Бактериальный вагиноз (БВ) – это дисбиотический процесс, проявление патологии экосистемы влагалища, вызванное усиленным ростом преимущественно облигатно-анаэробных бактерий. В современной литературе бактериальный вагиноз определяется как инфекционный невоспалительный синдром полимикробной этиологии, связанный с дисбиозом вагинального биотопа. Повышение количества аэробных и анаэробных бактерий с преобладанием последних объясняет название бактериальный, а отсутствие лейкоцитов (клеток, ответственных за воспаление) – вагиноз [1–3].
Нарушение микроэкологии влагалища при бактериальном вагинозе характеризуется резким снижением количества или отсутствием лактобактерий, продуцирующих перекись водорода, и увеличением количества Gardnerella vaginalis, грамотрицательных анаэробных бактерий (Bacteroides spp., Mobiluncus spp., Fusobacterium spp., Peptostreptoicoccus spp., M. hominis, U. Urealyticum) [4–7].
Основными клиническими проявлениями бактериального вагиноза являются гомогенные выделения из влагалища, пенистые, слегка тягучие, белого или серого цвета, с неприятным запахом. Длительность существования этих симптомов может исчисляться годами [8–11].
Одним из современных и доступных методов диагностики бактериального вагиноза является анализ микрофлоры влагалища методом real-time ПЦР (ПЦР в реальном времени фемофлор-16-17). Это исследование позволяет количественно и качественно оценить нормальную и условно-патогенную микрофлору, определить нарушения биоценоза влагалища, выявить дисбиоз (бактериальный вагиноз) [12–14].
Цель лечения бактериального вагиноза – восстановить нормальную микрофлору влагалища, задержать рост микроорганизмов, не свойственных этому вагинальному микроценозу.
БВ является показанием для применения 7-дезоксипроизводного линкомицина (клиндамицина), который ингибирует синтез белков в микроорганизмах, оказывает бактериостатическое или бактерицидное действие в зависимости от концентрации в макроорганизме и чувствительности микроорганизма. Препарат эффективен в отношении грамположительных микроорганизмов (стафилококков, стрептококков, пневмококков, палочки дифтерии), гарднерелл, микоплазм. Устойчивость микроорганизмов к клиндамицину вырабатывается медленно.
Лабораторный контроль эффективности терапии следует проводить через 7–10 дней после окончания этиотропного лечения [1].
Вместе с тем, при всех вышеперечисленных методах лечения возможны рецидивы, возникающие в различные сроки после лечения. По-видимому, это связано с тем, что подавляется рост не только условно-патогенных микроорганизмов, но и лактофлоры, а условий для ее восстановления недостаточно. В этой связи в комплекс лечения БВ необходимо включать препараты, содержащие лактобациллы или создающие условия для восстановления лактофлоры в течение не менее 10 дней после основного курса лечения. Специфическое действие этих препаратов направлено на восстановление нормального титра лактобацилл в вагинальном биотопе и предотвращение рецидивов данного заболевания [15, 16] .
К таким препаратам относятся пробиотики, представляющие собой гетерогенную группу непатогенных бактерий, содержащих лактобактерии и бифидобактерии. В соответствии с определением рабочей группы ВОЗ к ним относят живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина.

Применение пробиотиков после лечения антибиотиками способствует нормализации вагинальной микроэкологии и повышает эффективность стандартной терапии бактериального вагиноза, прежде всего за счет снижения риска последующих рецидивов [3, 16, 17].
Уникальной способностью блокировать механизм адгезии вредных бактерий обладает обогащенный экстракт алоэ барбаденсис 2QR-комплекс, входящий в состав геля актигель мульти-гин. Данное натуральное вещество добывают из лекарственных растений. Оно состоит из биоактивных полисахаридов и нейтрализует действие патогенов. Этот блокирующий эффект абсолютно безопасен и безвреден, так как он не обусловлен токсическими веществами или агрессивными химикатами и не обладает отрицательными побочными свойствами. Помимо основного свойства, позволяющего блокировать вредные бактерии, гель актигель мульти-гин укрепляет естественную восстановительную способность тканей и улучшает состояние слизистой оболочки.
Цель исследования: изучение эффективности и противорецидивной активности адъювантной терапии актигель мульти-гин при лечении БВ у женщин репродуктивного возраста. Задачи исследования: оценить эффективность препарата актигель мульти-гин для 2-го этапа лечения БВ; провести сравнительную оценку длительности ремиссии после терапии препаратом актигель мульти-гин и препаратом, содержащим бактерии Lactobacillus rhamnosus GR-1 и Lactobacillus reuteri RC-14; оценить безопасность применения препарата актигель мульти-гин.
Материал и методы исследования
Исследование проводилось в поликлиническом отделении ГБУЗ МО МОНИИАГ. В исследование включены 50 пациенток с клиническим диагнозом бактериальный вагиноз, подтвержденный анализом real-time ПЦР (ПЦР в реальном времени фемофлор-16). Возраст пациенток колебался от 18 до 45 лет (29,6±4,5 года). Проводилась клинико-лабораторная диагностика.
Критерии включения в исследование: пациентки в возрасте от 18 до 45 лет, наличие бактериального вагиноза, подписанное информированное согласие. Критерии невключения: наличие положительного ВИЧ-статуса; вирусные гепатиты В и С; злокачественное новообразование любой локализации в анамнезе; нарушения углеводного обмена; любые отклонения от референсных значений, установленные в клиническом и биохимическом анализах крови перед включением в исследование; любые другие клинически значимые острые и хронические заболевания. Критерии исключения из исследования: пациентки с выявленными Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium и Ureaplasma spp. в высоких титрах, Candida spp.
Методом случайной выборки пациентки были рандомизированы на две равные группы. Первую группу составили 25 пациенток, получавших клиндамицин крем в течение 10 суток по 1 дозе вагинально на ночь. Для второго этапа терапии использовали актигель по 2 мг 2 раза в день в течение 10 дней.
Вторую группу составили 25 пациенток, получавшие клиндамицин крем в течение 10 суток по 1 дозе вагинально на ночь. Для второго этапа терапии использовали препарат, содержащий бактерии Lactobacillus rhamnosus GR-1 и Lactobacillus reuteri RC-14 в течение 14 дней (табл. 1).
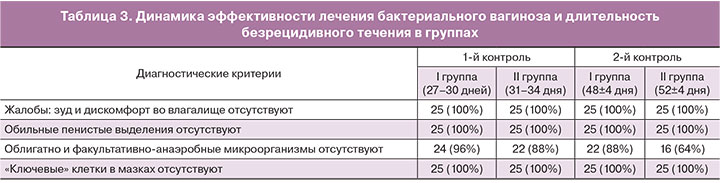
Для оценки эффективности терапии всем пациенткам, включенным в протокол, проводился тест real-time ПЦР (ПЦР в реальном времени фемофлор-16) на 7–10-й день с момента окончания лечения. Длительность безрецидивного периода в обеих группах оценивалась через 28 дней после окончания терапии тестом real-time ПЦР (ПЦР в реальном времени фемофлор-16) (табл. 2).
Критерии эффективности терапии:
- отсутствие жалобы на зуд во влагалище и обильные пенистые или желтоватые выделения с неприятным запахом;
- отсутствие объективных клинических признаков: обильных пенистых выделений;
- лабораторные показатели при микроскопическом исследовании – отсутствие ключевых клеток;
- при фемофлор-16 – отсутствие Gardnerella vaginalis, Atopobium vaginae, Ureaplasma spp., Mycoplasma hominis, Candida spp. и др.
Результаты исследования
По данным исследования эффективность лечения составила 92% (n=46). Длительность ремиссии в группе женщин, получавших адъювантную терапию препаратом актигель мульти-гин, составила 88% (n=22), в группе сравнения – 64% (n=16), p<0,5 (табл. 3).
Молекулярно-биологическое исследование выполнено всем 50 пациенткам. Согласно дизайну клинического исследования пациентки с выявленными Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium исключались из дальнейшего наблюдения. В отделяемом влагалища или в полости матки при включении в исследование не были выявлены также Mycoplasma hominis, однако у одной пациентки зафиксировано наличие Mycoplasma hominis в отделяемом из влагалища при втором после лечения исследовании (52±4 дня) влагалищной микробиоты методом фемофлор-16. У трех пациенток II группы при контрольном обследовании через 31–34 дня (n=3) и через 52±4 дня (n=5) выявлена Ureaplasma spp. (Ureaplasma urealyticum исключена при обследовании отделяемого цервикального канала методом ПЦР в реальном времени).
При включении в исследование Candida spp. были обнаружены у двух пациенток, однако при контрольных обследованиях качественная реакция на кандиды имела место в 9 (18,4%) случаях. Atopobium vaginae выявлен в 17 случаях (34,2%), причем через 52 дня после лечения элиминация данного инфекта отмечалась у 5 (14%) пациенток.
Как следует из полученных результатов, наличие Atopobium vaginae в вагинальном отделяемом является независимым прогностическим фактором рецидива заболевания. Достоверных данных по влиянию эффективности терапии в отношении элиминации Atopobium vaginae на продолжительность безрецидивного периода не получено.
Заключение
Инфекционно-воспалительные заболевания урогенитального тракта, включая бактериальный вагиноз, в том числе и при бессимптомном течении, представляют серьезную проблему для женщин репродуктивного периода. Одной из причин рецидивирующего течения воспалительных заболеваний урогенитального тракта наряду с качественными и количественными особенностями микробиоты являются особенности локального и/или системного иммунитета макроорганизма.
В нашей работе при динамическом исследовании отделяемого из влагалища из всех групп идентифицированных микроорганизмов только наличие Atopobium vaginae достоверно коррелировало со снижением «безрецидивного периода» бактериального вагиноза. В целом, применение дополнительной терапии (актигель мульти-гин) в пролонгированном режиме в качестве дополнения к этиотропной терапии было ассоциировано с увеличением периода «безрецидивного интервала» бактериального вагиноза. Добавление препарата актигель мульти-гин значительно улучшает результаты лечения. Препараты, содержащие пробиотики лактобактерий, также эффективны в комплексной терапии БВ, однако их эффективность основана на более длительном применении.
Таким образом, включение актигель мульти-гин в схему терапии бактериального вагиноза достоверно позволяет увеличить продолжительность безрецидивного периода за счет быстрого восстановления оптимальной кислотности влагалища (показатель pH) и роста численности полезных лактобактерий (молочнокислых бактерий), в результате чего создается оптимальная и естественная микрофлора, препятствующая возникновению бактериального вагиноза.



