Бактериальный вагиноз (БВ), или дисбиоз влагалища, является одним из наиболее распространенных вагинальных заболеваний, связанных с аномальными изменениями микробиома влагалища, которое может ассоциироваться с неблагоприятными исходами беременности [1, 2].
Нормальный биоценоз влагалища на 95% представлен аэробными и анаэробными лактобактериями, коринебактериями и бифидобактериями, анаэробными грамотрицательными палочками рода Fusobacterium и грамотрицательными кокками рода Veillonella. Благодаря действию бифидо- и лактобактерий слизистая оболочка влагалища обладает естественным защитным барьером, действующим против патогенных и условно-патогенных микроорганизмов [1, 3–5]. Их защитный механизм обусловлен адгезивными свойствами, посредством чего стимулируется работа иммунной системы, увеличивается выработка нейтрофилов, макрофагов, секретируются интерфероны и иммуноглобулины.
Характерная для влагалища кислотная среда образуется в результате переработки лактобактериями, содержащимися в эпителиальных клетках женщин, гликогена в молочную кислоту, продукции лизоцима и перекиси водорода, что является мощным защитным барьером верхнего полового тракта женщины, так как кислая среда влагалища подавляет рост патогенных и условно-патогенных микроорганизмов. В случае снижения уровня лактобацилл они замещаются, в первую очередь Gardnerella vaginalis [3–6].
Так, БВ – это синдром невоспалительного характера, причиной развития которого является дисбиоз влагалища, характеризующийся высокой концентрацией патогенных и условно-патогенных микроорганизмов в сочетании со сниженным количеством или отсутствием молочнокислых бактерий [1, 2, 4].
Во время беременности распространенность БВ достигает 30–40% [2, 3]. Факторы риска, способствующие развитию БВ, подразделяются на экзогенные и эндогенные. К первой группе относятся нарушение гигиены половых органов, использование внутриматочных контрацептивов, наличие более одного полового партнера, наличие заболеваний, передающихся половым путем, или иммунодефицитных состояний, лекарственная и лучевая терапия. Эндогенные факторы включают нарушение состава вагинальной микрофлоры, снижение кислотности вагинальной среды, атрофию и гипотрофию слизистой оболочки влагалища, наличие полипов и кист влaгалища. Другой важной причиной, приводящей к развитию БВ, является гормональная перестройка организма у беременных, которая обычно сопровождает период гестации [5–8].
Состояние иммунитета играет немалую роль в развитии БВ. Первая линия локальной защиты женских половых органов от патогенов представлена иммунной системой слизистых оболочек женских половых органов. Биологически активные молекулы, синтезируемые нейтрофилами, лимфоцитами, макрофагами слизистой оболочки влагалища, реализуют свое действие, выделяясь в цервикальную слизь [9–11].
При установленном диагнозе БВ только у 50% женщин выявляется клиническая картина, характеризующаяся беловато-серыми выделениями из влагалища, рыбным запахом из половых путей, рН влагалища >4,5, жжением и зудом, при отсутствии воспалительной реакции [2, 9, 12].
Для диагностики БВ созданы критерии Amsel и шкала Nugent [1, 2, 10]. Учитывая доступность и быстроту постановки диагноза согласно критериям Amsel, они чаще используются в клинической практике, чем подсчет баллов по шкале Nugent, основанной на окрашивании по Граму, при котором микрофлора рассматривается под микроскопом, разные микроорганизмы имеют свою балльную оценку, в соответствии с которой идентифицируют БВ. Так, от 0 до 4 баллов выставляется при обнаружении Lactobacillus spp., от 4 до 6 баллов – при идентификации Gardnerella vaginalis spp., Bacteroides spp., Mobiluncus spp., а аномальная микрофлора, содержащая большое количество анаэробных бактерий в отсутствие лактобактерий, оценивается в 7–10 баллов [13–16].
Для постановки диагноза БВ с учетом критериев Amsel должны присутствовать 3 критерия из следующих:
- значение рН вагинального отделяемого >4,5;
- выделения из влагалища – густые, гомогенные, беловато-серые, с неприятным запахом;
- положительный результат аминотеста;
- обнаружение «ключевых» клеток при микроскопическом исследовании вагинального отделяемого.
БВ является фактором риска осложнений беременности: преждевременных излития околоплодных вод и родов, хориоамнионита, эндометрита после кесарева сечения, самопроизвольных выкидышей, рождения детей с низкой массой тела, что подтверждается проведенными исследованиями по данной теме [11, 12, 15].
Проведение терапии БВ во время беременности является обязательным и способствует снижению гестационных и перинатальных осложнений [16, 17]. Формированию микрофлоры новорожденных способствует прохождение через родовые пути матери в первые часы жизни. В случае если кишечник будет заселен патогенными микроорганизмами, будет нарушаться колонизационная резистентность, способствующая нарушению функции кишечника, снижению адаптационных возможностей новорожденного и, как следствие, ухудшению его здоровья [18].
Успешные результаты лечения БВ достигаются благодаря своевременной и рациональной терапии: восстановление нормального микробиоценоза влагалища, коррекция иммунного статуса женщины [6, 7]. Согласно клиническим рекомендациям, терапия БВ проводится в 2 этапа. На первом этапе проводят подавление агрессивной микрофлоры с помощью противомикробных и антибактериальных препаратов (производные 5-нитроимидазола, клиндамицин) [1, 2, 18, 19]; на втором этапе – восстановление нормального микробиоценоза влагалища [19, 20].
Снижение иммунитета является ключевым фактором, способствующим хронизации заболевания, продлевающим длительность течения и усиливающим резистентность к проводимой терапии [3, 10, 12]. Иммунный ответ опосредован секрецией провоспалительных интерлейкинов (ИЛ), цитокинов, интерферонов (ИФН), фактора некроза опухоли (ФНО). Повышение продукции провоспалительных цитокинов приводит к хронизации течения патологического состояния, а избыточное отложение циркулирующих комплексов в тканях – к иммунопатологическим процессам [20, 21]. Для эффективной терапии БВ актуальной является нормализация функции иммунной системы; включение в терапию препаратов, обладающих иммуномодулирующим действием, является перспективным направлением [22].
Одним из иммуномодулирующих препаратов, разрешенных к использованию во время беременности, является «Суперлимф», представляющий собой естественный комплекс природных противомикробных пептидов и цитокинов – стимуляторов иммунной системы. Данный препарат повышает активность клеток врожденного иммунитета – моноцитов и нейтрофилов, активирует фагоцитоз, выработку противовоспалительных цитокинов, фактора, ингибирующего миграцию фагоцитов, трансформирующего фактора роста, регулирует миграцию клеток в очаг воспаления, усиливает активность естественных киллеров. Препарат снижает развитие воспалительных реакций, обладает антиоксидантной активностью, стимулирует регенерацию и эпителизацию раневых дефектов. Эффективность данного препарата неоднократно была продемонстрирована в клинических исследованиях [22, 23].
Одновременно с этиотропным лечением целесообразно назначать иммуномодулирующую терапию, так как комплексное лечение способствует более быстрому нивелированию клинических проявлений и стабилизации гуморального иммунитета. Учитывая вышеизложенное, интерес представляет поиск новых подходов к терапии БВ.
Цель исследования: представить собственный опыт комплексного лечения БВ.
Материалы и методы
Было проведено исследование, включающее 46 женщин с одноплодной беременностью, у которых был диагностирован БВ в гестационном сроке от 22 до 36 недель. Пациентки разделены на 2 группы:
- группа 1 – основная, состояла из 23 пациенток, получавших комплексное лечение антибактериальным препаратом и иммуномодулирующим средством «Суперлимф»;
- группа 2 – сравнения, включала 23 пациентки, получавших только антибактериальную терапию.
Диагноз БВ устанавливался на основании выявления 3 из 4 критериев Amsel. Степень тяжести БВ оценивали при помощи количественной шкалы Nugent (Nugent's Diagnostic Criteria for Bacterial Vaginosis 1991). От 0 до 3 баллов считается показателем нормального микробиоценоза влагалища, от 4 до 6 баллов – промежуточный тип микробиоценоза, 7 баллов и более – критерий БВ [2, 13].
Также тяжесть БВ оценивается с учетом клинических симптомов с использованием балльной шкалы: характер и количество выделений, зуд, жжение, боли при мочеиспускании, диспареуния.
Учитывая высокую биодоступность, антибактериальную активность, низкую частоту побочных явлений, лечение проводилось клиндамицином по схеме – крем 2% 5,0 г интравагинально 1 раз в сутки в течение 7 дней (на ночь). Иммуномодулирующая терапия проводилась препаратом «Суперлимф» 10 ЕД ректально по 1 суппозиторию 1 раз в сутки в течение 10 дней и в последующие 10 дней вагинально. Курс лечения начинали одновременно с антибактериальной терапией.
Все пациентки получили стандартное обследование в рамках клинических рекомендаций. Анализировались клинико-анамнестические показатели, эффективность лечения оценивалась на 11-й день от начала проведения терапии (контрольный визит), анализировалось микробиологическое и микроскопическое исследование отделяемого из влагалища, показатели pH влагалища, выраженность симптомов БВ. Для оценки иммуномодулирующей эффективности терапии определяли содержание провоспалительных цитокинов (ФНО-α, ИФН-γ, ИЛ-1α, ИЛ-6, ИЛ-8).
С целью оценки эффективности терапии в отношении возникновения рецидивов БВ все пациентки наблюдались в динамике в течение 3 месяцев после проведенного лечения.
Статистический анализ
При статистическом анализе использовали русифицированную версию Statistica 13.3, рассчитывали среднее значение и среднеквадратическое отклонение (M±SD). Статистически значимыми различия между группами считалась при значении p<0,05.
Результаты и обсуждение
В ходе проведенного исследования были получены данные о характере микробиоценоза влагалища. Представленную картину можно охарактеризовать, разделив микроорганизмы на 2 группы: «облигатная микрофлора», представленная лактобациллами и бактероидами, и «факультативная микрофлора», кокки и гарднерелла. Результаты комплексной оценки представлены в таблице 1.
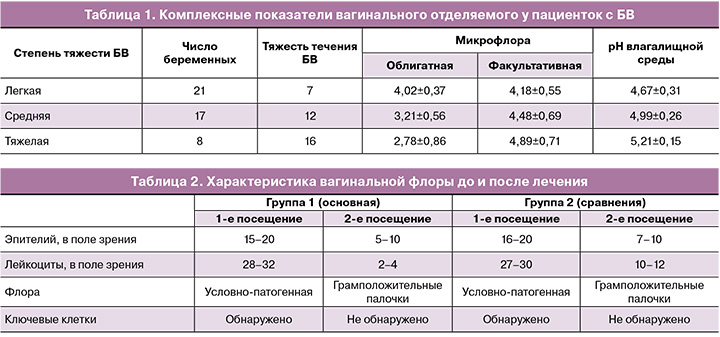
Представленные в таблице данные демонстрируют, что наиболее высокие баллы по облигатной микрофлоре отмечались при БВ легкой степени, наоборот, самые низкие – у беременных с тяжелой формой БВ. Наименьший показатель факультативной микрофлоры соответствовал группе легкой степени, при тяжелом БВ данный показатель был наибольшим. Уровень факультативной микрофлоры положительно коррелировал с тяжестью БВ, тогда как облигатная микрофлора имела обратную корреляционную связь. Самый низкий показатель рН фиксировался при легком течении БВ, а наибольшее значение рН характеризовало пациенток с тяжелым течением БВ. Таким образом, показатели рН влагалищной среды имеют прямую взаимосвязь с тяжестью клинического течения БВ.
На фоне проведенной терапии были получены значимые результаты; при этом стоит отметить, что не зафиксировано ни одной беременной, предъявляющей жалобы, связанные с приемом лекарственных препаратов; пациентки обеих групп проявили высокую приверженность к проводимому лечению. В группе 1 исследования при втором визите к врачу ни одна из женщин не предъявляла жалобы на выделения и неприятный запах из влагалища, дискомфорт и зуд в области промежности. Однако в группе 2 исследования в 3 случаях терапия оказалась недостаточно эффективной в отношении БВ; женщины предъявляли те же жалобы, что и до лечения, но клинически менее выраженные. На фоне проведенного лечения у пациенток обеих групп наблюдалась нормализация значения pH влагалища, составлявшего <4,5.
При оценке вагинальной флоры были получены следующие результаты: в мазках в 1-й и 2-й группах до лечения отмечались выраженное количество ключевых клеток, характерное для БВ, лейкоцитоз, повышенное число эпителиальных клеток. На фоне лечения в обеих группах отмечалось снижение количества эпителиальных клеток, лейкоцитов, ключевые клетки после лечения не выявлялись. Однако в 1-й группе исследования на фоне комбинированной терапии улучшение было более значительным, что отображено в таблице 2.
Характер микробиологической картины отделяемого из влагалища и состав наиболее часто встречающихся микроорганизмов представлены в таблице 3. В обеих группах исследования на фоне проводимой терапии наблюдалось снижение титра микроорганизмов, однако во 2-й группе, несмотря на проведенное лечение, в 17,4% случаев (n=4) средний титр Gardnerella vaginalis имел значение >104 КОЕ/мл. Отображением эффективности проводимой терапии в обеих группах являлся рост Lactobacillus spp., при этом в 1-й группе значение данного микроорганизма было более высоким, хотя и не имело статистически значимой разницы между группами исследования. Следует отметить, что после лечения микрофлора влагалища у беременных основной группы по данным микробиологического обследования соответствовала показателям у здоровых беременных. Представленные данные характеризуют комбинированную терапию антибактериальным препаратом с иммуномодулирующим средством как наиболее эффективный вариант лечения БВ.
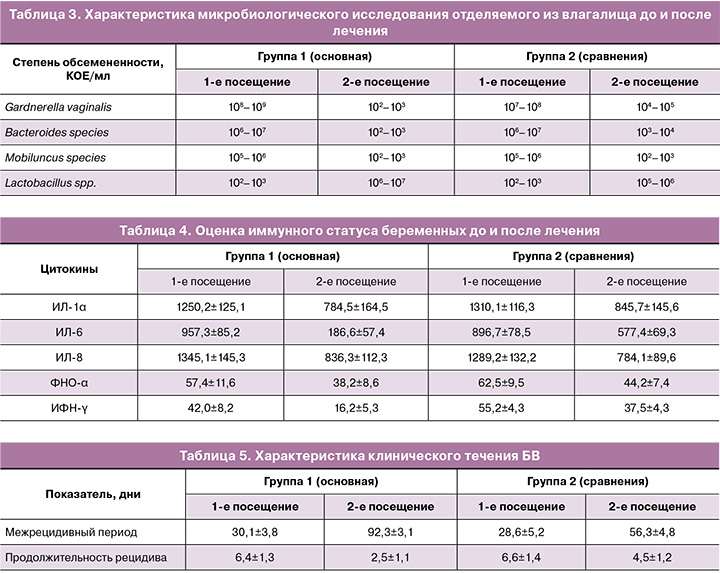
При обследовании пациенток обеих групп были выявлены признаки специфического иммунодефицита, опосредованного персистированием патогенных микроорганизмов. Уровни провоспалительных цитокинов на этапе, предшествующем медикаментозному лечению в обеих группах, были равнозначными. При анализе влияния проводимой терапии в основной группе отмечалось статистически значимое снижение уровня провоспалительных цитокинов до нормальных величин. Данные продемонстрированы в таблице 4.
Анализ полученных результатов показал, что содержание провоспалительных цитокинов в отделяемом из влагалища у беременных на фоне терапии, включающей иммуномодулирующий препарат, значимо ниже, чем в группе сравнения.
При наблюдении за всеми пациентками в течение 3 месяцев после проведенного лечения (в том числе, после родоразрешения) оценивались период между возникновением рецидивов и продолжительность рецидива. Данные полученных результатов отображены в таблице 5.
Данные, представленные в таблице 5, демонстрируют эффективность проведенного лечения в обеих группах исследования, однако в группе 1 длительность межрецидивного периода была значимо выше по сравнению с группой 2, а продолжительность рецидива – ниже.
Также в рамках исследования были оценены акушерские и перинатальные исходы. В группе 1 своевременные роды произошли в 21/23 (91,3%) случае, преждевременные – в 2/23 (8,7%); в группе 2 своевременные роды были у 18/23 (78,3%) женщин, а преждевременные – у 5/23 (21,7%).
В основной группе роды осложнялись преждевременным излитием околоплодных вод в 4/23 (17,4%) случаях, в группе сравнения – в 7/23 (30,4%). Средний объем кровопотери при самопроизвольных родах в 1-й группе был ниже, чем в группе сравнения, и составил 256,4±38,4 мл против 278±42,1 мл, соответственно. Средняя длительность своевременных родов в 1-й группе составила 7 ч 46 минут±1 ч 10 минут, во 2-й группе – 10 ч 34 минут±1 ч 28 минут.
Что касается перинатальных исходов, гестационный возраст новорожденных был от 35 до 41 недели беременности. В группе 1 оценка состояния по шкале Апгар варьировалась от 7 до 9 баллов, в группе 2 – от 6 до 9 баллов. Количество недоношенных детей соответствовало числу преждевременных родов в каждой группе. Масса доношенных новорожденных в среднем составила 3346±54 г, недоношенных – 2457±43 г. Асфиксия новорожденных наблюдалась в 3/23 (13%) случаях 1-й группы и в 6/23 (26%) случаях 2-й группы исследования. Кроме того, чаще (р<0,05) в группе 2 – 6/23 (26,1%) по сравнению с группой 1 – 2/23 (8,7%) дети рождались с признаками внутриутробной инфекции.
Представленные данные по акушерским и перинатальным исходам, при которых наиболее благоприятные результаты соответствуют 1-й группе исследования, отображают эффективность терапии БВ антибактериальным препаратом в комбинации с Суперлимфом.
Заключение
Схемы терапии БВ хорошо известны, однако не всегда имеют высокую эффективность, особенно в гестационном периоде, когда женский организм подвержен гормональным и иммунным изменениям. В этом случае целесообразность и эффективность в ходе проводимого исследования доказало комплексное лечение данной категории женщин. Наши данные показали более значимые результаты при оценке не только клинических проявлений заболевания, но и лабораторных данных. По нашему мнению, иммуномодулирующий препарат «Суперлимф» целесообразно использовать в комбинации с антибактериальным средством при лечении БВ во время беременности.



