Выявление лиц, подверженных риску возникновения рака, и его ранняя диагностика являются одним из перспективных направлений онкологии. Усовершенствование современных методов лечения, безусловно, приносит определенные плоды – пятилетняя выживаемость онкологических больных достигла достаточно высокого уровня. Но, к сожалению, остается категория пациенток, которым мы не в силах помочь. Вероятно, возможности современной медицины достигли определенного предела, и улучшения результатов лечения ждать в ближайшее время не приходится. Для решения этих вопросов целесообразно рассмотреть роль скрининга в выявлении начальных форм злокачественных опухолей. Прежде всего, необходимо четко понимать, чем скрининг отличается от ранней диагностики. При ранней диагностике пациент уже предъявляет какие-либо жалобы и по своей инициативе обращается за медицинской помощью. Под скринингом в медицине подразумевают метод активного выявления лиц с какой-либо патологией или факторами риска ее развития, основанный на применении специальных диагностических исследований, включая тестирование, в процессе массового обследования населения или его отдельных контингентов [1]. На сегодняшний день во многих цивилизованных странах на государственном уровне действуют различные скрининговые программы, позволяющие выявлять ранние формы заболеваний.
В онкологии известны 4 скрининговые программы, которые зарекомендовали себя с положительной стороны. Это маммографический скрининг для выявления рака молочной железы, тест на скрытую кровь для выявления предрака и рака толстой кишки, тест на PSA (простатический специфический антиген) для выявления рака предстательной железы, цитологический скрининг для выявления патологии шейки матки.
Нам показалось своевременным и актуальным подробнее остановиться на цитологическом скрининге предрака и рака шейки матки (РШМ). По данным ВОЗ, ежегодно в мире выявляется 529,4 тыс. вновь заболевших РШМ и 274,9 тыс. из них умирает [2]. В России за последние десятилетия прирост заболеваемости РШМ составил 15,3%, а летальность в течение первого года с момента установления диагноза в 2010 г. составила 20,9% [2], то есть от РШМ в течение первого года умирает практически каждая пятая заболевшая женщина! Изменилась и структура заболевания. В России средний возраст заболевших РШМ снизился в среднем на 6 лет (с 58 лет до 52 лет в 2010 г.) [2]. При этом необходимо отметить, что РШМ в России стал основной причиной смертности у женщин в возрастной группе 30–34 лет, то есть у женщин репродуктивного возраста. Поэтому с сожалением вынуждены отметить, что частота встречаемости РШМ и беременности на сегодняшний день в нашей стране составляет 5% [3].
Вместе с тем, РШМ является одной из немногочисленных нозологических форм злокачественных новообразований, которые могут быть выявлены на ранних стадиях путем проведения популяционного скрининга, поскольку это заболевание широко распространено, имеет распознаваемую преклиническую фазу, длительный период развития и, что особенно важно, на сегодняшний день существует надежный скрининг-тест – цитологическое исследование мазков, взятых с экто- и эндоцервикса.
Впервые уникальные возможности цитологического исследования для ранней диагностики РШМ показал Папаниколау в 40-х годах прошлого столетия. Он предположил, что если с помощью цитологического метода обследовать всех женщин, то можно выявлять РШМ в преклинической фазе, что позволит излечить больных «сберегательными» методами и сократить сроки лечения, сохранить фертильность, снизить случаи инвалидизации и смертности, что имеет еще и большое экономическое значение.
Впервые цитологический скрининг РШМ стал проводиться в канадской провинции Британская Колумбия с 1949 г. Затем программы скрининга РШМ начали реализовываться в других странах мира – в США, Китае, Японии, Финляндии и др. С начала введения скрининговых программ накоплен большой опыт. Критериями оценки эффективности скрининга являются снижение показателей заболеваемости и, особенно, смертности от РШМ, а также изменение структуры заболеваемости за счет увеличения количества ранних стадий рака и уменьшения запущенных форм.
В нашей стране цитологический метод исследования при массовых профилактических гинекологических осмотрах стали применять с 1964 г., а с 1977 г. на основании приказа Минздрава СССР № 1253 от 30.12.1976 г. была создана сеть централизованных цитологических лабораторий. Однако с развалом «советской» системы диспансеризации, последовавшим за распадом СССР в 1991 г., практически полностью прекратила существование созданная повсеместно сеть смотровых кабинетов, осуществлявших цитологический скрининг почти всего женского населения страны. На сегодняшний день в России нет четкой программы организованного цитологического скрининга РШМ. Приказами Министерства здравоохранения регламентированы лишь общие положения о целесообразности проведения ежегодных профилактических осмотров женщин. Профилактическое обследование должно носить массовый поточный характер, и только в этом случае можно существенно повысить раннюю выявляемость патологии шейки матки и улучшить результаты лечения.

Эффективность скрининга зависит от уровня охвата женского населения, возраста женщин, межскринингового интервала. В большинстве цивилизованных стран скринингу подвержено от 75 до 90% женского населения. При этом вероятность выявления инвазивного РШМ у женщин снижается примерно в 5 раз [4].
До сих пор остается открытым вопрос о периодичности проведения скрининга, в связи с тем, что в разных странах приняты различные межскрининговые интервалы. В идеале скринингу РШМ рекомендуют подвергать женщин в возрасте 25–65 лет ежегодно первые 2 года, а затем при отрицательных результатах – каждые 3 года (ВОЗ). Однако нам кажется целесообразным оговаривать возраст начала проведения скрининга для каждой страны отдельно с учетом среднего возраста полового дебюта.
Эффективность скрининга подтверждена длительными наблюдениями за популяциями Скандинавских стран. За 40 лет, в течение которых проводились скрининговые программы, снизился уровень смертности от этого заболевания в Исландии на 80% и в Финляндии на 50%. В этих странах благодаря массовому скринингу женского населения частота запущенных форм РШМ не превышает 4% [4].
Для наглядности отметим, что пятилетняя выживаемость больных начальным РШМ составляет 88%, а при распространенных формах (III и IV ст.), несмотря на проводимые современные комбинированные и комплексные методы терапии, выживаемость едва достигает 13%. При этом лечение больных РШМ только I стадии в развитых странах обходится примерно в 19 млрд долларов ежегодно. Стоимость программы цитологического скрининга составляет 60 тыс. долларов, что значительно меньше за один сохраненный год жизни. Стоимость программы цитологического скрининга и исследования на HPV – 81 тыс. долларов за один сохраненный год жизни [4].
Скрининг РШМ предусматривает 3 этапа:
- I этап (популяционный скрининг) – деление на подгруппы здоров/болен на основании визуальных осмотров;
- II этап (диагностический скрининг) – деление на подгруппы по степени онкологического риска на основании данных дообследования: фоновые заболевания, предрак, рак;
- III этап – формирование групп диспансерного наблюдения для мониторинга и коррекции по нозологическому принципу.
Скринингу не подлежат женщины, у которых уже выявлены заболевания женских половых органов, и они состоят на учете у врача-гинеколога или онкогинеколога.
Весьма важным фактором эффективности скрининга РШМ является чувствительность цитологического исследования. Она составляет от 60 до 85%. В большинстве наблюдений причина ложноотрицательных цитологических ответов обусловлена некачественным забором материала для исследования. Это и недостаточное количество эпителиально-клеточного материала в мазке, неравномерное распределение биологического материала на стекле, неполное прокрашивание клеточного материала, связанное с его многослойностью (толстый мазок), большое содержание слизи, элементов воспаления и периферической крови, высокая частота артефактов по причине высыхания препарата после взятия мазка (отсутствие влажной фиксации).
На сегодняшний день появилась новая стандартизированная технология приготовления цитологического препарата – жидкостная цитология [5]. Компьютеризированная система скринига РШМ на основе жидкостной цитологии способствует повышению чувствительности цитологического метода, снижению временных затрат и повышению производительности цитологической лаборатории. Жидкостная цитология рекомендована в качестве «золотого стандарта» диагностики патологии шейки матки.
В настоящее время используют 3 цитологические классификации цервикальных мазков: по Папаниколау (Пап-тест, Pap-smear, Pap-мазок), ВОЗ, Bethesda System (таблица).
Классификация по Папаниколау:
- I класс – нормальные клетки;
- II класс – воспалительный тип мазка;
- III класс – дискариоз, морфологические изменения эпителиальных клеток;
- IV класс – атипические клетки, подозрительные в отношении злокачественности;
- V класс – злокачественные изменения клеток.
Классификация ВОЗ (Cervical intraepithelial Neoplasia):
- CIN I – легкая цервикальная дисплазия;
- CIN II – умеренная дисплазия;
- CIN III – тяжелая дисплазия.
Основным этиологическим фактором патогенеза РШМ считается инфицирование вирусом папилломы человека (ВПЧ) высокой степени онкогенного риска [6]. На сегодняшний день самой высокой чувствительностью обладает ВПЧ Digene (Дайджен)-тест. Данный анализ позволяет выявить ВПЧ, определить его тип и принадлежность к высокоонкогенной или низкоонкогенной группе, зафиксировать клинически значимые концентрации в тканях, что позволяет оценить риск развития РШМ. Необходимо подчеркнуть, что при выявлении РШМ цитологическое исследование и ВПЧ-тестирование ни в коей мере не исключают, а, наоборот, взаимно дополняют друг друга.
Однако окончательный диагноз патологического стояния шейки матки может быть установлен только на основании гистологичекого исследования. Для этого проводят кольпоскопию – методичный осмотр нижнего отдела генитального тракта под увеличением и хорошим освещением. Кольпоскопия не является скрининговым тестом, выполняется по определенным показаниям, дополняет цитологический метод и ВПЧ-тестирование для верификации диагноза. Кольпоскопия позволяет выявить пораженные участки шейки матки (дисплазию, начальные формы рака), дифференцировать их от нормы и произвести прицельную биопсию. При этом чувствительность метода составляет 87–99%, а специфичность – 23–87%.
 Кроме того, для успешной реализации программы скрининга РШМ необходимо познание основных принципов онкологической помощи, организации лечения в сети специализированных онкологических учреждений и быстрое направление по назначению больного с подозрением на опухоль.
Кроме того, для успешной реализации программы скрининга РШМ необходимо познание основных принципов онкологической помощи, организации лечения в сети специализированных онкологических учреждений и быстрое направление по назначению больного с подозрением на опухоль.
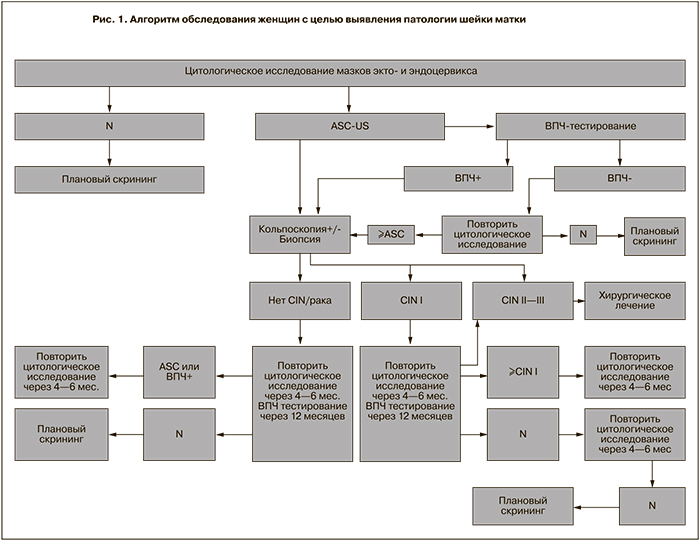
Нам бы хотелось предложить алгоритм выявления предрака и РШМ в условиях нашей страны (цитологический скрининг и ВПЧ-тестирование) (рис. 1).
Скринингу РШМ рекомендуется подвергать женщин начиная с 18 лет или с момента начала половой жизни. Возраст окончания скрининга 65 лет. После 65 лет показания для скрининга для каждой женщины определяются индивидуально. Интервалы скрининга: первые 2 года ежегодно, затем каждые 3 года.
В обязательном порядке рекомендуется проводить цитологическое исследование и ВПЧ-тестирование с количественной оценкой концентрации вируса всем женщинам при планировании беременности или при первичном обращении к гинекологу по поводу наступившей беременности. При нормальных результатах цитологического исследования и высоких концентрациях вируса рекомендуется повторное обследование через 2 месяца.
В обязательном порядке рекомендуется проводить цитологическое исследование и ВПЧ-тестирование с количественной оценкой концентрации вируса всем женщинам через 2–3 мес. после беременности (роды или аборт). При нормальных результатах цитологического исследования и высоких концентрациях вируса рекомендуется повторное обследование через 4–6 мес.
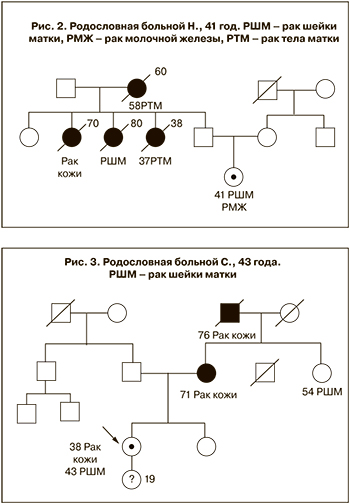
И, наконец, говоря о скрининге, к сожалению, следует признать, что еще один немаловажный аспект упущен из поля зрения онкологов. Принято считать, что значительную роль в онкологической заболеваемости играет наследственность. Это практически доказанный факт. Рак молочной железы, рак яичников, рак тела матки, рак толстой кишки, рак щитовидной железы – вот далеко не полный перечень наследственных форм заболеваний, профилактика которых уже приносит свои плоды. Что же касается РШМ, то долгое время считалось, что эта патология не является наследственным заболеванием, однако в последние годы были описаны ранее неизвестные наблюдения семейного накопления РШМ и опухолей других локализаций [7]. Было выдвинуто предположение, что, вероятно, существуют еще малоизученные самостоятельные наследственные синдромы семейного рака, такие как: синдром наследственного рака брюшины/яичников/шейки матки, а также синдром рака молочной железы/эндометрия/яичников/толстой кишки/шейки матки. Одним из таких примеров может служить родословная больной Н., представленная на рис. 2.
Конечно, вышеописанные наблюдения достаточно редки, но следует признать необходимость оценки этих случаев с учетом явного влияния наследственности на онкологическую заболеваемость в целом.
Кроме того, необходимо отметить, что до последнего времени мало кто принимал во внимание взаимосвязь плоскоклеточного рака и семейного предрасположения к новообразованиям этого гистогенеза. На сегодняшний день хорошо известна роль ВПЧ инфекции в канцерогенезе плоскоклеточного рака таких локализаций как: мягкое небо, основание языка, небные миндалины, глотка и гортань, носовая полость, конъюнктива, кожа, влагалище/вульва, половой член, анус, пищевод, легкие, мочевой пузырь [8]. Однако в клиниках ФГБНУ РОНЦ им. Н.Н. Блохина были получены весьма неожиданные результаты, свидетельствующие о предрасположенности к плоскоклеточному раку различных анатомических локализаций у одних и тех же больных. Были выявлены
36 пациенток с плоскоклеточным РШМ, у которых возникшая вторая опухоль (практически каждое 6 наблюдение) была представлена также плоскоклеточным раком, что, вероятно, связано с единой вирусной этиологией – с ВПЧ, являющимся причиной полинеоплазий:
- РШМ + рак кожи – 15 наблюдений;
- РШМ + рак легких – 7 наблюдений;
- РШМ + рак тела матки – 2 наблюдения;
- РШМ + рак вульвы – 9 наблюдений;
- РШМ + рак небной миндалины – 2 наблюдения;
- РШМ + рак толстой кишки – одно наблюдение.
Не менее интересным как с теоретической, так и с практической точек зрения нам представляются наблюдения, свидетельствующие о накоплении в семьях опухолей плоскоклеточного строения различных органов. По нашим данным в семьях рак аналогичного строения наблюдается у 30% больных плоскоклеточным РШМ (рак легкого, рак гортани, рак толстой кишки, рак кожи). Поэтому больных плоскоклеточным РШМ, пожалуй, следует относить к «группе риска» по развитию аналогичного рака других локализаций (рис. 3).
Заключение
Таким образом, с нашей точки зрения, традиционный комплексный подход с использованием скрининга, а также создание групп наследственного риска по возникновению РШМ позволит значительно расширить уже имеющиеся возможности по улучшению общей выживаемости больных этой патологией.



