Ворсины хориона плаценты имеют внешнюю оболочку из синцитиотрофобласта, под которым находится один слой клеток цитотрофобласта [1]. Синцитиотрофобласт представляет собой единую многоядерную структуру, покрывающую плодовые клетки и первым инвазирующим в матку [2]. Клетки синцитиотрофобласта выполняют трофическую функцию до установления гематотрофного типа питания, а также выполняют такие функции, как обмен кислородом, питательными веществами между организмом матери и плодом, выведение метаболитов, синтез гормонов, формирование иммунологической толерантности, защита сосудистой системы плода [3]. Трофобласт в первом триместре дифференцируется в несколько морфологически и функционально различных типов клеток. При этом основной характеристикой трофобласта первого триместра является высокая степень его пролиферации, миграции и инвазии в децидуальную оболочку. Надзор за пролиферацией и миграцией трофобласта, их ограничение и регуляцию осуществляют клетки плаценты, а также клетки иммунной системы матери, локализованные в децидуальной оболочке. Цитокины, ростовые факторы и ферменты, секретируемые в плаценте клетками трофобласта, клетками плаценты и децидуальной оболочки, оказывают паракринное и аутокринное влияние на функциональную активность трофобласта и их взаимодействие с клетками микроокружения. Эти взаимодействия лежат в основе контроля развития плаценты, ограничения избыточного роста и поддержания иммунологической толерантности в системе мать-плод. В третьем триместре беременности на первый план выступают механизмы, ограничивающие пролиферацию и миграцию клеток трофобласта при одновременном поддержании их жизнеспособности, ведущую роль в которых играют клетки микроокружения, в том числе децидуальные NK-клетки и макрофаги материнского происхождения. Полагают, что эти механизмы связаны с изменением цитокинового профиля в зоне маточно-плацентарного контакта.
В настоящее время достаточно полно описана продукция цитокинов плацентой как при физиологической беременности, так и при различных акушерских патологиях, включая преэклампсию [4]. Вместе с тем остаются недостаточно изученными механизмы, обеспечивающие поддержание функциональной активности при одновременном ограничении пролиферации трофобласта в третьем триместре физиологической беременности. Нарушение иммунологической толерантности в системе мать-плод и сбалансированной продукции цитокинов клетками микроокружения в зоне маточно-плацентарного контакта, а также связанная с этим неадекватная инвазия трофобласта лежат в основе таких осложнений беременности, как преэклампсия и привычное невынашивание. Однако в настоящее время недостаточно данных об изменении функциональной активности клеток трофобласта, не созданы модели, отражающие влияние факторов, секретируемых плацентой при преэклампсии на пролиферацию и миграцию клеток трофобласта.
Целью настоящего исследования стало изучение пролиферации и миграции клеток трофобласта линии JEG-3 в присутствии факторов, секретируемых плацентой в третьем триместре при физиологической беременности и при преэклампсии.
Материал и методы исследования
Культура клеток. Использовали клетки трофобласта линии JEG-3, полученные из Американской коллекции типовых культур (ATCC, США), воспроизводящие основные характеристики трофобласта [5]. Их культивировали в среде DMEM с добавлением 10% инактивированной эмбриональной телячьей сыворотки (ЭТС), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина, 0,5 мМ L-глутамина, 1 мл MEM, 1 мМ пирувата натрия (Sigma, США). Дезинтеграцию монослоя клеток для пересева осуществляли раствором версена и раствора трипсина, смешанных в соотношении 1:1. Пересев клеток осуществляли 3 раза в неделю. При помощи раствора трипанового синего оценивали жизнеспособность клеток, при этом она составляла не менее 96%.
Культивирование фрагментов плацент. Использовали плаценты женщин, у которых беременность протекала без осложнений на сроке 38–39 недель (n=32, группа 1), плаценты женщин с беременностью, осложненной преэклампсией на сроке 38–39 недель (n=34, группа 2). Получено информированное согласие пациенток на обследование плаценты.
Фрагменты плацентарной ткани из центральной части плаценты культивировали в питательной среде DMEM без добавления ЭТС в течение 24 ч. Затем кондиционированные среды собирали и замораживали при температуре -20˚С до исследования.
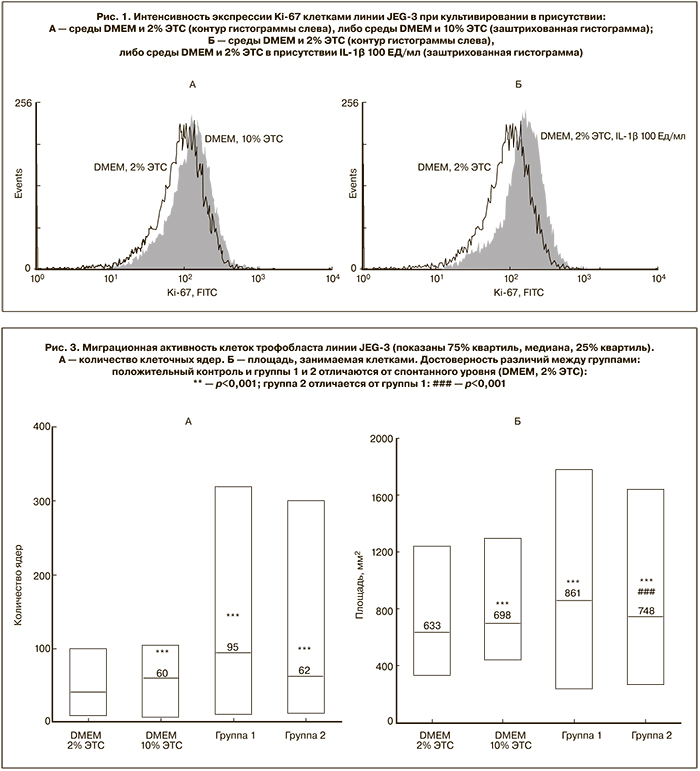
Пролиферативную активность клеток трофобласта линии JEG-3 оценивали при помощи метода, основанного на окраске белковых компонентов цитоплазмы клеток витальным красителем кристаллическим фиолетовым. Указанный метод по чувствительности сопоставим с другими методами оценки пролиферативной активности. Клетки линии JEG-3 помещали в лунки 96-луночного плоскодонного планшета для адгезионных культур (Sarstedt, Австрия) в концентрации 4000 клеток на лунку в 100 мкл среды DMEM c добавлением 2% ЭТС (Sigma, США) и культивировали сутки при 37˚С во влажной атмосфере и 5% СО2 для прикрепления их к поверхности планшета. Вносили кондиционированные среды плацент в различных разведениях, приготовленных на среде DMEM, 2% ЭТС и инкубировали 72 часа. Затем определяли жизнеспособность клеток при помощи раствора трипанового синего, она составила 95–96%. После этого клетки линии JEG-3 окрашивали 0,2% раствором кристаллического фиолетового (Sigma, США), содержащего 5% метанола, для чего в каждую лунку вносили краситель в объеме 100 мкл на лунку и инкубировали 10 минут. Затем отмывали лунки 4 раза дистиллированной водой, высушивали и экстрагировали краситель 10% раствором уксусной кислоты. Учет оптической плотности раствора проводили на микропланшетном ридере «Labsystems» (Финляндия), длина волны 540 нм. По изменению оптической плотности раствора оценивали интенсивность пролиферации клеток линии JEG-3. Контролем служили показатели пролиферативной активности после инкубации клеток в среде DMEM, 2% ЭТС; положительным контролем служила их инкубация в среде DMEM, 10% ЭТС, а также в среде DMEM, 2% ЭТС и 100 ЕД/мл IL-1β. Эксперименты проведены трижды, для каждого разведения кондиционированных сред плацент получено 9 значений оптической плотности. Для подтверждения данных, полученных указанным выше методом, дополнительно оценивали пролиферативную активность клеток линии JEG-3 в присутствии IL-1β (R&D, USA) в концентрации 100 ЕД/мл при помощи метода, основанного на оценке экспрессии ядерного белка Ki-67. Для этого клетки помещали в лунки 6-луночного плоскодонного планшета в концентрации 5×105 клеток на лунку в 5 мл среды DMEM, 10% ЭТС. Для синхронизации клеточного цикла в фазе G0/G1 клетки инкубировали в присутствии 9мМ афидиколина (Sigma, США) 48 часов (37˚С, 5% СО2, влажная атмосфера). Затем меняли среду и культивировали 18 часов с среде DMEM, 2% ЭТС и 100 ЕД/мл IL-1β без афидиколина. После инкубации клетки линии JEG-3 снимали с поверхности планшета раствором версена, центрифугировали 3 минуты, 5000g и отбирали надосадочную жидкость. Фиксацию клеток в 70% растворе этанола обрабатывали моноклональными антителами против белка Ki-67(FITC) и раствором propidium iodide в соответствии с указаниями производителя (BD, США). Анализ экспрессии Ki-67 проводили на проточном цитофлуориметре BD FACS CantoII (BD, США). Контролем служили показатели экспрессии Ki-67 после инкубации клеток в среде DMEM, 2% ЭТС; положительным контролем служила их инкубация в среде DMEM, 10% ЭТС (рис. 1A). В качестве контроля неспецифического связывания антител использовали изотипические антитела в соответствии с указаниями производителя (BD, США).

Миграционную активность клеток трофобласта линии JEG-3 оценивали при помощи метода с использованием вставок для 24-луночных планшетов с поликарбонатным фильтром (размер пор 8 мкм, BD, США). Клетки линии JEG-3 вносили в количестве 1,5×105 клеток в среде DMEM, 2% ЭТС в верхнюю камеру вставки, в нижнюю – секреторные продукты плацент, разведенные средой DMEM в соотношении 1:1. Перед внесением секреторных продуктов плацент в течение 3 ч клетки линии JEG-3 инкубировали в поликарбонатных вставках при 37˚С, 5% СО2 для осаждения клеток. Контролем служили показатели миграционной активности после инкубации клеток линии JEG-3 в среде DMEM, 2% ЭТС; положительным контролем служила их инкубация в среде DMEM, 10% ЭТС, а также инкубация в среде DMEM, 2% ЭТС в присутствии bFGF в концентрации 1 нг/мл (рис. 2 см. на вклейке). После инкубации в течение 20 часов при 37˚С, 5% СО2 клетки фиксировали на поверхности фильтра поликарбонатных вставок в 70% растворе этилового спирта с последующей окраской гематоксилином Майера. Клетки с верхней части фильтра удаляли с помощью ватного диска. Для подсчета мигрировавших клеток проводили фотофиксацию клеток на фильтре со стороны нижней камеры с использованием микроскопа AxioObserver.Z1 (Zeiss, Германия). Каждый эксперимент повторили трижды, в каждой лунке выбирали не менее 8 полей зрения. В программном продукте Axio Vision (Carl Zeiss, Германия) проводили оценку относительного количества ядер мигрировавших клеток и площади, занимаемой мигрировавшими клетками.
Статистическую обработку данных производили в программе AtteStat 12.1.7, используя методы описательной и непараметрической статистики (критерий Манна–Уитни).
Результаты исследования
Средний возраст беременных не различался: в группе с преэклампсией – 29,2 года (95% ДИ 24,3–34 года), в контрольной – 30,8 года (95% ДИ 26,5–34,95 года) (p>0,05). Обследуемые группы были сопоставимы по паритету беременности и родов. У 23 (67,65%) беременных имелась умеренная преэклампсия, у 11 (32,35%) – тяжелая. Закономерным осложнением гестации у женщин с преэклампсией стало развитие хронической плацентарной недостаточности, которая диагностирована в 22 (64,7%) случаях. В группе сравнения данного осложнения не выявлено (p<0,0001). Все беременные обследуемых групп были родоразрешены путем операции кесарева сечения до начала родовой деятельности. Показания к операции в группе с преэклампсией в основном были сочетанными: у 14 (41,18%) – отсутствие стойкого эффекта от терапии преэклампсии, у 12 (35,3%) – наличие хронической плацентарной недостаточности, у 4 (11,76%) – неблагоприятный тип рубца на матке после предыдущей операции кесарева сечения по данным ультразвукового исследования, у 4 (11,76%) – длительное бесплодие в анамнезе, применение вспомогательных репродуктивных технологий. В группе женщин с физиологической беременностью показаниями к оперативному родоразрешению были: миопия высокой степени с периферической хориоретинальной дистрофией сетчатки – у 20 (62,5%), ультразвуковые признаки неблагоприятного типа рубца на матке после предыдущей операции кесарева сечения – у 12 (37,5%). Все операции в данной группе были выполнены в плановом порядке.
Всего родилось 66 живорожденных детей. Средний вес новорожденных при физиологической беременности составил 3334 г (95% ДИ 3198–3470 г) и достоверно отличался от показателей группы с преэклампсией – 2980 г (95% ДИ 2630–3081 г) (p=0,032). Такая же тенденция наблюдалась при средней оценке показателей состояния детей по шкале Апгар: контрольная группа – 8,14 (95% ДИ 7,89–8,34), преэклампсия – 7,21 (95% ДИ 7,05–7,74) (p=0,012).
Инкубация клеток трофобласта линии JEG-3 в среде DMEM с добавлением 10% ЭТС стимулировала их пролиферативную активность по сравнению со спонтанным уровнем (инкубация в среде DMEM с 2% ЭТС) (таблица).
По данным метода оценки пролиферации, основанного на окраске белковых компонентов цитоплазмы клеток витальным красителем кристаллическим фиолетовым (таблица), а также метода, основанного на внутриклеточной окраске белка Ki-67 (рис. 1), IL-1β в концентрации 100 Ед/мл оказывал стимулирующее действие на пролиферативную активность клеток линии JEG-3 по сравнению со спонтанным уровнем.
Кондиционированные среды плацент женщин всех исследованных групп в разведении 1:1 снижали пролиферацию клеток трофобласта линии JEG-3 по сравнению со спонтанным уровнем (таблица). При этом ингибирующий эффект кондиционированных сред плацент женщин с беременностью, осложненной преэклампсией на сроке 38–39 недель (группа 2) был сравним с эффектом кондиционированных сред плацент женщин с физиологической беременностью на сроке 38–39 недель (группа 1).
Кондиционированные среды плацент женщин с физиологической беременностью на сроке 38–39 недель (группа 2) в разведении 1:2 стимулировали пролиферацию клеток трофобласта по сравнению со спонтанным уровнем пролиферации (таблица). Пролиферация клеток трофобласта в присутствии кондиционированных сред плацент женщин с беременностью, осложненной преэклампсией на сроке 38–39 недель (группа 2) в разведении 1:2 была сходна со спонтанным уровнем пролиферации (таблица). В остальных разведениях (1:4; 1:8; 1:16; 1:32) кондиционированные среды плацент женщин с физиологической беременностью на сроке 38–39 недель (группа 1) обладали одинаковым стимулирующим пролиферацию действием в отношении клеток трофобласта по сравнению со спонтанным уровнем их пролиферации (таблица).
Кондиционированные среды плацент женщин c беременностью, осложненной преэклампсией на сроке 38–39 недель (группа 2), в разведениях 1:4; 1:8; 1:16; 1:32 также обладали стимулирующим пролиферацию действием в отношении клеток трофобласта по сравнению со спонтанным уровнем их пролиферации (таблица). При этом стимулирующее пролиферацию действие в отношении клеток трофобласта кондиционированных сред плацент в разведениях 1:4; 1:8; 1:16; 1:32 у проанализированных групп женщин не различались между собой.
Кондиционированные среды плацент женщин с физиологической беременностью на сроке 38–39 недель (группа 1) и беременностью, осложненной преэклампсией на сроке 38–39 недель (группа 2) обладали стимулирующим действием в отношении миграционной активности клеток трофобласта линии JEG-3 по сравнению со спонтанным уровнем (рис. 3). Отмечали меньшее стимулирующее действие кондиционированных сред плацент женщин c беременностью, осложненной преэклампсией на сроке 38–39 недель (группа 2) по сравнению с действием кондиционированных сред плацент женщин с физиологической беременностью на сроке 38–39 недель (группа 1) в отношении миграционной активности клеток трофобласта (рис. 3).
Обсуждение
В третьем триместре физиологической беременности изменения структуры ворсин хориона происходят в соответствии с метаболическими потребностями растущего плода, поэтому закономерно увеличивается обменная поверхность капиллярного русла ворсин и облегчается диффузия через фетоплацентарный барьер. К концу третьего триместра физиологической беременности не отмечают роста ворсинчатого дерева плаценты, формирование плаценты завершается, ограничивается инвазивность трофобласта за счет контроля его пролиферации и миграции клетками микроокружения, ограничения секреции матриксных металлопротеиназ (ММР) трофобластом. Полагают, что ограничение пролиферации и инвазивности трофобласта связано с продукцией цитокинов в зоне маточно-плацентарного контакта как клетками самой плаценты: клетки трофобласта, макрофаги, эндотелиальные клетки сосудов плаценты, так и клетками материнского происхождения, локализованными в децидуальной оболочке: NK-клетки, макрофаги, цитотоксические Т-лимфоциты, эндотелиальные клетки. На протяжении всей беременности в плаценте отмечают продукцию различных цитокинов, включая про- и противовоспалительные, ангиогенные и антиангиогенные факторы. Продукция цитокинов клетками плаценты как в первом, так и в третьем триместре физиологической беременности сбалансирована и изменяется по мере увеличения срока гестации [4]. Ранее установлено, что в третьем триместре физиологической беременности по сравнению с первым триместром в плаценте снижена продукция как проангиогенных, так и антиангиогенных факторов, при одновременном повышении секреции хемокинов и провоспалительных цитокинов. Преэклампсия сопровождается сниженной по сравнению с физиологической беременностью продукцией в плаценте сосудисто-эндотелиального фактора роста (VEGF), bFGF, MMP-2, при одновременно повышенной продукции ангиогенина, интерлейкина (IL)-8, IL-6, PDGF, TSP-1 и TGFβ. Ранее описаны цитокины, стимулирующие пролиферацию клеток трофобласта: EGF [6], HGF, VEGF, плацентарный фактор роста (PlGF) [7], лейкемия-ингибирующий фактор (LIF), GM-CSF [3], PDGF, bFGF [6], SDF; цитокины, стимулирующие миграцию трофобласта: HGF, EGF, IL-11, LIF, SDF [8], IL-1β [9], IL-6, IР-10 [10], IL-8 [11]. Ингибирующими миграцию трофобласта являются интерферон (IFN)γ, TGFβ [6], фактор некроза опухоли (TNF)α, IL-11 [12], IGF-I.
Установлено подавление пролиферативной активности клеток трофобласта по сравнению со спонтанным уровнем в присутствии кондиционированных сред плацент исследованных групп в разведении 1:1, которое может быть связано как с истощением ростовых факторов в питательной среде при культивировании плаценты, так и с наличием факторов, ингибирующих пролиферацию трофобласта, например IFNγ и TNFα. С другой стороны, в этом же разведении факторы плацент женщин всех исследованных групп обладали стимулирующим миграцию трофобласта действием. Ответственными за реализацию этого эффекта могут быть цитокины IL-1β, IL-6, IP-10, IL-8. Ранее установлено, что в третьем триместре по сравнению с первым триместром беременности в плаценте снижена секреция TGFβ [4], что может способствовать усилению миграционной активности трофобласта. Стимулирующий миграцию эффект кондиционированных сред плацент женщин с преэклампсией в разведении 1:1 был менее выражен по сравнению с эффектом факторов плацент женщин с физиологической беременностью. Сниженная миграционная активность трофобласта может лежать в основе нарушения инвазивности трофобласта при преэклампсии и может быть обусловлена повышенным содержанием в секреторных продуктах плаценты таких цитокинов, как TGFβ и IFNγ при одновременно сниженном содержании bFGF.
В разведении кондиционированных сред 1:2 ингибирующий пролиферацию эффект факторов, секретируемых плацентой женщин всех групп был нивелирован. Более того, факторы плацент женщин третьего триместра физиологической беременности в разведении 1:2 стимулировали пролиферацию по сравнению со спонтанным уровнем, а плаценты женщин третьего триместра беременности, осложненной преэклампсией, не обладали таким эффектом. При дальнейшем разведении кондиционированные среды плацент женщин всех групп стимулировали пролиферацию клеток трофобласта. Таким образом, разведение кондиционированных сред снижало концентрацию факторов, ингибирующих пролиферацию трофобласта, одновременно проявляя действие факторов, стимулирующих пролиферацию. Выявленное стимулирующее действие кондиционированных сред плацент женщин с физиологической беременностью на сроке 38–39 недель на пролиферативную активность клеток трофобласта линии JEG-3 может быть следствием секреции bFGF, PlGF плацентой и способствует поддержанию жизнеспособности трофобласта и других клеток плаценты и децидуальной оболочки. Наличие стимулирующего пролиферацию трофобласта эффекта кондиционированных сред плацент женщин с преэклампсией может быть связано с компенсаторной повышенной продукцией плацентой PDGF, ангиогенина, IL-8, IL-6 [4].
Заключение
Суммируя полученные данные, необходимо отметить, что, несмотря на завершение формирования плаценты и ограничение инвазии трофобласта в третьем триместре как при физиологической беременности, так и при беременности, осложненной преэклампсией, в плаценте секретируются цитокины как стимулирующие, так и ингибирующие пролиферацию и миграцию клеток трофобласта. При этом эффект ингибиторов пролиферации и миграции трофобласта превалирует над эффектом стимуляторов этих процессов. Эффект факторов, стимулирующих пролиферацию и миграцию трофобласта, снижен в случае плацент женщин с преэклампсией, отражая нарушение функций трофобласта при данной патологии. Продукция плацентой в третьем триместре беременности цитокинов, стимулирующих пролиферацию и миграцию трофобласта в условиях in vitro, вероятно, связана с необходимостью поддержания жизнеспособности и функциональной активности клеток трофобласта в конце третьего триместра беременности.



