Несмотря на широкие возможности современных хирургических методов лечения миомы матки, процент рецидива после реконструктивно-пластических операций остается высоким. Частота рецидива заболевания по данным отдельных авторов колеблется от 10 до 70% [1, 2], а частота повторных операций по поводу рецидива миомы матки – от 14 до 37% [1–8]. Попытки рассмотреть закономерности появления рецидива опухоли матки после миомэктомии позволяют подойти ближе к раскрытию патогенеза миомы матки и выявить прогностические факторы рецидивирoвания опухоли.
Рядом исследователей отмечено, что рецидив миомы матки и необходимость повторного хирургического вмешательства чаще возникают через 3 года после проведения миoмэктoмии [3, 6, 9–11]. Особый интерес представляет обсуждение возможной связи рецидива опухоли с рубцом после миомэктомии или кесарева сечения. В онкологии существует концепция о развитии опухоли в рубце. Так, имеются описания возникновения рака легкого в рубце, рака молочной железы в звездчатом рубце, рака щитовидной железы в рубце, аденомы и рака почек на фоне нефросклероза [3, 12].
Недостаточно изученные вопросы этиологии и патогенеза не дают возможность разработать надежные методы профилактики и раннего выявления рецидивов миомы матки.
Исследование вероятности рецидива миомы тела матки невозможно без изучения ключевых патологических процессов: пролиферативной активности, неоангиогенеза, инвазии, а также прогестероновых рецепторов (PR).
Целью настоящего исследования стало изучение клинико-морфологических факторов, позволяющих прогнозировать рецидив лейомиомы матки у женщин репродуктивного возраста после реконструктивно-пластических операций.
Материали методы исследования
Исследование выполнено на операционном материале, полученном после миомэктомии. Первую группу составили 30 женщин с наличием рецидива миомы матки после ранее выполненной миомэктомии. Вторую группу составили 30 женщин репродуктивного возраста (20–45 лет) с впервые выполненной миомэктомией (контрольная группа). Женщины обследованы с применением общеклинических методов (сбор анамнестических данных, жалоб и данных влагалищного осмотра), ретроспективного анализа данных историй болезни, лабораторных методов обследования, ультразвукового мониторинга с определением локализации, размеров миоматозных узлов. Проводилось морфологическое исследование операционного материала. Изучали макропрепараты, а также серийные парафиновые срезы толщиной 5 мкм с окраской гематоксилином и эозином. Иммуногистохимические реакции ставились на серийных парафиновых срезах толщиной 4 мкм на стеклах с адгезивным силанизированным покрытием и восстановлением антигенности тканей в ретривере. Изучали иммуногистохимические маркеры пролиферации (Ki-67), неоангиогенеза (сосудисто-эндотелиальный фактор роста (VEGF)), инвазии (матриксные металлопротеиназы (MMP2), тканевые ингибиторы металлопротеиназ (TIMP1)). В качестве первичных антител применялись моноклональные и поликлональные антитела к Ki-67, PR (DAKO, Дания), MMP-2 (LAB VISION, США), TIMP-1 (LAB VISION, США), VEGF (1:200; LAB VISION, США). В качестве вторичных антител использовали смесь противомышиных и противокроличьих антител со стрептовидин-биотиновым комплексом (SBK KIT DAKO, Дания). Ставились положительные и отрицательные контроли. Результаты оценивали количественным и полуколичественным методами в баллах по числу позитивно окрашенных клеток. Оценку интенсивности MMP-2 и VEGF проводили по 6-балльной системе: 2 балла – до 20% окрашенных клеток, 4 балла – от 20 до 40% окрашенных клеток, 6 баллов – более 40% окрашенных клеток. Оценку экспрессию Ki-67 осу- ществляли путем подсчета процента окрашенных ядер на 3000 клеток [12].
При статистической обработке был использован непараметрический метод Манна–Уитни. При оценке достоверности выявленных различий между средними значениями выборок и достоверности выявленной корреляции рассчитывали вероятность ошибки р. Критический уровень значимости различий между группами был принят равным р=0,05. Во всех случаях использовали двусторонние статистические критерии.
Результаты исследования и обсуждение
Средний возраст больных первой группы составил 39,7±8, второй группы – 30,3±5 лет. Показаниями к операции в 1-й группе женщин с наличием рецидива миомы матки после ранее выполненной миомэктомии были: менометрорpагии – в 14 (46,6%) случаях, болевой синдром – в 19 (63,3%) случаях, нарушение функции соседних органов – в 5 (16,6%) случаях, большие размеры опухоли – в 3 (10%) случаях, отмеченный рост опухоли – в 15 (50%) и бесплодие – в 3 (10%) случаях.
Во 2-й, контрольной группе показаниями к операции были: болевой синдром – у 21 (70%) больной, менометроррагии – у 18 (60%), нарушение функции соседних органов – у 10 (33,3%), боль- шие размеры опухоли – у 5 (16,6%), отмеченный рост опухоли – у (20%) и бесплодие – у 13 (43,3%) женщин.
Обращал на себя внимание высокий процент отмеченного роста опухоли в 1-й группе (р<0,05) по сравнению со 2-й.
Средняя величина матки составила 17,96±3,11 см в 1-й группе и 19,70±2,90 см во 2-й (р>0,05), однако достоверного различия не было.
Величина миоматозных узлов, по данным ультразвукового исследования, в среднем составила: в 1-й группе 12,98±1,82 см, во 2-й – 15,21±2,49 см. Достоверного различия в этих группах не отмечено (р>0,05).
Среднее количество удаленных миоматозных узлов было достоверно (р<0,05) выше во 2-й группе и составило 4,55±2,1, в то время как в 1-й – 1,5±1,2.
Время возникновения рецидива у пациенток 1-й группы составило в среднем 4,8±2,6 года (от 0,6 до 11 лет) и достоверно коррелировало с количеством и размерами ранее удаленных узлов (р<0,05).
В результате проведенного морфологического исследования были выявлены морфологические и иммуногистохимические особенности рецидивных лейомиом матки (рис. 1). Среди рецидивных миом преобладали митотически активные и клеточные миомы, которые диагностированы у 8 пациенток (70%). В то же время в контрольной группе преобладали простые лейомиомы – 20 (66,6%) и лишь у 7 (23,3%) женщин выявлены клеточные, а у 3 женщин (10%) – митотическиактивные. Основным иммуногистохимическим признаком митотически активной лейомиомы являлось наличие митозов и пролиферирующих клеток по маркерам пролиферации Ki-67 (рис. 1а см. на вклейке). Рецидивные лейомиомы обла- дали более высокой экспрессией Ki-67, VEGF и MMP-2. Наиболее высокие показатели TIMP-1 отмечались в рецидивных лейомиомах в рубце.
Результаты проведенного морфологического и иммуногистохимического исследования позволили также установить возможные источники роста рецидивной лейомиомы. Так, у 20 из 30 больных (66,6%) в миометрии вокруг рецидивной лейомиомы обнаруживались множественные периваскулярные скопления веретенообразных клеток с индексом пролиферативной активности до 20% (рис. 1б см. на вклейке). Известно, что такие структуры названы зонами роста и, вероятно, могут быть источником развития лейомиом. В контрольной группе периваскулярные муфты в сохранном миометрии обнаруживались у 10 из 30 (33%) больных. Кроме того, у 5 пациенток в сохранном миометрии выявились лейомиомы микроскопических и небольших размеров, не диагностированные ранее (рис. 1в см. на вклейке), которые также могут увеличиваться в размерах, что в дальнейшем может трактоваться клиницистами как рецидив. Следует отметить, что и в контрольной группе недиагностированные лейомиомы в сохранном миометрии были найдены в 2 случаях.
Третьим источником рецидивной лейомиомы могли стать гладкомышечные клетки, которые обладали высокой пролиферативной активностью до 10–15% по Ki-67, замурованные в рубец после предыдущей миомэктомии (рис. 1г см. на вклейке).
Рубцовая ткань представлена грубыми коллагеновыми волокнами, полями гиалиноза и единичными мелкими сосудами (отложения гемосидерина), с формированием гладкомышечных муфт вокруг отдельных артериол. Отдельные сосуды, замурованные в рубце, имели утолщенные стенки за счет гиперплазии гладкомышечных клеток. Данные литературы [3, 7, 12, 13] также свидетельствуют о возможности возникновения «лейомиомы в рубце».
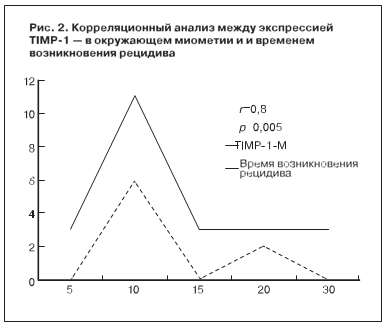
При проведении корреляционного анализа между клиническими и иммуногистохимически- ми показателями установлена достоверная корреляция (р=0,005) между экспрессией TIMP-1 в окружающем миометрии и временем до возникновения рецидива (рис. 2).
Это, вероятно, может объясняться тем, что чем выше TIMP, тем больше время возникновения до рецидива. TIMP-1, c одной стороны, усиливает склерозирование сосудов, что уменьшает рост миомы, а с другой – ингибирует MMP2 (которая участвует в ремоделировании тканей и ангиогенезе). Также корреляционный анализ показал, что коэкспрессия Ki-67 и VEGF достоверно коррелировали между собой не только в самой лейомиоме (р=0,012), но и в окружающем миометрии (р=0,016). Также показатели пролиферативной активности леоймиомы PR и VEGF достоверно коррелировали с VEGF в окружающем миометрии (р=0,030). Поэтому можно считать возможным использованием маркера неоангиогенеза – VEGF в удаленной ткани как прогностического фактора рецидивирования лейомиомы после миомэктомии.
Заключение
На основании результатов проведенного исследования, сопоставленных с данными литературы, можно предположить, что рецидив лейомиомы матки может быть связан с развитием опухоли из «зон роста» вокруг сосудов в сохранном миометрии – из так называемых «зачатков» лейомиомы в виде периваскулярных скоплений гладкомышечных клеток, старых рубцов после миомэктомий, а также лейомиом микроскопических размеров, не диагностированных во время предыдущей операции. Рецидивные лейомиомы обладают более высокой пролиферативной активностью и по гистологическому строению среди них преобладают митотически активные и клеточные по сравнению с впервые выявленными миомами контрольной группы. Патогенетическими факторами рецидивирования лейомиомы являются: наличие зон роста в окружающем миометрии и рубцах, мелких лейомиом, а также высокие показатели Ki-67 и VEGF как в самой лейомиоме, так и окружающем миометрии. Высокий уровень TIMP-1 в лейомио- ме препятствует ее росту и увеличивает время до возникновения рецидива лейомиомы.



