На современном этапе развития предиктивной медицины персонифицированная профилактика невозможна без междисциплинарного взаимодействия, в том числе и в части разработки этиопатогенетически обоснованных профилактических мероприятий при наследственной предрасположенности к заболеваниям [1].
Мутация Лейден – это дефект гена, кодирующего проакцелерин (FV), при этом в 1691-м положении гена происходит замена гуанина (G) на аденин (A). В результате генетической поломки аминокислотная последовательность в белке (V фактор) меняется, и полипептид утрачивает один из сайтов расщепления активированного протеина C, что реализуется формированием фенотипа резистентности фактора Vа к активированному протеину С (AПC-резистентность), сопровождаемого усилением генерации тромбина [2]. Формирующийся дисбаланс способен приводить не только к усилению коагуляционного потенциала крови [3, 4], но и к нарушению процесса инвазии и плацентации, что в дальнейшем клинически способно реализоваться плацента-опосредованными осложнениями [5]. В частности, по имеющимся данным, гетерозиготное носительство мутации Лейден [генотип F5L(1691)GА] увеличивает риск развития преэклампсии (ПЭ) в 2,19 раза; задержки роста плода (ЗРП) – в 2,68 раза; преждевременной отслойки нормально расположенной плаценты (ПОНРП) – в 4,7 раза [6, 7].
В опубликованном нами ранее проспективном когортном исследовании, включающем 500 женщин – носительниц генотипа F5L(1691)GA, было показано, что АПС-резистентность по НО ≤0,49 может рассматриваться как прогностический маркер развития ПЭ (площадь под ROC-кривой (AUС) – 0,839; p<0,0001) и ЗРП (площадь под ROC-кривой (AUС) – 0,867; p<0,0001) с наибольшей точностью при определение показателя в сроке 7–8 недель беременности [8].
Таким образом, эффективность профилактических мероприятий у пациенток с тромбофилическим генотипом F5L(1691)GA будет зависеть от своевременности определения фенотипической проявленности генотипа и адекватной коррекции дисбаланса в системе гемостаза с использованием антикоагулянтов [5].
Более 40 лет назад использование НМГ было предложено F.G. Buyse и соавт. в качестве профилактики ПЭ и ЗРП у беременных групп высокого риска. Посылом для исследователей был тот факт, что патогенез данных акушерских осложнений един и обусловлен нарушением ремоделирования спиральных артерий и дисбалансом гемостатических реакций на уровне плаценты [9, 10].
Механизмы, посредством которых НМГ может повлиять на предупреждение вышеуказанных нарушений при становлении плаценты, остаются не ясными, но имеющиеся предпосылки касаются в основном его некоагулянтных свойств.
Клинические исследования применения НМГ с целью профилактики плацента-опосредованных осложнений характеризуются неоднородностью по включению пациенток с генетической тромбофилией и иллюстрируют противоречивые данные [11–13]. Неоднозначность заключений, вероятно, обусловлена тем, что определяющим в выборе тактики профилактических мероприятий было наличие рисков (как генетических, так и анамнестических), а не возможность воздействия на патогенетические звенья патологического процесса.
Мы не нашли работ, направленных на изучение эффективности применения НМГ с целью профилактики плацента-опосредованных осложнений с учетом АПС-резистентности у носительниц генотипа F5L(1691)GA, что и послужило поводом для проведения настоящего исследования.
Цель исследования: изучить клинико-лабораторные эффекты гепаринопрофилактики у носительниц генотипа F5L(1691)GA с выраженной АПС-резистентностью.
Материал и методы исследования
На базе клинических подразделений ФГБОУ ВО АГМУ Минздрава России с 2015 по 2017 г. проведено одноцентровое рандомизированное контролируемое исследование 141 беременной, носительниц генотипа F5L(1691)GA.
Основным критерием включения пациенток в исследование стала степень выраженности АПС-резистентности (НО≤0,49), которая была связана с большей частотой гестационных осложнений, отмеченной нами ранее [8].
Критерии исключения: генотипы F5L(1691)GG/AA; аномалии развития половых органов; многоплодная беременность; беременность, наступившая в результате вспомогательных репродуктивных технологий; экстрагенитальные заболевание в стадии декомпенсации; аутоиммунные заболевания, включая антифосфолипидный синдром; наличие хромосомных аберраций у супругов.
Проведение исследования одобрено локальным этическим комитетом ФГБОУ ВО АГМУ Минздрава России (протокол № 6 от 28.04.2015 г.).
Всего за период с 2015 по 2017 годы была отобрана 161 пациентка, соответствующая критериям включения. Все пациентки относились к промежуточному риску развития венозных тромбоэмболических осложнений (ВТЭО) и согласно рекомендациям мировых сообществ не нуждались в проведении антенатальной тромбопрофилактики [14, 15]. На этапе формирования групп 20 пациенток выбыли из дальнейшего наблюдения: у 14 определены критерии исключения до этапа рандомизации; 4 исключены в первом триместре беременности (две выбыли в другой регион, у одной – монохориальная двойня, у одной – порок развития плода) и две пациентки выбыли из группы сравнения на этапе наблюдения, так как нуждались в назначение НМГ по заключению врача-гематолога в связи с антенатальным эпизодом тромбоза. В результате в исследование вошла 141 пациентка. Рандомизация осуществлялась простым блоковым методом [16].
Основную группу составили 70 беременных (средний возраст 30,2±4,7 года), которым со срока беременности 7–8 недель проводилась гепаринопрофилактика. Назначался надропарин кальция по 0,3 мл (2850 МЕ анти-Ха) 2 раза в день на протяжении 14 дней. Тактика дальнейшего применения НМГ определялась показателем АПС-резистентности при его исследовании в сроки 18–19 и 27–28 недель. Повторные курсы НМГ проведены у 39 (55,7%) пациенток в сроке 18–19 недель беременности и у 38 (54,3%) женщин в сроке 27–28 недель.
В группу сравнения определена 71 беременная (средний возраст 30,3±3,9 года), антенатальная профилактика НМГ в данной группе не проводилась.
Отметим, что в обеих группах пациентки высокого риска развития ПЭ (группа исследования 52,9%, группа сравнения 42,1%, р=0,399) получали профилактические дозы ацетилсалициловой кислоты (АСК) (75 мг в сутки) согласно положениям клинического протокола [17]. В послеродовом периоде родильницы обеих групп получали профилактические дозы НМГ [18].

У всех пациенток проводили динамическое исследование АПС-резистентности и способность генерации тромбина (калиброванная тромбография по Hemker [19]) в 8 точках: 7–8 недель, 12–13 недель, 18–19 недель, 22–23 недели, 27–28 недель, 32–33 недели, 36–37 недель и 2–3-е сутки после родоразрешения (ПР).
АПС-резистентность определялась с помощью набора реагентов «Фактор V-PC-тест» (фирма «Технология-Стандарт», Россия) – аналога соответствующего набора реагентов производства фирмы «Siemens», Германия. Для исследования генерации тромбина использовался планшетный флюориметр Fluoroskan Ascent «ThermoFisher SCIENTIFIC» (Финляндия) с программным обеспечением «Thrombinoscope 3.0.0.26». Коагуляция исследуемой плазмы крови осуществлялась в присутствии 5,0 пмоль тканевого фактора и 4 мкмоль фосфолипидов (PPP-Reagent 5 pM, Thrombin Calibrator, FluCa-Kit).
Конечными точками, определяющими эффективность назначения НМГ, определены: число случаев умеренной/тяжелой ПЭ, ЗРП и число ПР.
Статистическую обработку данных проводили с использованием пакета статистического программного обеспечения MedCalc Version 17.9.7 (лицензия BU556-P12YT-BBS55-YAH5M-UBE51). Проверка вариационных рядов на нормальность распределения проводилась с помощью теста Шапиро–Уилкоксна (Shapiro-Wilk’s W-test). Данные лабораторных показателей представлены в виде медианы (Ме), 95% доверительного интервала (95% Cl) и интерквартильного размаха [25-й и 75–й перцентили]. Сравнение рядов выполнялось с использованием непараметрических методов (U-тест Манна–Уитни). Основные критерии оценки эффективности терапии определены как абсолютный риск в группе исследования (EER) и группе контроля (CER), относительный риск (RR), снижение абсолютного риска (АRR) и относительного риска (RRR), число больных необходимых лечить (NNT), 95% доверительный интервал (CI 95%) для RR и NNT. Критический уровень значимости различий (p) определен как p<0,05.
Результаты исследования
На первом этапе изучена клиническая характеристика пациенток по традиционно рассматриваемым факторам риска развития плацента-опосредованных осложнений. Показано, что сравниваемые группы репрезентативны по возрасту, тромботическому и репродуктивному анамнезу, соматической патологии.
При исследовании показателя АПС-резистентности, служившего основным критерием оценки, определяющим проведение гепаринопрофилактики, установлено статистически значимое снижение его медианы по НО в группе пациенток, получавших НМГ (табл. 1).
Из представленных данных видно, что при приеме надропарина кальция АПС-резистентность статистически значимо снижалась уже с 12 недель беременности, в отличие от результатов, определенных в группе сравнения.
 В целом на фоне гепаринопрофилактики обнаружено снижение АПС-резистентности на 9–14% (р<0,05) по сравнению с беременными, получающими стандартные профилактические мероприятия.
В целом на фоне гепаринопрофилактики обнаружено снижение АПС-резистентности на 9–14% (р<0,05) по сравнению с беременными, получающими стандартные профилактические мероприятия.
При исследовании способности к генерации тромбина у пациенток обеих групп определено нарастание тромбинообразования в течение беременности, что согласуется с ранее полученными результатами [19].
В группе пациенток, получавших гепаринопрофилактику, отмечается статистически значимое снижение способности к тромбинообразованию с 22 недель беременности, подтвержденное показателями ЕТР и «Peak thrombin» в тесте генерации тромбина (ТГТ).
В целом, медиана показателя ЕТР в группе НМГ«+» в течение беременности динамически нарастала в диапазоне 1924 → 2383 нмоль×мин против 1999 → 2595 нмоль×мин у пациенток группы НМГ«-», что определяет снижение показателя ЕТР на фоне надропарина кальция на 4,0–9,0% (р=0,013).
Аналогичные изменения определены и при оценке показателя «Peak thrombin». В группе НМГ«+» его медиана в течение беременности динамически нарастала в диапазоне 363 → 387 нмоль/л против 387 → 423 нмоль/л у пациенток группы НМГ«-», что определяет снижение показателя «Peak thrombin» на фоне профилактики НМГ на 9,0–11,0% (р=0,008).
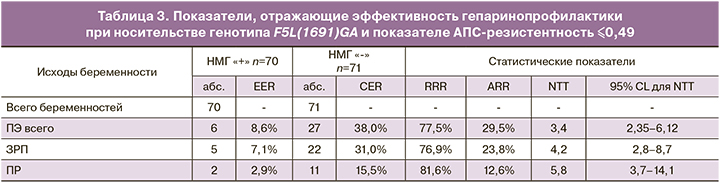
При изучении ассоциативных связей между гепаринопрофилактикой и частотой возникновения плацента-опосредованных осложнений (табл. 2) обнаружено, что в группе женщин, получавших надропарин кальция со срока беременности 7–8 недель, число случаев ПЭ уменьшилось в сравнении со стандартным лечением на 29,5%, ЗРП – на 23,8%, ПР – на 12,6% и эпизодов ПОНРП – на 5,6%.
Для конечных точек с уровнем значимости различий p<0,05 по числу благоприятных и неблагоприятных исходов беременности на фоне гепаринопрофилактики в соответствии с принятой практикой были рассчитаны показатели, определяющие степень эффективности лекарственного вмешательства (табл. 3).
В соответствии с представленными данными, в основной группе женщин имеется статистически значимое снижение АRR развития ПЭ (p=0,0003), ЗРП (p=0,0016) и ПР (p=0,0242).
При более детальном анализе течения беременности определено, что в группе гепаринопрофилактики умеренная ПЭ диагностирована в сроке беременности 36–37 недель в 6 случаях и реализовалась на фоне коморбидности, обусловленной гипертензивной болезнью сердца, варикозной болезнью нижних конечностей и избыточной массой тела.
Из 27 эпизодов ПЭ в группе сравнения тяжелое течение определено в 6 наблюдениях (22,2% от 27). В трех случаях пациентки с ранней тяжелой ПЭ родоразрешены досрочно (26, 30 и 32 недели). В остальных трех случаях проведено абдоминальное родоразрешение в сроке 37 недель. В 8 случаях ПЭ сочеталась с развитием ЗРП (29,6% от 27). У двух пациенток на фоне умеренной ПЭ в сроке 38 недель произошла ПОНРП, при этом в одном случае констатирована интранатальная гибель плода.
В группе женщин, получавших надропарин кальция, ЗРП определена в 5 наблюдениях против 22 случаев ЗРП у пациенток, получавших стандартное наблюдение. Масса новорожденных при ЗРП в основной группе составила 2458±240 против 2296±302 в группе сравнения, что не имело статистически значимой разницы (р=0,647).
Беременность закончилась досрочным родоразрешением на фоне гепаринопрофилактики у двух пациенток (2,9% от 70), в том числе один случай ПОНРП (33 недели) и один – антенатальная гибель плода (32 недели). В группе сравнения досрочно родоразрешены 11 женщин (15,5% от 71) в сроках 24–34 недели. В том числе в 3 случаях по поводу тяжелой ПЭ, в 3 – ПОНРП, 3 пациентки родоразрешены в сроке 35–36 недель в связи с угрожающей внутриутробной асфиксией плода. У двух пациенток преждевременные роды обусловлены антенатальной гибелью плода.
Для сравнения эффективности монопрофилактики НМГ или в сочетании с ацетилсалициловой кислотой (АСК) проведен анализ исходов и течения беременности в основной группе (НМГ «+»).
Как видно из рисунка, структура и частота осложнений беременности идентична в обеих подгруппах при получение гепаринопрофилактики, не имеет статистически значимой разницы и не зависит от дополнительного приема АСК.
Подводя итог анализу показателей, полученных в представленном исследовании, можно заключить, что гепаринопрофилактика имеет самостоятельное значение, способствуя снижению числа осложнений беременности (ПЭ, ЗРП и ПР). Совместное назначение НМГ и АСК в группе женщин высокого риска развития ПЭ не привело к суммации профилактического эффекта.
Таким образом, персонифицированная гепаринопрофилактика гестационных осложнений у носительниц тромбофилического генотипа F5L(1691)GA патогенетически обоснована, так как влияет на объективные маркеры субклинически проявленного фенотипа: резистентность фактора Va к активированному протеину С и способность к тромбинообразованию. Нормализация гемостатического баланса, подтвержденная статистически значимым изменением уровня АПС-резистентности и показателей ТГТ, коррелирует с улучшением исходов по конечным точкам исследования (ПЭ, ЗРП и ПР).
Обсуждение
Благоприятное течение беременности определяется адекватной имплантацией, успех которой зависит от тонкого иммунно-гемостазиологического баланса на маточно-эмбриональном уровне. С одной стороны, нарушение взаимодействия провоспалительных цитокинов, металопротеиназ (МППs), сосудистых факторов роста и белков системы гемостаза могут вызывать нарушение имплантации [20], с другой, именно указанные биологические маркеры являются точкой приложения НМГ и определяют его некоагулянтные свойства.
В частности, имеются данные, подтверждающие влияние гепаринов на инвазию трофобласта посредством синтеза E-кадгерина [21]. С. Zenerino с соавторами (2017) описали механизм, с помощью которого НМГ оказывает противовоспалительное действие на плацентарную ткань. Авторами установлено, что НМГ может менять структуру белков противовоспалительной группы путем снижения экспрессии IL-6 и TNF-α [22]. К. McLaughlin с соавт. (2017) определили, что НМГ обладает эндотелиопротекторным действием за счет стимуляции секреции PlGF из эндотелиальных клеток, в том числе у женщин с высоким риском развития преэклампсии [23].
С учетом того, что точкой приложения некоагулянтных эффектов НМГ являются иммунные, ангиогенные и гемостатические реакции в период имплантации цитотрофобласта, мы определили первую точку его применения у пациенток с субклинически проявленным фенотипом (АПС-резистентность по НО ≤0,49) – 7–8 недель гестации. Целесообразность профилактического назначения НМГ в период имплантации показано R. Pijnenborg и соавт. еще в 1983 году. Авторы обосновали, что терапевтический эффект от назначения гепарина можно ожидать только при его назначение до 18 недель гестации, момента окончания второй волны инвазии циототрофобласта [24].
В процессе работы выявлено снижение АПС-резистентности на фоне приема профилактических доз НМГ, что было статистически значимо с 12 недель беременности. По всей видимости, отмеченное действие связано с некоагулянтными эффектами НМГ и влиянием на причины, определяющие вторичную составляющую АПС-резистентности, генетически не детерминированную.
При анализе показателей ТГТ в случаях применения надропарина кальция определено снижение интенсивности генерации тромбина с 22 недель гестации: по Peak thrombin на 9–11% (р=0,008) и по ЕТР – на 4–9% (р=0,013). Представленный эффект НМГ обусловлен его антикоагулянтным действием и не противоречит результатам исследования А. Selmeczi (2015) [25].
Анализ исходов по конечным точкам показал, что использование профилактической дозы НМГ при проявленном лабораторном фенотипе – АПС-резистентности у носительниц генотипа F5L(1961)GA со срока беременности 7–8 недель уменьшает абсолютный риск развития ПЭ на 29,5%, ЗРП на 23,8% и ПР на 12,6%.
В целом, полученные данные согласуются с результатами других исследователей относительно гепаринопрофилактики осложнений беременностей у пациенток с мутацией Лейден, но без учета выраженности АПС-резистентности.
В частности, J.I. de Vries и соавт. (2012) в своей работе, включающей 82 (59,0% от 139 всех включенных) пациентки с генотипом F5L(1961)GA, показали положительный эффект от применения НМГ. Применение дальтепарина натрия (ежесуточно в дозе 5000 МЕ) в комбинации с АСК (в суточной дозе 75–100 мг) привело к снижению абсолютного риска развития ранней преэклампсии (до 34 недель) на 8,7% [95%Cl (1,9–15,5) p=0,012] [26].
В наблюдательном исследовании D. Tormene с соавт. (2012) оценил возможную эффективность использования НМГ с АСК или без нее в исходах беременности у 1011 женщин, из которых 416 (41,1%) были носительницы мутации F5L(1961)GA или F2(20210 GA. Большинство пациенток имели осложненный акушерский (36%) или личный тромботический анамнез (18%). Авторы пришли к выводу, что использование НМГ снижает риск ранних репродуктивных потерь [OR0,52; 95% CL0,29–0,94] и тромбозов [OR0,05; 95% CL0,01–0,21]. Наибольший эффект по числу живорождений отмечен у пациенток с рецидивирующими репродуктивными потерями в анамнезе [OR0,19; 95% CL 0,05–0,75] [27].
На наш взгляд, клиническая эффективность гепаринопрофилактики у носительниц генотипа F5L(1961)GA в настоящей работе определяется последовательной суммацией неантикоагулянтных и антикоагулянтных эффектов НМГ. Реализация первых осуществляется на этапах имплантации и плацентации, когда посредством воздействия на вышеуказанные клеточно-молекулярные взаимодействия гепарин способствует адекватной инвазии цитотрофобласта и полноценному ремоделированию спиральных артерий. Антикоагулянтный эффект реализуется преимущественно во второй половине беременности, снижая интенсивность генерации тромбина, способствуя восстановлению гемостатического равновесия.
Выводы
- Проведение курсов гепаринопрофилактики у беременных с генотипом F5L(1691)GA при выраженной АПС-резистентности (по НО ≤0,49) в сроки беременности 7–8, 18–19 и 27–28 недель приводит к снижению абсолютного риска развития преэклампсии на 29,5% (p=0,0003), задержки роста плода на 23,8% (p=0,0016) и частоты досрочного родоразрешения на 12,6% (p=0,0242).
- Корреляция показателей АПС-резистентности (по НО) и теста генерации тромбина с целевыми клиническими точками (ПЭ, ЗРП и ПР) позволяет использовать указанные высокочувствительные тесты в качестве критериев эффективности гепаринопрофилактики гестационных осложнений у носительниц генотипа F5L(1691)GA.



