1) N.N.Petrov Research Institute of Oncology, St.-Petersburg, Russia;
2) I.I. Mechnikov North-Western State Medical University, St.-Petersburg, Russia
Aim. To review strategies for prophylactic surgery in carriers of BRCA1 or BRCA2 gene mutations and their short and long-term outcomes regarding overall health and health-related quality of life.
Materials and methods. Between January 2007 and December 2018, 752 women with ovarian cancer were tested for the most common mutations of BRCA1 (5382insC, 4153delA, 185delAG, С61G, 2080delA, 3875del4, 3819del5) and BRCA2 (6174delT) genes using allele-specific PCR. Patients with suspected hereditary ovarian cancer (n = 327) or concurrent breast and ovarian cancer (n = 16) were identified. The entire coding sequences of BRCA1 and BRCA2 genes were analyzed in these patients using high-resolution analysis of melting PCR products followed by sequencing of fragments with abnormal denaturation curves.
Results. The study identified 97 patients with ovarian cancer who had common mutations of BRCA1 genes [5382insC in BRCA1 gene, 4153delA in BRCA1 gene, 185delAG in BRCA1 gene, and C61G in BRCA1 gene in 74 (76.3%), 13 (13.4%), 7 (7.2%), and 1 (1%) of patients, respectively], and BRCA1 gene C61G in 1 (1%), BRCA1 gene 2080delA in 2 (2.1%)) and two patients with the 617delLT mutation in the BRCA2 gene, as well as 19 patients with rare mutations: in the BRCA1 gene (n = 14) and the BRCA2 gene (n = 5). The following recurrent alleles of BRCA1 were identified among rare mutations: R1751X in 5 (35.7%), R1699W in 3 (21.4%), G1706E in 2 (14.3%), c.2643delA in 2 (14.3%), c.5215 + 1G> T in 2 (14.3%) (n = 2) and BRCA2: Y1762X in 2 (40%), and c. 6999dupA in 3 (60%). Among relatives who carried mutations, 2/72 (2.7%) were diagnosed with ovarian cancer and fallopian tube cancer. In healthy carriers of BRCA1 gene mutations, hysterectomy with adnexa removal and bilateral adnexectomy were performed in 5 (62.5%) and 3 (37.8%) patients, respectively. In all 8 cases of prophylactic surgery, no adenocarcinoma cells were detected in removed ovaries and fallopian tubes.
Conclusion. Thus, salpingectomy during various gynecological surgeries is safe and may offer protection against ovarian cancer without compromising endocrine function. Besides, a delayed salpingectomy strategy may also serve as an effective alternative preventive strategy for women with a genetic predisposition to ovarian cancer.
salpingectomy
ovarian cancer
prevention
gene mutations
oophorectomy
Рак яичников – это крайне агрессивная опухоль. У женщин – носительниц мутаций в генах BRCA1 и BRCA2 риск заболеть раком яичника (РЯ) и/или молочной железы (РМЖ) фатален. Кроме того, многие исследования указывают на более высокую частоту висцеральных метастазов у больных BRCA-ассоциированным РЯ по сравнению со спорадическими случаями [1, 2]. Учитывая отсутствие эффективного скрининга РЯ, хирургическое удаление тканей, подверженных риску, рассматривается как наиболее успешная профилактическая стратегия для пациенток с наследственным РМЖ и РЯ [3–5]. Также профилактическая овариэктомия у носительниц мутаций в генах BRCA1 и BRCA2 используется с целью снижения экспозиции ткани молочных желез к эстрогенам. Недавно опубликованное проспективное исследование продемонстрировало, что протективный эффект от овариэктомии в репродуктивном возрасте реализуется только у носительниц мутаций в гене BRCA2, в то время как подобная операция у женщин с мутацией BRCA1 не влияет на риск РМЖ [6].
Однако хирургическая менопауза, возникающая в связи с выполнением овариэктомии, создает целый ряд проблем, связанных с качеством жизни пациенток, а риски при использовании заместительной гормонотерапии для женщин – носительниц мутаций находятся в стадии изучения. Для предотвращения хирургической менопаузы была предложена профилактическая сальпингэктомия с отсроченной овариэктомией.
В основу такого подхода легли современные знания о специфическом патогенезе BRCA-ассоциированного РЯ, можно отметить, что первичный очаг раннего серозного high grade РЯ в виде серозной трубной интраэпителиальной карциномы (STIC) чаще всего возникает в дистальном отделе маточной трубы. В случае выполнения сальпингоэктомии в возрасте 30 лет носительницам мутаций в гене BRCA1 предлагается пройти отсроченную овариэктомию в возрасте 40 лет, носительницам мутаций в гене BRCA2 – в возрасте 45 лет [7, 8].
Цель исследования – обсудить различные стратегии хирургической профилактики у носительниц мутаций в генах BRCA1 и BRCA2, а также краткосрочные и долгосрочные последствия этих стратегий на общее состояние здоровья и качество жизни женщин.
Материалы и методы
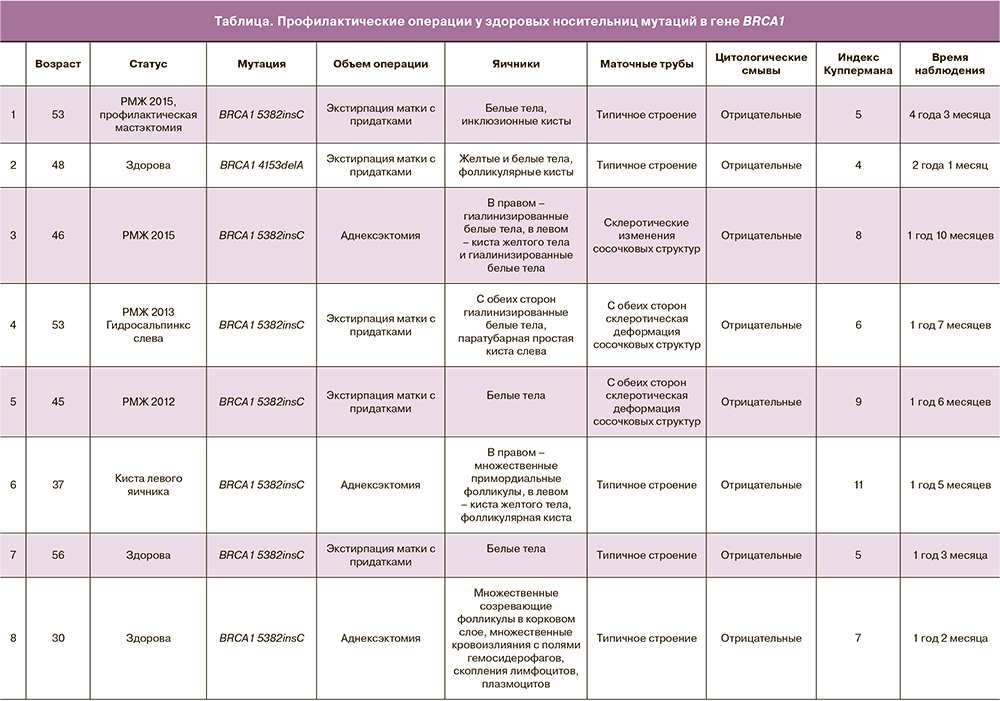
В лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России генетическое тестирование на наличие мутаций в генах BRCA1 и BRCA2 у больных РЯ и их родственников проводится с 2007 г. За период с января 2007 по декабрь 2018 г. 752 больных РЯ женщин, получающих лечение в клинике ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, были протестированы на наличие частых мутаций в гене BRCA1 (5382insC, 4153delA, 185delAG, С61G, 2080delA, 3875del4, 3819del5) и BRCA2 (6174delT) методом аллель-специфической полимеразно-цепной реакции (ПЦР) [5]. Кроме того, из группы пациенток, негативных по частым мутациям, были отобраны 343 с признаками наследственного РЯ (n=327) или с сочетанием РМЖ/РЯ (n=16). У этих пациенток мы выполнили анализ полной кодирующей последовательности BRCA1 и BRCA2 методом высокоточного анализа плавления ПЦР-продуктов с последующим секвенированием фрагментов с аномальными кривыми денатурации. Пациенткам с выявленными мутациями, а также их родственникам в период с мая 2017 по декабрь 2018 г. в хирургическом отделении онкогинекологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России проводилось обследование. По результатам молекулярного тестирования при наличии патогенной мутации здоровым женщинам предлагали выполнить профилактическое хирургическое лечение. Пролечены 8 пациенток с наличием мутации в гене BRCA1 (таблица). Все пациентки подписали информированное согласие на участие в исследовании с указанием объема хирургического лечения.
Результаты
В ходе исследования выявлены 97 больных РЯ с наличием частых мутаций в генах BRCA1 (5382insC гена BRCA1 – у 74 (76,3%), 4153delA гена BRCA1 – у 13 (13,4%), 185delAG гена BRCA1 – у 7 (7,2%), С61G гена BRCA1 – у 1 (1%), 2080delA гена BRCA1 – у 2 (2,1%)) и 2 пациентки с мутацией 617delLT в гене BRCA2, а также 19 пациенток с наличием редких мутаций: в гене BRCA1 (n=14) и в гене BRCA2 (n=5). В спектре редких мутаций выявлены следующие рекуррентные аллели BRCA1: R1751X – у 5 (35,7%), R1699W – у 3 (21,4%), G1706E – у 2 (14,3%), c.2643delA – у 2 (14,3%), c.5215+1G>T – у 2 (14,3%) (n=2) и BRCA2: Y1762X – у 2 (40%) и c.6999dupA – у 3 (60%).
Возрастной интервал у 107 больных РЯ с наличием мутации в гене BRCA1 колебался от 34 до 74 лет (медиана 48 лет), у 11 больных РЯ с наличием мутации в гене BRCA2 – от 40 до 62 лет (медиана 49 лет). У пациенток – носительниц мутаций вторые опухоли возникали в диапазоне от 1 до 13 лет. Медиана диапазона составила 5 лет. Как и ожидалось, мутации в генах BRCA1 и BRCA2 достоверно чаще присутствовали у пациенток с отягощенным семейным анамнезом (24/118 (20,3%) против 49/634 (7,7%), p=0,001; ОШ=2,9; 95% ДИ 1,57–5,57), а также у больных до 50 лет (19/118 (16,1%) против 43/634 (6,8%), p=0,003; ОШ=2,6; 95% ДИ 1,4–4,9). Наибольшая частота мутаций наблюдалась при сочетании РМЖ и РЯ: у 61/118 пациентки (51,7%). Мутации в генах BRCA1 и BRCA2 обнаруживались чаще в группе больных с распространенными формами заболевания: у 97/118 (82,2%) диагноз РЯ установлен на стадии IIIC–IV стадии (FIGO). При изучении анамнеза заболевания у больных РЯ носительниц мутаций в генах BRCA1 и BRCA2 было установлено, что предшествующее хирургическое лечение по поводу различных гинекологических заболеваний получали 12/118 (10,2%): гистерэктомии без придатков по поводу миомы матки выполнены у 6/12 (50%), гистерэктомии с маточными трубами без яичников – у 1/12 (8,3%), клипирование маточных труб – у 1/12 (8,3%), резекции яичников и/или цистэктомии – у 4/12 (33,4%).
При обнаружении мутации у больной РЯ родственникам предлагалось пройти генетическое тестирование и клиническое обследование. В группе обследованных родственников – носителей мутаций у 2/72 (2,7%) пациенток диагностирован РЯ и рак маточной трубы. Здоровым носительницам мутаций в гене BRCA1 экстирпация матки с придатками выполнена у 5 (62,5%), двусторонняя аднексэктомия –у 3 (37,8%) (таблица). Ни в одном из 8 случаев в профилактически удаленных яичниках и маточных трубах не были обнаружены клетки аденокарциномы.
При оценке менопаузального статуса (индекса Куппермана) только одна прооперированная носительница мутаций предъявляла активные жалобы на симптомы хирургической менопаузы (11 баллов). Пациентки были в целом довольны выбором стратегии хирургической профилактики РЯ и отмечали уменьшение чувства беспокойства и тревоги.
Обсуждение
Целесообразность выполнения профилактических операций у носительниц мутаций определяется значительным снижением заболеваемости РЯ в группе подвергшихся профилактической овариэктомии по сравнению с женщинами из «группы наблюдения». Так, например, Medeiros F. и cоавт. выявили РЯ у 1% BRCA1/2-носительниц после овариэктомии, в то время как этот показатель в контрольной группе достигал 6% [9]. Риск гибели от РМЖ или РЯ составлял 3% в случае профилактической овариэктомии и 10% – в группе мониторинга. Во многих клинических рекомендациях по снижению риска заболеваемости РЯ у носительниц мутаций предлагается проводить профилактические операции в возрасте 35–40 лет для носительниц мутаций в гене BRCA1, 40–45 лет – для носительниц мутаций в гене BRCA2.
Ряд авторов выдвигают предположение о первичном развитии опухолевого процесса в бахромчатом эпителии маточных труб, так называемых серозных интраэпителиальных маточных карциномах, которые морфологически и генетически схожи с серозным РЯ [10–12]. Mehra K. и cоавт. провели исследование морфологических находок в эпителии фаллопиевых труб после двусторонней профилактической тубовариэктомии у условно здоровых женщин с BRCA-мутациями (BRCA1: n=149, BRCA2: n=77) и в группе без мутаций (n=105). После двусторонней тубовариэктомии STIC обнаружена у 14 женщин, инвазивный рак – у 2. Все случаи рака были обнаружены в группе носительниц мутации, тогда как в группе контроля не было обнаружено ни одного случая злокачественного поражения маточных труб. В зависимости от локализации STIC обнаружена в фимбриальном отделе трубы в 9 случаях, в нефимбриальном (истмус, ампулярный отдел) – в 5. Оба инвазивных рака обнаружены в фимбриальном отделе маточной трубы [13]. На основании накопленных данных о том, что серозная карцинома high grade может происходить из маточных труб, двусторонняя сальпингэктомия (без овариэктомии) может снизить риск возникновения РЯ у носителей мутации BRCA1 или BRCA2 и отсрочить или избежать хирургической менопаузы. Поэтому была предложена профилактическая сальпингэктомия с отсроченной овариэктомией. Так, например, Anderson и соавт. обнаружили, что риск возникновения РЯ на 64% ниже (ОШ 0,36; 95% ДИ 0,13–1,02) среди женщин, перенесших профилактические операции с удалением только маточных труб (т.е. полная сальпингэктомия, частичная сальпингэктомия или дистальная фимбриэктомия), по сравнению с женщинами из контрольной группы [14]. Многоцентровое нерандомизированное проспективное пилотное исследование демонстрирует преимущества стратегии отсроченной овариэктомии: 43 женщины с высоким риском возникновения РЯ в возрасте 30–47 лет были проинструктированы пройти отсроченную овариэктомию в возрасте 40 лет для носительниц мутаций в гене BRCA1 и в возрасте 45 лет для носительниц мутаций в гене BRCA2. Среди всех женщин 19/43 (44%) выбрали отсроченную стратегию, 12/43 (28%) – овариэктомию и 12/43 (28%) – скрининг [15].
В нашем исследовании при обследовании родственников больных РЯ – носителей мутаций в 2,7% случаев был диагностирован инвазивный рак, при этом у 8 здоровых носительниц мутаций по результатам профилактических операций оккультных форм рака не обнаружили.
Заключение
Таким образом, сальпингэктомия во время различных гинекологических операций безопасна и может представлять защиту от РЯ без ущерба для эндокринной функции. Кроме того, стратегия отсроченной сальпингэктомии может также служить эффективной альтернативной профилактической стратегией для женщин с генетической предрасположенностью к РЯ.
- Alsop K., Fereday S., Meldrum C., et al. BRCA Mutation Frequency and Patterns of Treatment Response in BRCA Mutation–Positive Women With Ovarian Cancer: A Report From the Australian Ovarian Cancer Study Group. JCO. 2012; 30: 2654–63. doi: 10.1200/JCO.2011.39.8545
- Gorodnova T.V., Sokolenko A.P., Ivantsov A.O., et al. High response rates to neoadjuvant platinum-based therapy in ovarian cancer patients carrying germ-line BRCA mutation. Cancer Lett. 2015; 2: 363–7. doi: 10.1016/j.canlet.2015.08.028
- Ingham S.L., Sperrin M., Baildam A., et al. Risk-reducing surgery increases survival in BRCA1/2 mutation carriers unaffected at time of family referral. Breast Cancer Res Treat. 2013; 3: 611–8. doi: 10.1007/s10549-013-2765-x.
- Nelson H.D., Pappas M., Zakher B., et al. Risk assessment, genetic counseling, and genetic testing for BRCA-related cancer in women: a systematic review to update the U.S. Preventive Services Task Force recommendation. Ann Intern Med. 2014; 4: 255–66. doi: 10.7326/M13-1684
- Rice M.S., Murphy M.A., Tworoger S.S. Tubal ligation, hysterectomy and ovarian cancer: a meta-analysis. J. Ovarian Res. 2012; 5(1): 2415–21. http://dx.doi.org/10.1186/1757-2215-5-13
- Kotsopoulos J., Huzarski T., Gronwald J., et al. Bilateral Oophorectomy and Breast Cancer Risk in BRCA1 and BRCA2 Mutation Carriers. J Natl Cancer Inst. 2016; 109(1): 255–66. doi: 10.1093/jnci/djw177
- Suspitsin E.N., Sherina N.Y., Ponomariova D.N., et al. High frequency of BRCA1, but not CHEK2 or NBS1 (NBN), founder mutations in Russian ovarian cancer patients. Hered Cancer Clin Pract. 2009; 7(1): 5. doi:10.1186/1897-4287-7-5
- Domchek S.M., Friebel T.M., Singer C.F., et al. Association of risk-reducing surgery in BRCA1 or BRCA2mutation carriers with cancer risk and mortality. JAMA. 2010; 9: 967–75. doi: 10.1001/jama.2010.1237
- Medeiros F., Muto M.G., Lee Y., et al. The tubal fimbria is a preferred site for early adenocarcinoma in women with familial ovarian cancer syndrome. Am J Surg Pathol. 2006; 30(2): 230–6. doi: 10.1097/01.pas.0000180854.28831.77
- Labidi-Galy S.I., Papp E., Hallberg D. High grade serous ovarian carcinomas originate in the fallopian tube. Nat Commun. 2017; 8(1): 1093. doi:10.1038/s41467-017-00962-1
- Marquez R.T., Baggerly K.A., Patterson A.P., et al. Patterns of gene expression in different histotypes of epithelial ovarian cancer correlate with those in normal fallopian tube, endometrium, and colon. Clin Cancer Res. 2005;11(17): 6116–26. doi: 10.1158/1078-0432.CCR-04-2509
- Ducie J., Dao F., Considine M., et al. Molecular analysis of high-grade serous ovarian carcinoma with and without associated serous tubal intra-epithelial carcinoma. Nat Commun. 2017; 8(1): 990. doi: 10.1038/s41467-017-01217-9
- Mehra K.K., Chang M.C., Folkins A.K., et al. The impact of tissue block sampling on the detection of p53 signatures in fallopian tubes from women with BRCA 1 or 2 mutations (BRCA+) and controls. Mod Pathol. 2011; 24(1): 152–6. doi: 10.1038/modpathol.2010.171.
- Anderson C.K., Wallace S., Guiahi M., Sheeder J., Behbakht K., Spillman M.A. Risk-reducing salpingectomy as preventative strategy for pelvic serous cancer. Int J Gynecol Cancer. 2013; 23(1): 417–21. doi: 10.1097/IGC.0b013e3182849dba.
- Nebgen D.R., Hurteau J., Holman L.L., Bradford A., Munsell M.F., Soletsky B.R., et al. Bilateral salpingectomy with delayed oophorectomy for ovarian cancer risk reduction: a pilot study in women with BRCA1/2 mutations. Gynecol Oncol. 2019; 20: 117–20. doi: 10.1016/j.ygyno.2018.04.564
Received 20.12.2019
Accepted 26.12.2019
Tatiana V. Gorodnova, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology. Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)596-89-47. E-mail:
t.gorodnova@mail.ru SPIN-код: 7239-5933, AuthorID: 854658
Pesochny-2, St.-Petersburg, 197758, Russia.
Anna P. Sokolenko, MD, PhD, Department of Tumor Biology, N.N. Petrov Institute of Oncology (St.-Petersburg, Russia). E-mail:
annasokolenko@mail.ru.
AuthorID: 153982.
Pesochny-2, St.-Petersburg, 197758, Russia.
Khristina B. Kotiv, Postgraduate, Department of Oncogynecology, N.N. Petrov Institute of Oncology (St.-Petersburg, Russia). E-mail:
xristinabogdanovna@gmail.com.
SPIN-code: 3049-8250.
Pesochny-2, St.-Petersburg, 197758, Russia.
Maria G. Yakovleva Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
mersend@mail.ru SPIN-код автора в РИНЦ: 2661-9106; ORCID: 0000-0003-1719-7498
Pesochny-2, St.-Petersburg, 197758, Russia.
Olga E. Lavrinovich, Oncologist, PhD, Head of department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
olgalav1973@mail.ru; AuthorID: 383329
Pesochny-2, St.-Petersburg, 197758, Russia.
Nikolay A. Mikaya, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
nmikaya@mail.ru; SPIN-код: 1566-1789, AuthorID: 919303; Scopus AuthorID: 56801905000
Pesochny-2, St.-Petersburg, 197758, Russia.
Zaur N. Ibragimov, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru; SPIN-код: 4788-1510; AuthorID: 277962.
Pesochny-2, St.-Petersburg, 197758, Russia.
Yuri N. Trifanov, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Pesochny-2, St.-Petersburg, 197758, Russia.
Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru; AuthorID: 306796; Scopus AuthorID: 57031846900
Pesochny-2, St.-Petersburg, 197758, Russia.
Nikolay E. Bondarev, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
ssmirnova.oa@gmail.com; SPIN-код: 9309-7703, AuthorID: 1019011
Pesochny-2, St.-Petersburg, 197758, Russia.
Ekaterina A. Nekrasova, candidate of medical sciences, researcher at the Department of Oncogynecology of the Federal State Budgetary Institution “National Medical Research Center of Oncology named after N.N. Petrov” of the Ministry of Health of the Russian Federation. Tel .: +7 (812) 439-9555. Fax: (812) 596-8947.
E-mail:
ekaterina_neks@mail.ru
Address: 197758 St. Petersburg, pos. Sand, st. Leningradskaya, 68
Anna A. Sidoruk, Resident at the Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
sidoruk_ann@mail.ru.
Pesochny-2, St.-Petersburg, 197758, Russia.
Olga A. Smirnova, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
meshkova.62@bk.ru
Pesochny-2, St.-Petersburg, 197758, Russia.
Konstantin D. Guseynov, Oncologist, MD, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47.E-mail:
oncl@rion.spb.ru; SPIN-код: 5191-8792, AuthorID: 203398; Scopus AuthorID 10739227400
Pesochny-2, St.-Petersburg, 197758, Russia.
Elena V. Bakhidze, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru SPIN-код: 5191-8792, AuthorID: 203398; Scopus AuthorID: 56632534700
Pesochny-2, St.-Petersburg, 197758, Russia.
Iryna E. Meshkova, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru; Scopus AuthorID:56801862100
Elvina Kh. Bakaeva, Resident at the Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru
Pesochny-2, St.-Petersburg, 197758, Russia.
Marianna G. Shikhzadaeva, Resident at the Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru
Pesochny-2, St.-Petersburg, 197758, Russia.
Elena A. Ulrikh, MD, professor, professor of the Department of Oncology, North-West State Medical University them. I.I. Mechnikov, a doctor of the highest category of oncogynecological department of the Federal State Budgetary Institution Scientific Research Center for Oncology N.N. Petrova ”Ministry of Health of the Russian Federation.Tel.: (007)-(812)-596-84-21. Fax: (007)-(812)-596-89-47. E-mail:
elenaulrikh@yandex.ru; ORCID: 0000-0002-1593-6771
Pesochny-2, St.-Petersburg, 197758, Russia.
Adel F. Urmancheeva, M.D., Ph.D., Leading Researcher at the Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology;
Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47, Professor at the Department of Oncology of North-Western State Medical University
na I.I. Mechnikov, St.-Petersburg.
E-mail:
adaurm@mail.ru; SPIN-код: 1110-1844; AuthorID: 668989; Scopus AuthorID: 55943009000
Pesochny-2, St.-Petersburg, 197758, Russia.
Igor V. Berlev, M.D., Ph.D, professor, Leading Researcher at the Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology;
Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47, Professor at the Department of Oncology of North-Western State Medical University
na I.I. Mechnikov, St.-Petersburg E-mail:
iberlev@gmail.com; SPIN-код: 4169-6011; AuthorID: 668976; Scopus AuthorID: 6603322008
Pesochny-2, St.-Petersburg, 197758, Russia.
Evgeny N. Imyanitov, MD, DSc, Professor, Corresponding Member of the Russian Academy of Sciences, Head of the Department of Tumor Biology, N.N. Petrov Institute of Oncology (St.-Petersburg, Russia). E-mail:
evgeny@imyanitov.spb.ru. SPIN-code: 1909-7323.
Pesochny-2, St.-Petersburg, 197758, Russia.
Alexey M. Belyaev, M.D., Ph.D., Professor, Нead of Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47, Нead of Department of Gynecology of North-Western State Medical University na I.I. Mechnikov, St.-Petersburg. E-mail:
oncl@rion.spb.ru; Author ID: 274121; ORCID: 0000-0001-6937-2740; Scopus AuthorID: 54995192000
Pesochny-2, St.-Petersburg, 197758, Russia.
For citation: Gorodnova T.V., Sokolenko A.P., Kotiv Kh.B., Yakovleva M.G., Lavrinovich O.E., Mikaya N.A., Ibragimov Z.N., Trifanov Yu.N., Bondarev N.E., Nekrasova E.A., Sidoruk A.A., Smirnova O.A., Guseinov K.D., Bakhidze E.V., Meshkova I.E., Bakaeva E.Kh., Shikhzadaeva M.G., Ul’rikh E.A., Urmancheeva A.F., Berlev I.V., Imyanitov E.N., Belyaev A.M. Prophylactic surgery in carriers of BRCA1 or BRCA2 gene mutation.
Akusherstvo i Ginekologiya/Obstetrics and Gynecology. 2020; 1(Suppl): 56-62.(in Russian)
https://dx.doi.org/10.18565/aig.2020.1suppl.56-62




