Работа поддержана грантом Президента Российской Федерации НШ – 1694.2014.7.
При наступлении беременности полуаллогенный плод, клетки которого содержат отцовские аллогенные антигены, не отторгается организмом матери благодаря комплексу иммунологических механизмов, действующих в период гестации. Сбалансированные взаимоотношения между иммунной системой матери и клетками плода приводят к формированию толерантности, необходимой для успешного развития беременности. Недостаточная или избыточная активность иммунологических реакций приводит к осложнениям течения беременности [1].
Отторжение эмбриона, вызванное иммунологическими нарушениями, клинически наиболее ярко проявляется при потерях беременности в ранние сроки. По данным разных авторов, у 1–5% пар с повторяющимися спонтанными потерями беременности плод имеет нормальный кариотип. Считается, что в таких случаях прерывание обусловлено иммунологическими причинами [2, 3].
Одним из подходов к лечению женщин с привычным выкидышем иммунного генеза является иммуноцитотерапия (ИЦТ) – иммунизация женщин лейкоцитарными клетками периферической крови партнеров (аллоиммунизация) в течение первого триместра беременности [2–4]. ИЦТ рассматривается как способ снижения активного иммунного ответа провоспалительной направленности (Th1-типа), на фоне которого беременность у женщин с привычным выкидышем не пролонгируется. Чрезмерный воспалительный ответ во время имплантации (5–6 недель гестации) во время последующей инвазии трофобласта может быть причиной прерываний беременности на ранних сроках [5, 6]. Поэтому успех использования ИЦТ прежде всего связывают с формированием иммунного ответа на антигены партнера противовоспалительной направленности (Th2-типа) [7].
На сегодняшний день считается, что для пациенток с привычным и угрожающим выкидышем иммунологической природы аллоиммунизация может быть проведена как можно раньше при наступлении беременности и даже в период предгестационной подготовки [4, 8]. В качестве иммунологических критериев прогноза развития беременности на ранних ее этапах на фоне применения ИЦТ используется оценка продукции иммунными клетками биологически активных молекул, и прежде всего цитокинов [9, 10].
До сих пор изучались лишь отдельные показатели цитокинового статуса на определенных сроках гестации, а динамика продукции цитокинов активированными in vitro мононуклеарными клетками (МНК) периферической крови в процессе предгестационной подготовки с использованием процедуры аллоиммунизации и последующей беременности, прогрессирующая на фоне аллоиммунизации в первом триместре, не изучалась [11, 12].
Целью данной работы стало изучение продукции провоспалительных (Th1-типа) и противовоспалительных (Th2-типа) цитокинов митоген-стимулированными МНК периферической крови пациенток с привычным выкидышем на фоне аллоиммунизации в период предгестационной подготовки и в первом триместре беременности, завершившейся рождением живого ребенка.
Материал и методы исследования
Обследованы 20 женщин с привычным выкидышем ранних сроков в анамнезе в процессе предгестационной подготовки с использованием ИЦТ. У 12 пациенток наступившая беременность завершилась рождением живого ребенка.
В исследование включены женщины, имеющие в анамнезе не менее двух спонтанных выкидышей от одного партнера при условии нормального кариотипа у плода. Критериями исключения были анатомические нарушения органов репродуктивной системы, наличие инфекционных, аутоиммунных, аллергических и эндокринных заболеваний, тяжелая экстрагенитальная патология, использование ИЦТ для лечения привычного выкидыша в течение последних двух лет.
Пациентки были обследованы до назначения лечения, в течение предгестационной подготовки и в течение наступившей беременности.
Предгестационная подготовка включала процедуру аллоиммунизации: пациенткам дважды с интервалом в один месяц на 5–9-й день менструального цикла подкожно вводили 50 млн клеток лейкоцитарной взвеси партнера в ладонную поверхность предплечья в 10–12 точек. Во время наступившей беременности аллоиммунизацию проводили на сроке в 5–6 и 8–9 недель, согласно протоколу ведения беременности у пациенток с привычным выкидышем.
Кровь для анализа забирали натощак из локтевой вены: вне беременности – до назначения лечения (n=9) и после процедуры иммунизации на 18–22-й день менструального цикла (n=10), во время беременности – на сроке 8–9 (n=7), 12–15 (n=9), 22–24 (n=9) и 33–34 (n=12) недели гестации.
МНК выделяли стандартным методом центрифугирования с использованием смеси фиколл-верографин плотностью 1,077.
Продукцию цитокинов в культуральной среде оценивали после стимуляции МНК конканавалином А (КонА) в дозе 10 мкг/мл в течение 24 ч. Содержание цитокинов оценивали с помощью мультиплексного анализа с использованием системы Cytometric Bead Array (Becton Dickinson, США) и проточного цитофлуориметра FACSCalibur (Becton Dickinson, США). Определяли содержание цитокинов провоспалительной (интерферон (ИФН)-γ, фактор некроза опухоли (ФНО)-α, интерлейкин (ИЛ)-2, ИЛ-6, ИЛ-8) и противовоспалительной (ИЛ-4, ИЛ-10) направленности.
Статистическую обработку данных проводили общепринятыми методами вариационной статистики. Данные представлены на рисунках, выполненных с помощью статистического пакета MedCalc12 для Windows 7. Точками обозначены полученные значения цитокинов, линия тренда связывает средние значения показателей на каждом сроке обследования, маркеры указывают величину стандартной ошибки среднего. Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Колмогорова–Смирнова. Значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью двухвыборочного t-критерия Стьюдента с различными дисперсиями для средних значений с использованием пакета статистического анализа для Microsoft Office Excel 2007.
Результаты исследований
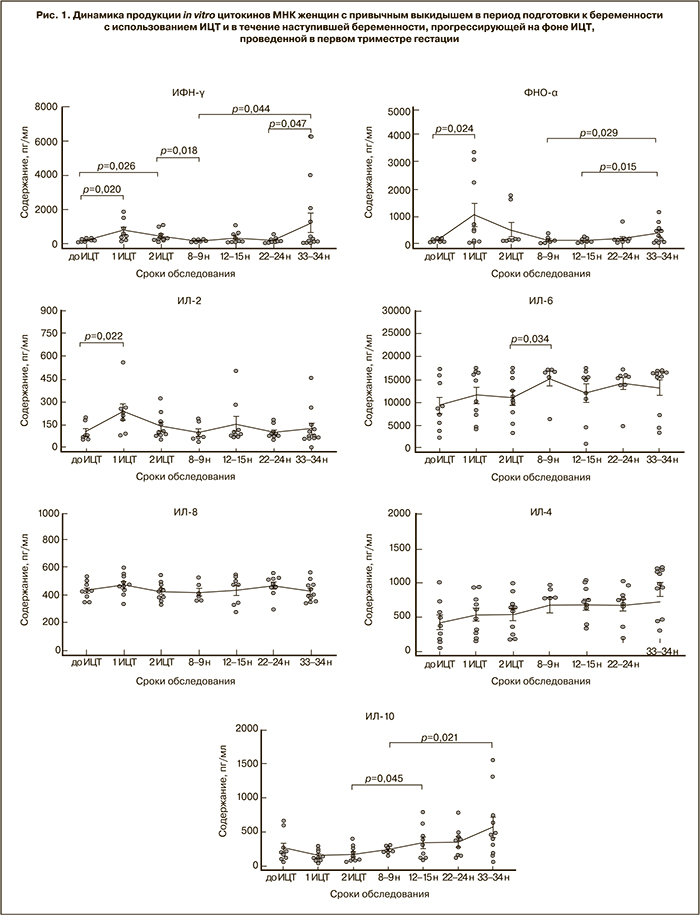
Результаты оценки продукции цитокинов стимулированными in vitro МНК периферической крови пациенток с привычным выкидышем представлены на рис. 1 и 2.
После первой процедуры аллоиммунизации отмечается увеличение продукции провоспалительных цитокинов ИФН-γ, ФНО-α и ИЛ-2, а также тенденция к уменьшению продукции противовоспалительного цитокина ИЛ-10 (р=0,08). Увеличение соотношения ИФН-γ/ИЛ-10 и ФНО-α/ИЛ-10 свидетельствует о превалировании цитокинов провоспалительной направленности на этом сроке обследования.
После второй процедуры аллоиммунизации продукция ИФН-γ остается значимо увеличенной.
Изменений в продукции ИЛ-6 в период предгестационной подготовки не отмечено, однако соотношение ИЛ-6/ИЛ-10 по сравнению с исходным уровнем значимо выше и после первой, и после второй процедуры иммунизации.
На сроке 8–9 недель наступившей беременности, после аллоиммунизации в 5–6 недель, зарегистрировано увеличение продукции ИЛ-6 и снижение продукции ИФН-γ по сравнению с уровнем этих показателей после второй иммунизации вне беременности.
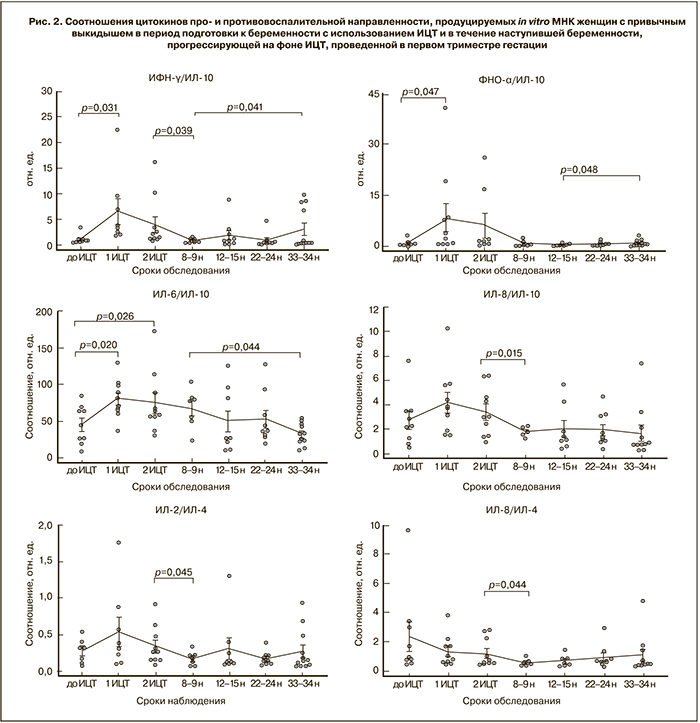
Кроме того, на сроке 8–9 недель гестации выявлено значимое снижение соотношений цитокинов ИЛ-2/ИЛ-4, ИЛ-8/ИЛ-4, ИЛ-8/ИЛ-10, ИФН-γ/ИЛ-10, что свидетельствует о развитии интенсивных противовоспалительных реакций в этот период.
На сроке в 12–15 недель после аллоиммунизации в 8–9 недель наблюдалось увеличение продукции ИЛ-10.
Во втором триместре беременности продукция всех исследованных цитокинов не отличалась от их уровня, определяемого в первом триместре. Надо отметить, что изменений в продукции ИЛ-2, ИЛ-8 и ИЛ-4 не было выявлено в течение всего периода наблюдения прогрессирующей беременности.
К середине третьего триместра обнаруживалась тенденция к увеличению продукции цитокинов провоспалительной направленности (ИФН-γ и ФНО-α) и увеличение соотношений ИФН-γ/ИЛ-10, ФНО-α/ИЛ-10, несмотря на то что продукция ИЛ-10 оказалась даже выше по сравнению с уровнем в 8–9 недель. Видимо, по этой причине соотношение ИЛ-6/ИЛ-10 на сроке 33–34 недели было сниженным, поскольку изменений в продукции ИЛ-6 во второй половине беременности не отмечалось.
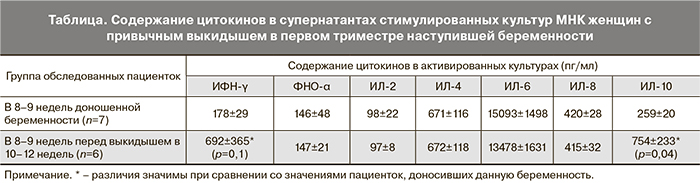
Нами исследована продукция цитокинов в 8–9 недель беременности у пациенток с состоявшимся в 10–12 недель выкидышем на фоне аналогичной предгестационной подготовки с использованием ИЦТ (таблица).
Перед выкидышем обнаруживалось увеличение содержания ИФН-γ в 3,9 раза и ИЛ-10 в 2,9 раза. Интересно, что формирование аналогичного Th1/Th2-профиля, при котором наблюдалось увеличение продукции ИФН-γ наряду со значительным увеличением продукции ИЛ-10, было обнаружено в конце беременности у женщин с нормальным течением гестации.
Известно, что IL-10 является ключевым иммунорегуляторным цитокином, обусловливающим толерантность во время беременности [10]. В экспериментальных моделях показано, что дефицит IL-10 приводит к повышению риска выкидыша и задержке внутриутробного развития плода у мышей [13]. Имеются данные, что IL-10 регулирует экспрессию молекулы HLA-G клетками трофобласта и моноцитами периферической крови, а также децидуальными стромальными клетками [14].
Нами получены данные о том, что «избыточная» продукция ИЛ-10 также может ассоциироваться с вероятностью реализации самопроизвольного выкидыша, хотя «избыточность» продукции, учитывая его функции как регуляторного цитокина, может быть связана с развитием компенсаторных реакций, вызванных многократным увеличением содержания провоспалительного цитокина ИФН-γ.
Таким образом, проведенные исследования выявили иммуномодулирующие эффекты ИЦТ в период предгестационной подготовки, проявляющиеся в увеличении уровня продукции in vitro провоспалительных цитокинов ИФН-γ, ФНО-α, ИЛ-2 и тенденцией к уменьшению продукции ИЛ-10 стимулированными МНК периферической крови женщин, у которых наступила и в дальнейшем нормально протекала беременность, закончившаяся рождением живого ребенка. Указанные эффекты характеризуют превалирование перед наступлением беременности продукции цитокинов Th1-направленности. Полученные результаты согласуются с современными представлениями о необходимости провоспалительного фона для благополучной имплантации бластоцисты и для успешного протекания процессов первой волны инвазии трофобласта в спиральные артерии [5, 6].
Снижение соотношений цитокинов ИЛ-2/ИЛ-4, ИЛ-8/ИЛ-4, ИЛ-8/ИЛ-10, ИФН-γ/ИЛ-10 на сроке 8–9 недель гестации может свидетельствовать о формировании к этому сроку Th2-профиля иммунокомпетентных клеток, обеспечивающего толерантность иммунной системы матери к аллоантигенам плода.
Начиная с середины третьего триместра отмечалось увеличение продукции цитокинов провоспалительной направленности и увеличение соотношений ИФН-γ/ИЛ-10, ФНО-α/ИЛ-10, что согласуется с данными, что механизмы иммунорегуляции последнего этапа беременности и родов включают в себя физиологические воспалительные процессы [5].
В целом, полученные результаты подтверждают представление о том, что направленность Th1/Th2-реакций зависит от срока гестации – на самых ранних стадиях беременности преобладают воспалительные реакции, сдвиг в сторону Th-2-направленности наблюдается на более поздних сроках, а в конце беременности снова преобладает провоспалительный фон [5].
Таким образом, превалирование цитокинов как Th1 так и Th2 профиля может отражать как недостаточную, так и избыточную активность иммунологических реакций, приводящих к осложнениям течения беременности. Очевидно, что мониторинг Th1/Th2-реакций при аллогенной иммунизации может стать основой как для понимания роли иммунной системы в регуляции репродуктивной функции, так и для повышения эффективности лечения привычного выкидыша.



