Предменструальный синдром (ПМС), или синдром предменструального напряжения (СПМН) – распространенное патологическое состояние, характеризующееся нарушением эмоционального и физического статусов, общего самочувствия на протяжении менструального цикла, возникновением соматических, поведенческих симптомов и нарушением настроения во вторую фазу менструального цикла. Частота ПМС в женской популяции варьируется от 20 до 90%, при этом до 40% женщин страдают достаточно тяжелыми формами ПМС, а 5% теряют трудоспособность [4, 6].
Описано более 200 симптомов ПМС, которые условно можно разделить на 3 группы. Наиболее
характерными являются поведенческие симптомы: усталость, бессонница, головокружение,
изменение либидо, изменение пищевых пристрастий и потребностей. Группа психологических симптомов: раздражительность, гнев, депрессия, плаксивость, нервозность, напряженность, снижение концентрации внимания, непоследовательность, забывчивость, беспокойство, ощущение одиночества, снижение самооценки и группа физических симптомов – головная боль, нагрубание и болезненность молочных желез, боли в спине и животе, вздутие живота, увеличение массы тела, отечность, тошнота [4, 6, 7]. Как правило, впервые симптомы ПМС возникают у женщины в возрасте 25–35 лет, могут сохраняться в течение 15 лет и исчезнуть только после
наступления менопаузы.
Этиология ПМС окончательно не выяснена, но мультифакторность и многокомпонентность воздействий, приводящих к развитию ПМС, не вызывают сомнений. Предполагают, что причинами ПМС могут быть следующие факторы:
· изменение уровня гормонов, которые через центральные механизмы регуляции приводят
к активации нейротрансмиттеров, например серотонина;
· недостаток секреции прогестерона в лютеиновую фазу цикла или изменение чувствительности
рецепторов к прогестерону;
· дефицит простагландинов, обусловленный нарушением перехода линолевой кислоты в предшественники простагландинов;
· латентная гиперпролактинемия, для которой характерно повышение уровня пролактина в ночное время и при стрессах [4–6].
ПМС не имеет специфических биохимических и других объективных маркеров, по которым можно уточнить диагноз. Отсутствие единой обоснованной теории и лабораторных критериев ПМС обусловливает сложность подбора терапии и многообразие методов лечебного воздействия.
Основной целью лечения является уменьшение тяжести или устранение симптомов ПМС, их влияния на качество жизни и минимизация побочных эффектов терапии, в связи с чем целесообразно включать в лечебный комплекс препараты растительного происхождения.
Выделенные из экстракта растения Vitex аgnus сastus (VAC) бициклические терпены могут связывать эндорфиновые рецепторы, плоды содержат иридоиды и флавоноиды, а листья и цветки – соединения, по структуре сходные с половыми гормонами, а по механизму действия – с гормонами желтого тела. Важно отметить, что при использовании экстракта VАС снижение продукции пролактина происходит без прямого воздействия на уровень гонадотропинов и прогестерона [3, 5, 8].
Целью исследования явилось изучение эффективности и переносимости препарата агнукастон (циклодинон) при лечении среднетяжелых и тяжелых форм ПМС у женщин репродуктивного возраста.
Материал и методы исследования
Исследование проводилось в соответствии с международными стандартами качественной клинической практики (ICH-GCP), принципами Хельсинкской декларации и было одобрено Комитетом по этике биомедицинских исследований при Федеральном агентстве контроля качества, эффективности, безопасности лекарственных средств и этическим комитетом НЦ АГиП им. академика В.И. Кулакова. Мониторирование исследования проводилось в соответствии с требованиями ICN GCP Guidelines. Проспективное открытое несравнительное моноцентровое (фаза IV) исследование состояло из двух этапов длительностью по 3 мес: I этап – обследование и включение, II этап – лечение препаратом, содержащим 40 мг экстракта Vitex agnus castus – агнукастоном (циклодиноном) по 1 таблетке в день сразу после сна в течение 3 менструальных циклов.
В течение всего периода исследования пациентки заполняли дневники для оценки тяжести ПМС, эффективности лечения, изменения состояния и наличия неблагоприятных эффектов (ПМС-дневники).
В период набора с целью определения соответствия пациенток критериям включения/исключения все женщины прошли обследование, включавшее тщательный сбор анамнеза, клинический и биохимический анализы крови, анализ мочи, эхографию органов малого таза и молочных желез, гинекологическое обследование. Клинически значимых отклонений от нормативных показателей не выявлено.
В исследование были включены пациентки в возрасте от 18 до 45 лет (средний возраст 29,6±7,2 года) без серьезной соматической патологии, с продолжительностью менструальных циклов 28–32 дня в течение 12 мес, при наличии подписанного информированного согласия, заполненной шкалы самооценки с суммой баллов ≥18. Большинство пациенток (99%) не курили и никто не злоупотреблял алкоголем.
Критерии исключения из исследования: прием гормональных контрацептивов в течение 6 предыдущих (предшествующих) месяцев, гормонов гипоталамуса, гипофиза и их ингибиторов, нейролептиков и антидепрессантов, ингибиторов обратного захвата серотонина, ингибиторов пролактина; любое психиатрическое лечение; наличие эндокринных заболеваний (сахарного диабета 1 и 2 типа, гиперпролактинемии >20 нг/мл, гипо- или гипертиреоза, опухоли гипофиза); хронические заболевания почек, печени, язвенная болезнь желудка и двенадцатиперстной кишки в активной стадии, синдром мальабсорбции, гиперсекреция желчных кислот; эндометриоз, заболевания молочных желез, галакторея, беременность, кормление грудью, желание забеременеть; предшествующее началу исследования хирургическое вмешательство, любое лечение ПМС в период набора.
Для оценки эффективности препарата главный показатель эффективности (первичная конечная точка) определялся по изменению средних суммарных показателей ПМС-дневников после 3 циклов лечения в сравнении с соответствующими показателями до лечения. С этой целью каждые 7 дней перед менструацией суммировали результаты 18 симптомов (перепады настроения, депрессия, раздражительность, беспокойство, вспыльчивость, приступы плаксивости, отеки конечностей, набухание молочных желез, боли в молочных железах, вздутие живота, боли внизу живота, генерализованные боли, боли в пояснице, головная боль, усталость, изменения аппетита, тяга к сладкому или соленому, бессонница), указанных в ПМС-дневнике, в баллах. Средний суммарный показатель этих 7 дней, рассчитанный в исходном цикле и в последнем, 3-м цикле лечения, сравнивали с целью оценки результатов лечения.
Второстепенными показателями эффективности (вторичными конечными точками) являлись несколько параметров:
1. Изменения средней суммарной величины (средняя арифметическая от суммы баллов) ПМС-дневников после 1-го и 2-го менструальных циклов в период лечения по сравнению
с исходным состоянием. Подсчет разницы значений до и после лечения был аналогичным оценке
первичной конечной точки (Δ цикл 0-цикл 1-й и Δ цикл 0-цикл 2-й соответственно).
2. Доля респондеров, рассчитанная на основе ПМС-дневников после 3 мес лечения. При этом
пациентка определялась как респондер, если у нее на фоне лечения наблюдалось клиническое улучшение и, по данным оценки дневников, средний суммарный показатель после 3 циклов лечения уменьшался на 40% и более по сравнению с исходными данными.
3. Изменение среднего суммарного показателя шкалы самооценки симптомов предменструального напряжения (СПМН) — опросника после 3 циклов лечения по сравнению с исходными данными.
4. Доля респондеров, рассчитанная на основании шкалы самооценки СПМН-опросника
после 3 циклов лечения.
Результаты исследования и обсуждение
После обследования и предварительной оценки ПМС-дневников лечение было назначено
121 пациентке с подтвержденным диагнозом ПМС. Позднее, в связи с нарушением протокола
(неправильное заполнение дневников) 3 женщины были исключены из статистического анализа,
и эффективность лечения оценивали у 118 пациенток. Полностью завершили исследование 106
пациенток (12 выбыли в связи с возникшими неблагоприятными явлениями). Характеристика
пациенток представлена в таблице 1.
Таблица 1. Характеристика пациенток, которым было назначено лечение (n=121).
Таблица 2. Характеристика побочных явлений и их связь с лечением (n=66).
Основную оценку эффективности проводили по данным ПМС-дневников путем сравнения интенсивности 18 симптомов, выраженных в баллах. Средние суммарные показатели дневников после 1-го, 2-го, 3-го циклов по сравнению с исходными данными указывают на то, что в процессе лечения выраженность жалоб постепенно уменьшалась. Так, средний суммарный показатель перед началом лечения варьировался от 10,9 до 47,9 балла и в среднем составлял 22,8±6,6 балла, а после лечения показатель снизился примерно до середины исходного уровня от 0,0 до 35,9 балла и в среднем составил 10,2±8,0 балла (первичная конечная точка).
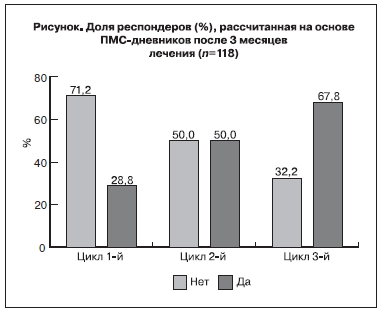
Затем оценивали такой показатель, как число женщин, у которых достигнуто клиническое
улучшение после 3 мес лечения (см. рисунок). Положительный эффект от лечения через 1 мес
отметили 28,8% женщин, что проявилось в уменьшении суммарного показателя ПМС-дневников.
К окончанию лечения у 67,8% женщин наблюдалось значительное клиническое улучшение состояния, средний суммарный показатель по ПМС-дневникам снизился на 40% и более по сравнению с исходным (вторичная конечная точка).
По данным СПМН-опросников, после 3 циклов лечения у 70 (59,3%) пациенток произошло значительное улучшение состояния, у 40,7% улучшения не наблюдалось. Оценку безопасности препарата проводили на основании частоты и интенсивности побочных эффектов, которые на фоне лечения возникли у 30 (24,8%) из 121 пациентки, при этом преобладали различные гастроинтестинальные симптомы (42,4% из числа всех неблагоприятных явлений), головные боли (24,2%), кожно-аллергические реакции (зуд, покраснение – 15,2%). В связи с этим 12 (9,9%) пациенток досрочно прекратили прием препарата.
Степень выраженности большинства неблагоприятных явлений из всех зарегистрированных (69,7%) была слабой или умеренной (табл. 2). Половина побочных реакций и неблагоприятных явлений возникла в течение первого месяца приема препарата, впоследствии их частота уменьшилась. Серьезные побочные реакции в период терапии не зарегистрированы Результаты лечения позволили сделать вывод, что созданный на основе экстракта VAC препарат агнукастон (циклодинон) является эффективным и приемлемым для лечения среднетяжелого и тяжелого ПМС.
Клиническая картина ПМС характеризуется разнообразием симптоматики, что наряду с недостаточно изученным этиопатогенезом обусловливает многообразие терапевтических подходов к лечению. Терапию следует начинать с применения немедикаментозных методов, затем можно подключать фармакологические средства [4, 6]. Рациональная схема включает психотерапию, полноценное питание и лечебную физкультуру, которые являются основой лечения всех форм ПМС. В зависимости от преобладания тех или иных симптомов используют витамины, диуретики, нестероидные противовоспалительные средства, антидепрессанты, фитопрепараты, а также пероральные контрацептивы и гестагены. Нестероидные противовоспалительные средства в основном применяют для лечения циклического болевого синдрома, возникающего в лютеиновую фазу менструального цикла. Психогенные нарушения эффективно корригируются антидепрессантами – селективными ингибиторами обратного захвата серотонина [2]. Однако препараты этой группы имеют такие побочные эффекты, как бессонница, сонливость, повышенная утомляемость, головная боль, тошнота, тревога, сексуальные расстройства [2]. В качестве альтернативы синтетическим антидепрессантам можно применять экстракт травы зверобоя продырявленного (препарат геллариум гиперикум), который практически не имеет противопоказаний и побочных эффектов. [1] При достаточной длительности лечения (2–3 мес) рецидивы возникают не чаще, чем при лечении современными психофармакологическими средствами.
Успешное применение бромокриптина, являющегося синтетическим ингибитором пролактина, может служить подтверждением справедливости предположения об этиологической роли гиперпролактинемии в развитии ПМС [5]. Вместе с тем бромокриптин противопоказан при гипертензии, нарушениях сердечного ритма, заболеваниях желудочно-кишечного тракта. Препарат с осторожностью назначают лицам, работа которых требует повышенного внимания. При его применении могут возникнуть головные боли и другие побочные явления.
Проведенное исследование доказало не только эффективность, но и безопасность препаратов на растительной основе, в частности экстракта Vitex аgnus сastus, при лечении среднетяжелой и тяжелой форм ПМС, что открывает новые возможности в лечении патологического состояния,
этиология и патогенез которого не выяснены.
Таким образом, нет лекарственного средства, которое было бы эффективным в отношении всех симптомов и для всех пациентов. При выборе метода лечения женщин, страдающих ПМС, необходим индивидуальный подход. Пациенткам нужно рекомендовать умеренные физические нагрузки или занятия спортом, рациональное питание, а также индивидуальную медикаментозную терапию в зависимости от преобладания симптоматики ПМС, характерной для каждой пациентки. Оценка здоровья пациентки, правильный подбор терапии способствуют повышению работоспособности и качества жизни женщины, нормализации взаимоотношений в семье и коллективе. Однако, несмотря на существенный прогресс в изучении ПМС, все еще остаются нерешенные проблемы и потребность в улучшении методологии изучения и лечения ПМС.



