Предменструальный синдром (ПМС) – состояние, возникающее в результате комплекса психоэмоциональных, обменно-эндокринных и вегето-сосудистых нарушений, проявляющихся, как
правило, за 2–14 дней до начала менструации [6].
Все больше пациенток с ПМС обращаются за помощью к врачам-специалистам [1–3]. В последние годы значительно возрос интерес к ПМС в связи с полученными новыми данными о возникновении предменструальных нарушений уже в подростковом возрасте с периода менархе [2]. По некоторым данным, до 20% девушек могут испытывать предменструальную симптоматику [9].
Клинические проявления ПМС воспринимаются пациентками как серьезная помеха, снижающая качество жизни, а в ряде случаев, приводящая к временной утрате трудоспособности. Частота ПМС колеблется в широких пределах и составляет от 20 до 95% [2]. Эта вариабельность обусловлена отсутствием единой теории этиопатогенеза [1, 3]. Считают, что решающим в генезе
ПМС является не уровень половых гормонов, который не отличается от такового у здоровых
женщин, а колебания их содержания на фоне овуляторного менструального цикла. Доказано,
что эстрогены и прогестерон оказывают значительное модулирующее воздействие на центральную нервную систему путем взаимодействия с ядерными рецепторами, прямого влияния
на мембрану нейронов и их синаптическую функцию, причем не только в центрах, ответственных за деятельность репродуктивной системы, но и в лимбических отделах мозга, регулирующих эмоции, поведение и сон [10]. Поэтому целесообразным подходом к терапии ПМС является
ингибирование овуляции.
Комбинированные оральные контрацептивы (КОК) представляются перспективным выбором купирования симптоматики ПМС [4, 6]. Однако даже при улучшении самочувствия больных
на фоне применения КОК во время семидневного интервала патологическая симптоматика возобновляется, а на фоне некоторых КОК, содержащих определенные прогестины, наоборот, ухудшается [8]. Поэтому препаратом выбора стал инновационный микродозированный оральный контрацептив Джес (Байер Шеринг Фарма АГ, Германия), содержащий 20 мкг этинилэстрадиола и 3 мг дроспиренона, с пролонгированным режимом приема 24/4. Дроспиренон относится к последнему поколению прогестинов, являясь производным 17-альфапиролактона, и представляет уникальную комбинацию прогестагенного, антиминералокортикоидного, антиандрогенного эффектов [7, 13]. Представляется интересным изучение терапевтической эффективности препарата в отношении ПМС у пациенток, начиная с подросткового возраста. В литературе, включая Кокрановскую базу данных систематических обзоров, мы не встретили длительных исследований по лечению ПМС, включающих подростков [15].
Целью исследования явилась оценка лечебной эффективности комбинированного монофазного
контрацептива, содержащего 20 мкг этинилэстрадиола и 3 мг дроспиренона, у пациенток подросткового и репродуктивного возрастов с ПМС в течение 12 циклов.
Материал и методы исследования
Проведено клиническое нерандомизированное многоцентровое открытое исследование с активным контролем. Были обследованы 129 пациенток от 15 до 45 лет (средний возраст 29,5±6,12 года),
получавших препарат Джес с пролонгированным режимом приема в течение 12 мес с контрацептивной и лечебной целями. В исследование включали пациенток без органической патологии центральной нервной системы и психических заболеваний; не использовавших гормональные контрацептивы в течение как минимум последних 3 мес до исследования; не имевших противопоказаний к применению КОК; не планировавших беременность в период исследования и заинтересованных в надежной контрацепции. Из исследования выбыли 3 пациентки: 2 – по причине изменения репродуктивных планов, 1 – из-за смены места жительства. Таким образом, исследование закончили 126 пациенток.
Для исходной количественной оценки симптомов ПМС использовали календарь предменструального наблюдения за пациентками в течение двух – трех менструальных циклов. Каждый симптом имел оценку от 0 до 3 баллов в зависимости от наличия и степени выраженности. Оценку формы и тяжести ПМС проводили на основе специально разработанной шкалы (модифицированной шкалы Г.П. Королевой) [6]. Форму ПМС определяли по преобладанию симптомов какой-либо группы: а) нейропсихическая; б) вегето-сосудистая; в) обменно-эндокринная; г) трофическая; д) смешанная. Выделяли следующие степени тяжести ПМС: 4–21 балл — легкая степень, 22–51 — средняя, 52 и более — тяжелая. В исследование были включены пациентки с легкой и средней степенями тяжести синдрома. Динамическое наблюдение для оценки лечебной эффективности в отношении проявлений ПМС включало заполнение календаря предменструальных симптомов и шкалы оценки формы и тяжести ПМС через 3, 6, 12 циклов
наблюдения.
Полученные данные были обработаны методами описательной статистики и представлены в виде среднего±стандартного отклонения. Для определения значимости различий сопоставляемых величин использовали t-критерий Стьюдента, точный критерий Фишера и критерий χ2. За уровень статистической достоверности принимали р<0,05.
Результаты исследования и обсуждение
Длительность течения ПМС у пациенток репродуктивного возраста к началу исследования
в среднем составила 8,2±0,9 года, у подростков – 2,3±0,3 года. У 71 (56,35%) пациентки наблюдали легкую степень тяжести течения ПМС, что соответствовало в среднем 18,59±4,21 балла; у 55 (43,65%) обследуемых – среднюю степень тяжести течения ПМС – 41,12±6,7 балла. Следует отметить, что в возрастных группах 15–17 и 25–34 года наиболее часто наблюдалась нейропсихическая форма (42,7 и 31,3% соответственно); 18–24 года – обменно-эндокринная (28,5%); 35–45 лет – вегето-сосудистая форма ПМС (39,6%).
При оценке семейного анамнеза 28,15% пациенток отметили наличие симптомов ПМС
по женской линии. В структуре гинекологических заболеваний, по данным анамнеза, ведущее
место у 46 (36,5%) женщин занимала дисменорея. У остальных пациенток гинекологическая
патология была представлена воспалительными заболеваниями органов малого таза – 32 (25,39)%,
патологией шейки матки в виде хронического цервицита – 27 (21,4%), бесплодием – 26 (20,6%),
эндометриозом – 25 (19,8%), привычным невынашиванием беременности – 18 (14,3%), миомой
матки – 17 (13,5%) пациенток.
Оценка профессионального анамнеза показала, что 84 (66,7%) пациентки являлись работниками
умственного труда, 74 (58,7%) отмечали повышенное эмоциональное напряжение на работе,
у 47 (37,3%) был ненормированный рабочий день, 40 (31,7%) отметили неудовлетворенность своим
профессиональным статусом, 39 (30,9%) учились в высших учебных заведениях, 28 (22,2%) занимали руководящие должности.
Среди исследуемых пациенток с ПМС у 51 (40,5%) наблюдался избыток массы тела (среднее значение индекса массы тела – 28,5±3,5 кг/м²). Среди жалоб наиболее часто встречались: мастодиния и масталгия – у 97 (76,9%) пациенток, вздутие живота – у 83 (65,9%), головные боли – у 58 (46,0%), отеки – у 44 (34,9%), раздражительность – у 94 (74,6%), эмоциональная лабильность – у 88 (69,8%), депрессия – у 74 (58,7%), плаксивость – у 65 (51,6%), чувство тревоги – у 57 (45,2%), утомляемость – у 54 (42,8%) женщин.
У всех пациенток отмечен существенный положительный эффект на фоне лечения. Через 3 мес
приема препарата у 33 (26,2%) пациенток с легкой степенью ПМС симптомы исчезли, у 51 (40,5%)
тяжесть проявления ПМС уменьшилась от средней до легкой, общая оценка выраженности
симптомов составила 12,55±3,64 балла. Через 6 мес результаты изменения тяжести симптоматики ПМС были следующими: полностью исчезли проявления ПМС у 67 (53,2%) пациенток, у 59 (46,8%) выраженность симптомов имела легкую степень и соответствовала 5,9±2,4 балла.
К окончанию терапии полностью исчезли проявления ПМС у 101 (80,2%) пациентки, у 25 (19,8%)
женщин выраженность симптомов имела легкую степень. Число женщин с легкой степенью
тяжести ПМС через 6 и 12 месяцев наблюдения было достоверно меньше исходных показателей
(p<0,05).
Положительный клинический эффект КОК был отмечен в отношении обменно-эндокринных симптомов ПМС (рис. 1) вследствие подавления циклических процессов на фоне контрацептивного влияния КОК. Более выраженная скорость уменьшения частоты обменно-эндокринных симптомов ПМС, по-видимому, связана с минимальной гормональной нагрузкой
(20 мкг этинилэстрадиола) на организм в целом и отсутствием возобновления данной симптоматики в связи с пролонгированным режимом приема данного препарата. Динамика уменьшения частоты обменно-эндокринных симптомов ПМС в целом по сравнению с исходными показателями в группе наблюдения составила через 3 месяца 58,0%, через 6 месяцев – 81,0%, к окончанию лечения – 92,0%, что было достоверно (p<0,05).
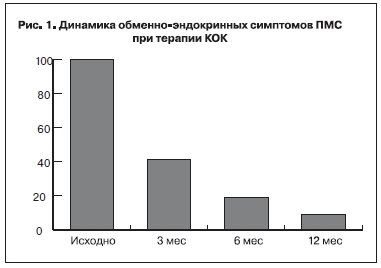
Наибольший клинический эффект был отмечен в отношении следующих симптомов: мастодиния и масталгия наблюдались к концу 3-го и 6-го циклов у 40 (31,7%) и 16 (12,7%) женщин соответственно, к окончанию лечения – у 7 (5,6%) женщин; вздутие живота отмечено
соответственно у 44 (34,9%) и 17 (13,5%), к окончанию терапии – у 8 (6,3%) пациенток; отеки
оставались у 28 (22,2%) и 12 (9,5%) соответственно, через 12 месяцев – у 5 (6,6%) женщин; приливы – у 11 (14%) и 6 (8%) соответственно, к окончанию 12-го цикла – не регистрировались; угревая сыпь – у 23 (18,2%) и 7 (5,6%) соответственно, к концу лечения – отсутствовали.
Отмечалось и достоверное уменьшение частоты вегето-сосудистых симптомов ПМС по сравнению с исходными показателями: через 3 месяца – на 53,4%, через 6 месяцев – на 84,5%, к окончанию терапии – на 92,6% (p<0,05) (рис. 2).
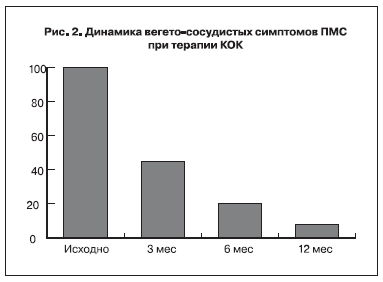
Уменьшение вегето-сосудистых симптомов ПМС происходило, с одной стороны, из-за подавления овуляции КОК, что нивелировало циклические колебания стероидных гормонов, а также за счет входящего в его состав прогестагена дроспиренона, обладающего антиминералокортикоидной активностью, которая в 8 раз выше, чем у спиронолактона (диуретика с антиминералокортикоидной активностью) [15]. С другой стороны, вследствие минимизации гормонального влияния поступающего извне этинилэстрадиола на организм женщины и укороченного безгормонального режима приема препарата [2, 9]. Наибольший терапевтический эффект наблюдался в отношении следующей симптоматики: головные боли отмечались через 3, 6 циклов у 31 (24,6%) и 8 (6,3%) соответственно, к окончанию терапии – у 6 (4,8%) женщин, кардиалгия – у 17 (13,5%) и 8 (6,3%) пациенток соответственно (p<0,05), к окончанию лечения – не наблюдалась ни у одной женщины, тахикардия оставалась у 13 (10,3%) и 6 (4,8%) соответственно, к концу терапии – не регистрировалась, повышение артериального давления – у 11 (8,7%) и 2 (1,6%) соответственно, через 12 циклов – отсутствовало.
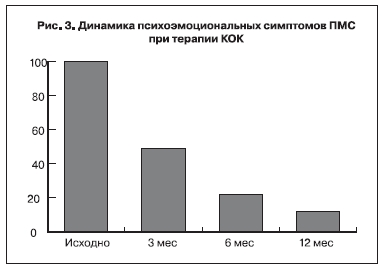
Наиболее трудно поддаются коррекции психоэмоциональные симптомы ПМС, патогенез
которых разнообразен и связан с метаболизмом медиаторов серотонина и дофамина. Ослабление
психоэмоциональных симптомов связано со способностью дроспиренона взаимодействовать с рецепторами метаболитов прогестерона, снижение уровня которых создает в центральной нервной системе характерный «предменструальный срыв» [10, 13]. Уменьшение аффективной симптоматики ПМС, в частности таких симптомов, как агрессивность и раздражительность, связано и с антиандрогенной активностью дроспиренона. При применении КОК с дроспиреноном в некоторых исследованиях выявлено также увеличение концентрации серотонина в крови [6, 12, 13]. Относительное уменьшение нервно-психических симптомов ПМС в целом по сравнению с исходными показателями соответственно составило: через 3 месяца – 52%, через 6 месяцев – 77,5%, к окончанию лечения – 89% и было достоверно (p<0,05) (рис. 3). Поэтому отмечена выраженная тенденция к улучшению аффективного самочувствия у пациенток: через 3, 6 мес лечения эмоциональная лабильность наблюдалась у 49 (38,9%) и 18 (14,3%) соответственно, к окончанию лечения – у 11 (8,7%) пациенток; раздражительность – у 54 (42,9%) и 23 (18,3%), к окончанию терапии – у 12 (9,5%); плаксивость – у 35 (27,8%) и 11 (8,7%), к окончанию курса – у 7 (5,6%); депрессия – у 44 (34,9%) и 21 (16,7%), к концу лечения – у 15 (11,9%) пациенток; чувство тревоги – у 40 (31,8%) и 16 (12,7%) соответственно, к концу 12-го цикла – у 11 (8,8%) женщин.
При сравнении терапевтического эффекта в отношении симптоматики ПМС выявили более быструю динамику уменьшения частоты обменно-эндокринных симптомов ПМС – уже в первые 3 мес лечения. Это связано, по-видимому, с тем, что эти проявления ПМС в бóльшей степени, чем другие зависят от колебаний половых стероидов во время естественного менструального цикла. Поэтому подавление овуляции КОК, резко снижая циклические колебания, приводит к данному результату. Через 6 и 12 мес лечения уменьшение обменно-эндокринных и вегето-сосудистых симптомов были сравнимы: 81,0, 81,4, 92,0 и 92,6% (p>0,05) за счет сходного контрацептивного механизма действия применяемого препарата, минимальной дозы этинилэстрадиола и пролонгированного режима его приема [14].
Помимо симптомов ПМС мы оценивали и другие показатели. При оценке контрацептивной
эффективности не было зафиксировано ни одной беременности.
Антиандрогенная активность дроспиренона позволила достичь значительного лечебного
эффекта в отношении aкне средней и легкой степеней. Тенденция к снижению выраженности акне наблюдалась уже в первые мес приема препарата: через 3 мес данная симптоматика
сохранялась у 21,0% пациенток, а к концу лечения – лишь у 7,9% женщин.
Отслеживая динамику массы тела, мы выявили ее снижение у пациенток на 3,65±0,38 г; 6,1±0,64
и 6,8±0,67 кг после 3; 6 и 12 циклов лечения соответственно, что объясняется антиминерало-
кортикоидной активностью дроспиренона.
Выводы
Продленное действие дроспиренона наглядно доказало уменьшение симптомов, наблюдающихся во время перерывов в приеме стандартных оральных контрацептивов.
Исследуемый комбинированный монофазный контрацептив клинически эффективен при ПМС легкой и средней степеней тяжести, включая дисфорическую симптоматику.
Наибольший терапевтический эффект наблюдается в отношении обменно-эндокринных и вегето-сосудистых проявлений, что соответствует выраженной скорости уменьшения частоты данной симптоматики у пациенток.
Наилучший лечебный результат в снижении предменструальной симптоматики был достигнут
у пациенток подросткового возраста.
Отмечены положительные контрацептивный, косметический эффекты и поддержание стабильной массы тела.
Длительность лечения должна быть не менее 6 мес, в отношении ряда симптомов максимальный эффект наступает через 12 мес терапии.
Проведенное исследование позволило признать лечение ПМС данным препаратом в различных
возрастных группах патогенетически обоснованным и перспективным.



