Сегодня большинство людей могут рассчитывать на то, что доживут до 60 и более лет [1, 2]. Согласно представленному Австралийскому обширному лонгитюдному исследованию, диапазон физического функционирования значительно шире в пожилом возрасте, чем в более молодом. Это означает, что у некоторых 80-летних уровень физических и умственных способностей сопоставим с уровнем функционирования высшей нервной деятельности многих 20-летних [2]. При этом увеличение продолжительности жизни далеко не всегда сопровождается более длительным периодом приемлемого состояния здоровья. Мир меняется, и новым ожиданием человечества является активная старость. С целью поддержания качества жизни женщин очевидной становится необходимость применения менопаузальной гормональной терапии (МГТ). МГТ должна эффективно купировать проявления климактерического синдрома, профилактировать развитие отдаленных последствий дефицита эстрогенов [3]. МГТ сегодня нужно рассматривать именно в контексте концепции ВОЗ, которая так и называется «Активная старость: директивные рамки» [1].
Согласно данным последних статистических отчетов, число женщин в возрасте 45–69 лет на территории Российской Федерации составляет 26,7 млн. Однако удельный вес женщин, принимающих препараты МГТ, крайне мал и составляет всего 1,3% [4]. Приверженность к терапии как важный аспект применения МГТ и индивидуальный подход являются приоритетными направлениями при выборе тактики лечения климактерических расстройств. Учитывая современную стратегию персонализации МГТ, врачу следует соблюдать ряд принципов: оценивать безопасность используемой комбинации препаратов и составляющих ее компонентов, подбирать МГТ с учетом различных факторов риска, таких как сердечно-сосудистые заболевания, рак молочной железы и постменопаузальный остеопороз. Необходимым также является определение наличия коморбидных состояний. Неотъемлемой частью данной концепции являются: определение лекарственной формы препаратов МГТ, подбор минимальной эффективной дозировки, использование режима терапии с учетом возраста, стадии репродуктивного старения (STRAW +10) и потребности пациентки [3].
Одним из вопросов, требующих обсуждения, является тот факт, что на практике врачи и пациентки часто сталкиваются с ситуациями, требующими замены МГТ и других гормональных препаратов. К клиническим причинам замены МГТ относят: непереносимость препарата, развитие нежелательных лекарственных реакций, потребности пациентки, наличие сопутствующих заболеваний и другое. Все вышеперечисленное диктует необходимость замены составляющих препарата, то есть смены МГТ. Складывающаяся на сегодняшний день ситуация, касающаяся дефицита ряда импортных препаратов, а именно санкционная политика, ограничение ввоза сырья для производства препаратов и невозможность компаний удовлетворить спрос, также влияют на выбор в назначении того или иного лекарственного средства.
Описанные в статье наблюдения реальной клинической практики, в которых возникла необходимость смены одного препарата на другой, демонстрируют эффективное практическое решение для врачей, которые могут столкнуться с аналогичными проблемами.
Клиническое наблюдение № 1
Июль, 2021. На приеме: пациентка К., возраст – 50 лет, образование – высшее, профессия – учитель, замужем. Возраст мужа – 54 года.
Жалобы на нарушения сна. В течение последних 6 месяцев просыпается в 4.30 утра, час проводит без сна, затем засыпает, но в 7 утра необходимо просыпаться и приступать к повседневным обязанностям. Весь день чувствует себя разбитой. Чувство жара (приливы) до 6–8 в сутки.
Акушерско-гинекологический анамнез. Менструации с 13 лет, по 4–5 дней, продолжительность цикла 28 дней. В анамнезе 3 беременности, из них 2 закончились родами и 1 – медикаментозным абортом. Гормональные контрацептивы с целью защиты от незапланированной беременности никогда не принимала. В возрасте 38 лет по поводу эндометриомы правого яичника произведена цистэктомия лапароскопическим доступом. С целью лечения климактерического синдрома по назначению врача принимала препарат МГТ, содержащий 1 мг эстрадиола и 2 мг дроспиренона. Через 3 месяца после начала приема терапии появились мажущие кровянистые выделения, которые продолжались в течение 20 дней и усилились на 21-й день, появились сгустки. Пациентка отменила препарат самостоятельно. На момент обращения к врачу пациентка находилась без МГТ уже около 1 месяца.
Соматический анамнез. С 45 лет – гипертоническая болезнь (ГБ), 2-я степень, II стадия. Принимает антигипертензивные препараты. Варикозная болезнь вен нижних конечностей II стадии.
Обследована: выполнена гистероскопия с последующей биопсией эндометрия. По данным гистероскопии определяется увеличение объема полости матки за счет локального выпячивания в просвет полости образования бледно-желтого оттенка, неправильной формы, без четких границ с деформацией одной из стенок матки. Подобная эндоскопическая картина интерпретирована как узловая форма аденомиоза.
Результаты гистологического исследования биоптата эндометрия: атрофические изменения в эпителии желез и строме.
Семейный анамнез. Возраст матери – 85 лет. В анамнезе у матери – ГБ, сахарный диабет 2 типа, постменопаузальный остеопороз. Возраст сестры – 56 лет. В анамнезе у родной сестры – рак молочной железы (состояние после комплексного лечения). Отец умер в возрасте 84 лет, в анамнезе у отца – хроническая сердечная недостаточность, острая массивная тромбоэмболия легочной артерии.
Образ жизни и привычки. Диету не соблюдает. Индекс массы тела 27,1 кг/м2. Ведет малоподвижный образ жизни. Вредных привычек не имеет.
Основной диагноз: N95.1 Менопауза и климактерическое состояние. Средняя степень тяжести климактерического синдрома по шкале Грина. N80.0 Аденомиоз.
Сопутствующий диагноз: ГБ II степени; контролируемая артериальная гипертензия; варикозная болезнь вен нижних конечностей II стадии.
С целью эффективного лечения климактерического синдрома пациентке рекомендована смена МГТ. С учетом анамнеза и результатов обследования рекомендован прием препарата, содержащего 1 мг эстрадиола/5 мг дидрогестерона. Целесообразность данного режима подробно рассмотрена в Алгоритмах применения МГТ у женщин в период пери- и постменопаузы [5]. Ниже представлено обоснование перевода с одного препарата МГТ на другой, согласно рациональному ведению пациенток в период менопаузы.
Обоснование смены МГТ.
Гестагены рекомендованы Российским обществом акушеров-гинекологов в качестве первой линии терапии при эндометриозе, а также рекомендациями ESHRE-2022 [6, 7]. Дидрогестерон продемонстрировал высокую эффективность и безопасность при лечении эндометриоза и для профилактики его рецидивов, а также предоставляет уникальную возможность персонализации терапии [8, 9]. Учитывая наличие аденомиоза у данной пациентки, гестагеном выбора является дидрогестерон.
Имеются данные о преимуществах назначения комбинированной МГТ, содержащей 1 мг эстрадиола/5 мг дидрогестерона, у пациенток в постменопаузе при сопутствующей миоме матки и эндометриозе [10].
Рекомендуется при назначении препаратов учитывать различные профили безопасности гестагенов, входящих в их состав. Дидрогестерон в силу высокой селективности к прогестероновым рецепторам снижает вероятность побочных эффектов, связанных с другими рецепторами [11, 12]. (Пациентка имеет сердечно-сосудистые заболевания, а также избыточную массу тела).
Ввиду развития нежелательных лекарственных реакций при применении дроспиренонсодержащей МГТ целесообразна замена на другую комбинацию (мажущие кровянистые выделения через 3 месяца после начала приема МГТ с дроспиреноном).
Из доступных и исследованных гестагенов в составе пероральной МГТ предпочтительны прогестерон и дидрогестерон. Эффективность и безопасность схемы эстрадиол/дидрогестерон подтверждена российскими (РОАГ) и мировыми (EMAS, IMS) клиническими рекомендациями [3, 13, 14].
Для купирования нейровегетативных симптомов климактерического синдрома, профилактики отдаленных последствий менопаузы, с целью профилактики рецидива эндометриоза, а также ввиду развития нежелательных лекарственных реакций при применении дроспиренонсодержащей МГТ с информированного согласия пациентки рекомендован перевод на комбинированную МГТ, содержащую эстрадиол/дидрогестерон.
Пациентка осмотрена после 3 месяцев приема терапии эстрадиолом/дидрогестероном. Отмечена удовлетворенность терапией, климактерические симптомы купированы, жалоб на момент осмотра не предъявляет, коррекция терапии не требуется. Пациентке рекомендованы продолжение терапии, плановая явка на осмотр через 6 месяцев.
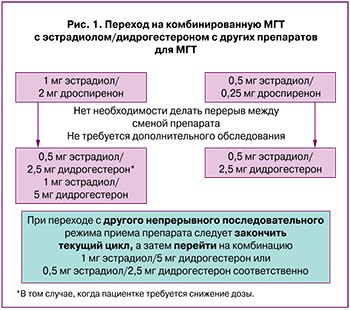
Согласно Алгоритмам применения МГТ у женщин в период пери- и постменопаузы под ред. В.Н. Серова, С.В. Юреневой [5], нет необходимости делать перерыв при смене препарата, оценив преимущества назначения препарата с другой дозировкой эстрадиола и/или иным гестагенным компонентом для данной конкретной пациентки. Дополнительное обследование при этом не требуется. При переходе с другого непрерывного последовательного режима приема препарата следует закончить текущий цикл, а затем перейти на комбинацию 1 мг эстрадиола/5 мг дидрогестерона или 0,5 мг эстрадиола/2,5 мг дидрогестерона (рис. 1).
Клиническое наблюдение № 2
Апрель, 2021. На приеме: пациентка Н., возраст – 47 лет, образование – высшее, профессия – инженер, замужем. Возраст мужа – 58 лет.
Обратилась с жалобами: на умеренную общую слабость, быструю утомляемость, чувство разбитости в конце рабочего дня. Резкие перепады настроения (в том числе чрезмерный гнев). Увеличение веса на 4 кг с января 2021 г. на фоне приема комбинированных оральных контрацептивов (КОК).
Пациентка информирована, что существуют препараты МГТ. Со слов пациентки: «Могут помочь при климаксе, но боюсь рака молочной железы».
Акушерско-гинекологический анамнез. Менструации регулярные, с 13 лет по 6–7 дней, всегда обильные, длительность цикла – 28 дней. После отмены КОК (этинилэстрадиол/дроспиренон) в течение последних 6 месяцев цикл нерегулярный от 21 дня с задержками до 42 дней. Известно, что пациентка прекратила прием КОК в связи с набором веса. В анамнезе 2 беременности, 2 естественных родов.
Соматический анамнез. С 46 лет – ГБ 2 степень, II стадия. Наблюдается у терапевта, получает антигипертензивную терапию.
Семейный анамнез. Возраст матери – 78 лет. В анамнезе у матери – ГБ, сахарный диабет 2 типа, варикозная болезнь вен нижних конечностей, постменопаузальный остеопороз. Возраст отца – 84 года, в анамнезе – хроническая сердечная недостаточность, эмфизема легких.
Образ жизни и привычки. Диету не соблюдает. Индекс массы тела 29,3 кг/м2. Ведет малоподвижный образ жизни. Вредных привычек не имеет.
Диагноз. Основной: N95.1 Менопауза и климактерическое состояние. Средняя степень тяжести климактерического синдрома по шкале Грина. Состояние на фоне приема КОК (этинилэстрадиол/дроспиренон).
Сопутствующий: ГБ II степени.
Пациентка обследована в рамках рутинного скрининга, рекомендованного перед назначением МГТ.
Ниже представлено обоснование перехода с КОК на МГТ в рамках рационального научно обоснованного ведения пациентки.
Жалобы на набор веса (пациентка набрала 4 кг с января 2021 г. на фоне приема КОК).
Отсутствие показаний к применению КОК. Пациентка в контрацепции не нуждается.
Нежелание пациентки принимать КОК, учитывая нежелательные лекарственные реакции.
Наличие менопаузальных симптомов на фоне приема КОК. У пациентки сохраняются менопаузальные симптомы: слабость, чувство разбитости, резкие перепады настроения.
С пациенткой проведена беседа об эффективности и безопасности назначаемой ей МГТ с учетом опасений женщины в отношении рака молочной железы. Рекомендовано: отменить прием КОК, далее с целью лечения климактерического синдрома назначен прием МГТ, содержащей 1 мг эстрадиола/10 мг дидрогестерона.
Показания к переводу с КОК на МГТ также рассмотрены в Алгоритмах применения МГТ у женщин в период пери- и постменопаузы [5] (рис. 2).
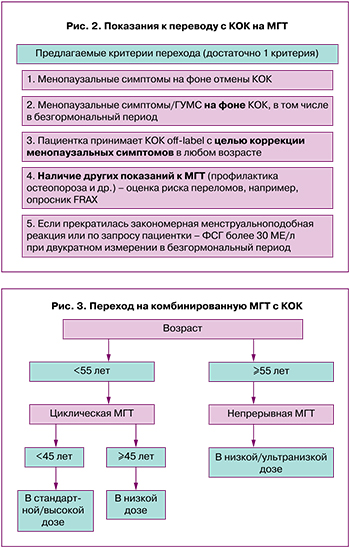
При переходе с другого циклического режима приема препарата (КОК) следует закончить текущий цикл, а затем перейти на комбинацию 1 мг эстрадиола/10 мг дидрогестерона или 2 мг эстрадиола/10 мг дидрогестерона (рис. 3).
Пациентка осмотрена после 3 месяцев приема терапии эстрадиолом/дидрогестероном. Отмечается удовлетворенность терапией, климактерические симптомы купированы, жалоб на момент осмотра не предъявляет, коррекция терапии не требуется.
Обсуждение
Среди врачей разных специальностей есть мифы о повышении риска возникновения злокачественных новообразований у пациенток вследствие приема МГТ. Эта причина занимает первое место среди причин отмены или запрета МГТ, с которым сталкиваются 75% врачей-гинекологов. По данным опроса O+K Research, в клинической практике у каждого врача-гинеколога наблюдается от 3 до 8 случаев отмены/запрета МГТ врачами других специальностей [15].
Необходимо подчеркнуть, что на сегодняшний день накоплено достаточно научных данных о безопасности использования комбинации эстрадиол/дидрогестерон в контексте снижения возникновения рака молочной железы [13, 16–18], рака эндометрия [19–21], снижения вероятности венозной тромбоэмболии [22, 23] и позитивного влияния на основные показатели углеводного и липидного обмена.
Следует признать, что рак молочной железы занимает первое место в мире среди злокачественных новообразований у женщин. Однако существует достаточно доказательств того, что фактический риск рака молочной железы на фоне МГТ низок и оценивается как менее чем 0,1% в год, или <1 случая на 1000 женщино-лет среди пациенток, получающих МГТ [17, 24, 25]. Эти данные ниже рисков, связанных с такими эндогенными факторами, как повышенная плотность молочных желез, или таких факторов, как гиподинамия, ожирение и употребление алкоголя. Из всех гестагенов дидрогестерон продемонстрировал самый благоприятный профиль безопасности в отношении риска рака молочной железы [13, 16–18].
Антипролиферативные эффекты дидрогестерона на ткани эндометрия изучены давно и имеют достаточную доказательную базу [19–21, 26]. При применении комбинации 1 мг эстрадиола/10 мг дидрогестерона и 2 мг эстрадиола/10 мг дидрогестерона не было зарегистрировано ни одного случая гиперплазии или гормонозависимого рака эндометрия [21, 27]. Изменение режима МГТ, индекса массы тела и возраста пациенток не влияло на риски тромбоэмболических исходов или осложнений при применении комбинации эстрадиола/дидрогестерона [17].
Эффективность МГТ зависит от ряда факторов, в том числе от приверженности пациентки к терапии и, соответственно, продолжительности применения. Врачу следует обсудить в диалоге с пациенткой все преимущества МГТ и разобрать все барьеры, так как в последующем именно они могут стать причинами нарушения приверженности к терапии и, как следствие, неэффективности назначенного лечения. В результате женщина должна понимать важность назначаемого лечения и необходимость контрольных осмотров.
В рекомендациях EMAS 2018 г. по менопаузе и сахарному диабету [14] отмечается, что:
- предпочтительна пероральная МГТ при отсутствии абсолютных противопоказаний;
- из доступных и исследованных гестагенов в составе пероральной МГТ предпочтительны дидрогестерон и прогестерон;
- МГТ положительно влияет на гликемический профиль как у женщин без сахарного диабета, так и у женщин с сахарным диабетом 2 типа;
- своевременно начатая МГТ позволяет отложить развитие сахарного диабета.
Своевременно назначенная МГТ осуществляет протективное влияние в отношении метаболических нарушений – профилактики абдоминального типа ожирения у женщин в постменопаузе [28, 29].
Влияние МГТ на липидный спектр крови зависит от типа гормонов (эстрогена и гестагена), дозы и пути введения препаратов [30]. Согласно клиническим рекомендациям EMAS 2020 г. по ведению женщин c дислипидемией в менопаузе [31], пероральные эстрогены индуцируют значительное дозозависимое снижение общего холестерина, липопротеинов низкой плотности и липопротеина А, увеличение концентрации липопротеинов высокой плотности.
Дидрогестерон является метаболически нейтральным гестагеном [11, 12, 31]. Различные режимы МГТ с дидрогестероном способствуют достижению индивидуальных целевых показателей гликемии у коморбидных пациенток [32].
Неизбежны предстоящие демографические изменения в сторону увеличения численности населения пожилого возраста. Гинеколог в своей ежедневной практике может внести существенный вклад в сохранение и повышение качества жизни женщин данной возрастной категории. Своевременный выбор по показаниям в пользу эффективных, безопасных препаратов МГТ с учетом персонализации для лечения климактерического синдрома, а также замена одного препарата на другой при необходимости помогут сохранить здоровье пациенток на протяжении многих лет.
Например, своевременное начало МГТ, а именно первые 10 лет, снижает риск смертности от всех причин на 30%, ишемической болезни сердца – на 32% по сравнению плацебо и отсутствием лечения [13, 23].
Среди препаратов, предназначенных для коррекции менопаузальных симптомов, комбинация эстрадиола/дидрогестерона соответствует всем критериям МГТ, согласно данным международных обществ по менопаузе (IMS, EMAS, NICE) [13, 14, 33]. Профиль безопасности комбинации эстрадиола/дидрогестерона хорошо изучен и является благоприятным [13, 16–23, 34, 35].
Комбинация эстрадиола/дидрогестерона имеет линейку различных дозировок и режимов, что позволяет максимально персонализировать терапию климактерических расстройств и обеспечивает возможность ведения пациентки на протяжении всего периода от пери- до постменопаузы, не меняя гестаген.
Заключение
Современная тактика ведения пациенток с менопаузальными симптомами, алгоритм замены гормональных препаратов предоставляют врачу и пациентке возможность получить максимальную эффективность и безопасность терапии, высокую приверженность к лечению, профилактировать отдаленные осложнения.



