Известно, что гистосовместимость родителей может служить неблагоприятным фактором, препятствующим распознаванию эмбриональных антигенов отцовского происхождения с ранних сроков беременности, что способствует реализации акушерских осложнений [1].
В исследованиях зарубежных авторов проводился анализ роли HLA II класса в патогенезе идиопатического привычного выкидыша. По данным исследователей из Германии, Японии, США, Китая HLA-совместимость супругов может являться одной из причин привычного выкидыша [2–5].
Актуальность
В настоящее время получены данные о роли HLA-совместимости в системе мать-плод в патогенезе не только ранних потерь беременности, но и самопроизвольных ее прерываний на поздних сроках, реализации плацентарной недостаточности, задержки роста плода, преэклампсии, преждевременных родов [6–8].
Интерес представляют данные американских авторов, касающиеся не только изучения гистосовместимости родителей, но и механизмов наследования HLA-фенотипа, в частности HLA-типирования матери и плода. Была изучена роль HLA-совместимости как у детей, рожденных в результате неосложненной беременности, так и глубоко недоношенных детей при преждевременных родах. Было установлено, что при наличии общих аллелей по локусу DRB1 у матери и плода риск очень ранних преждевременных родов в 5 раз выше, чем у пар мать-ребенок, где HLA совместимость отсутствует [6].
Данное клиническое наблюдение посвящено изучению особенностей течения и исходов 5 беременностей у супругов с различной степенью гистосовместимости с детьми. Проведено HLA-типирование родителей и детей, выявлен неблагоприятный исход при полной гистосовместимости матери и плода.
Клиническое наблюдение
Пациентка В., 35 лет, русская, впервые обратилась в ФГБУ НЦАГиП в 2008 году для обследования, подготовки и последующего ведения беременности в связи с отягощенным акушерским анамнезом.
Из анамнеза известно: наследственность и аллергоанамнез не отягощены. Из перенесенных заболеваний отмечены детские инфекции, редкие ОРВИ, хронический пиелонефрит, хронический эндометрит. Брак первый, мужу 35 лет.
 Первая беременность в 2000 году закончилась родоразрешением путем операции кесарева сечения в связи с преэклампсией. Наблюдение в течение беременности и родоразрешение проводилось по месту жительства женщины в г. Мурманске. Отмечалось повышение АД до 150 и 100 мм рт. ст., протеинурия до 1,0 г/л, отеки нижних конечностей. Срок беременности на момент родоразрешения составлял 37 недель. Родился живой доношенный мальчик массой 2740 г, длиной 49 см. Родильница с ребенком на 7-е сутки выписаны домой.
Первая беременность в 2000 году закончилась родоразрешением путем операции кесарева сечения в связи с преэклампсией. Наблюдение в течение беременности и родоразрешение проводилось по месту жительства женщины в г. Мурманске. Отмечалось повышение АД до 150 и 100 мм рт. ст., протеинурия до 1,0 г/л, отеки нижних конечностей. Срок беременности на момент родоразрешения составлял 37 недель. Родился живой доношенный мальчик массой 2740 г, длиной 49 см. Родильница с ребенком на 7-е сутки выписаны домой.
Вторая беременность в 2006 году закончилась антенатальной гибелью плода в сроке 26–27 недель, индуцированы преждевременные роды, родилась мертвая девочка массой 900 г, длиной 33 см. По данным гистологического заключения последа имелась декомпенсированная плацентарная недостаточность. Наблюдение за беременностью и родоразрешение также проводилось по месту жительства больной в г. Мурманске.
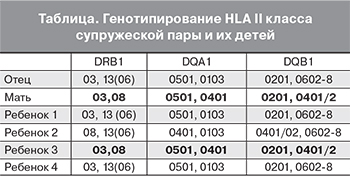
При обращении в научно-поликлиническое отделение ФГБУ НЦАГиП больной проведено полное клинико-лабораторное обследование по программе, принятой в отделении профилактики и лечения невынашивания беременности. Кариотип супругов был нормальным – 46, XX, 46, XY. По результатам диагностики антител к фосфолипидам выявлен повышенный уровень антител IgG к кардиолипину (16,5) и IgG к аннексину (7,3), остальные данные соответствовали нормативным показателям. При повторном анализе на антитела к кардиолипину и аннексину через 6 недель, уровени IgG оставались повышенными и составляли 13,8 и 7,0 соответственно. Диагностированы множественные аллельные полиморфизмы генов гемостаза (гомозиготные мутации в генах PAI-1 и MTHFR, гетерозиготные – MTRR и MTR). При обследовании гемостаза во вторую фазу менструального цикла выявлены явления умеренной гиперкоагуляции (фибриноген 5,9 г/л; индекс тромбодинамического потенциала 13,0 у.е; растворимые комплексы мономеров фибрина – слабо положительные; Д-димер 600 мкг/л). При HLA-типировании 2-го класса супругов были выявлены следующие общие аллели в локусах: DRB1 – 03; DQA1 – 0501; DQB1 – 0201 (таблица). При исследовании уровней гормонов в I фазу менструального цикла, ультразвукового скрининга на наличие анатомических факторов невынашивания беременности, а также инфекционного скрининга (включающего в себя бактериологическое исследование отделяемого из цервикального канала, расширенное исследование микрофлоры урогенитального тракта методом полимеразной цепной реакции (фемофлор-16) из заднего свода влагалища, мазок на флору из влагалища) патология не выявлена.
Пациентка также консультирована специалистами терапевтической группы (терапевт, нефролог, кардиолог) – патологии со стороны сердца и почек по данным тестов функциональной диагностики и лабораторных показателей не выявлено.
После проведения обследования был выставлен диагноз: Антифосфолипидный синдром (АФС). Мультигенная тромбофилия (PAI-1 +/+; MTHFR +/-; MTRR +/+; MTR +/-). Совместимость супругов по системе HLA II класса. Рубец на матке после кесарева сечения в 2000 году.
В течение третьей беременности в 2008 году с учетом выявленных изменений в системе гемостаза, а также установленного диагноза АФС с ранних сроков пациентка получала антикоагулянтную терапию эноксапарином в терапевтических дозах. Однако в сроке 30 недель в связи с развившейся тяжелой плацентарной недостаточностью, выраженным маловодием, преэклампсией, несмотря на проводившуюся комплексную терапию, пациентка была родоразрешена путем операции кесарева сечения. Родился живой недоношенный гипотрофичный мальчик массой 1638 г, длиной 41 см. Ребенок проходил лечение и реабилитацию в неонатальных отделениях НЦАГиП и был выписан домой. В настоящее время ребенку 7 лет, растет и развивается соответственно возрасту.
Четвертая беременность в 2011 г. протекала с явлениями угрожающего раннего выкидыша, пациентка неоднократно находилась на стационарном лечении по месту жительства. Получала гормональную, гемостатическую, спазмолитическую и антикоагулянтную терапию. В сроке 22 недели впервые по месту жительства были выявлены признаки плацентарной недостаточности по данным ультразвукового исследования и допплерометрии – маловодие, нарушение кровотока в системе «мать-плацента-плод». При обращении в НЦАГиП в сроке 23–24 недели беременности по данным тестов функциональной диагностики размеры плода соответствовали гестационному сроку, имелось маловодие; отмечалось усиление фето-плацентарного кровотока (ФПК), выраженное снижение маточно-плацентарного кровотока (МПК) с ранней дикротической выемкой. Беременной в условиях стационара была проведена профилактика респираторного дистресс-синдрома плода дексаметазоном суммарно 24 мг в/м, проводилась антикоагулянтная терапия в терапевтических дозах. При ультразвуковом исследовании и допплерометрии в динамике было отмечено прогрессирование маловодия – практически полное отсутствие околоплодных вод, отсутствие динамики роста плода, а также отмечалось выраженное снижение кровотока («0» кровоток) в артерии пуповины с признаками централизации кровотока, кровоток в ductus venosus оставался в норме. Принимая во внимание прогрессирование плацентарной недостаточности, отсутствие эффекта от проводимой комплексной терапии у пациентки с тяжелым течением АФС, проведено родоразрешение в сроке 26 недель путем операции кесарева сечения в условиях реинфузии аутоэритроцитов. Родился живой глубоко недоношенный гипотрофичный мальчик массой 680 грамм, длиной 35 см, оценка состояния по шкале Апгар 2–6 баллов. Отмечалась выраженная гипоплазия плаценты (размеры 10–12 см, масса 210 грамм). Ребенок прошел лечение и реабилитацию в неонатальных отделения Центра и выписан домой на 86-е сутки с массой 2445 г, длиной 50 см. Умер в возрасте 4,5 месяца в связи с осложнениями тяжелой вирусной инфекции.
В 2013 году у пациентки наступила пятая беременность. Протекала с явлениями угрожающего выкидыша в I и II триместрах и неоднократным стационарным лечением в отделениях Центра. В сроках 6, 9 недель проведена лимфоцитоиммунотерапия (ЛИТ) клетками мужа. В сроке 23–24 недели по данным допплерометрии выявлено нарушение МПК, доза эноксапарина увеличена до 100 мг в сутки. С 30 недель больная отмечала подъемы АД до 140/90 мм рт. ст., суточная протеинурия составила 0,03 грамма; по данным суточного мониторирования АД выявлена артериальная гипертония. К терапии добавлены гипотензивные препараты: допегит 500 мг/сутки, кордафлекс 40 мг/сутки. В сроке 33 недели по данным тестов функциональной диагностики выявлены признаки плацентарной недостаточности – маловодие, задержка роста плода, снижение ФПК, снижение МПК с дикротической выемкой. Консультативно принято решение о досрочном родоразрешении, учитывая крайне отягощенный акушерский анамнез беременной, после проведения повторного курса профилактики респираторного дистресс синдрома плода. В сроке беременности 34 недели выполнена операция кесарева сечения. Родился живой недоношенный гипотрофичный мальчик массой 1591 грамм, длиной 41 см. Оценка состояния по шкале Апгар 6–8 баллов. После лечения в неонатальных отделениях НЦАГиП выписан домой. В настоящее время растет и развивается соответственно возрасту.
Проведено HLA-типирование всех родившихся детей. Заслуживают внимания данные по HLA-типированию первых двух и 4-го ребенка. Полной гистосовместимости с матерью в данных наблюдениях не выявлено (таблица). Напротив, у 3-го глубоко недоношенного ребенка имелась полная HLA-совместимость с матерью, что помимо имеющегося у пациентки АФС, являлось дополнительным критическим фактором, приведшим к раннему развитию тяжелой плацентарной недостаточности.
Полученные данные позволяют предположить, что гистосовместимость матери и плода является неблагоприятным фактором в реализации не только ранних и поздних прерываний беременности, как полагали ранее, но и тяжелой плацентарной недостаточности.
Как известно, гистосовместимость родителей препятствует распознаванию эмбриональных антигенов отцовского происхождения с ранних сроков беременности, что способствует реализации различных акушерских осложнений. Нарушение процессов инвазии трофобласта в первом триместре беременности ведет к реализации поздних гестационных осложнений: задержки роста плода, преэклампсии, преждевременных родов, антенатальной гибели плода.
На примере данной пациентки мы видим, что полная гистосовместимость матери с плодом привела к развитию ранней тяжелой плацентраной недостаточности, а совместимость супругов по системе HLA II класса была предрасполагающим фактором. Помимо HLA-совместимости также был диагностирован акушерский АФС, без тромбозов периферических сосудов, который мог спровоцировать данные осложнения беременности и привести к задержке роста плода [9].
Безусловно, АФС являлся одним из ведущих причинных факторов, в связи с чем в течение трех последних беременностей проводилась коррекция гемостазиологических нарушений с ранних сроков беременности терапевтическими дозами низкомолекулярных гепаринов, однако не удалось предотвратить развитие тяжелой плацентарной недостаточности, дебютировавшей в сроке 23 недели и потребовавшей элективного досрочного родоразрешения в сроке 26 недель при полной HLA совместимости матери и плода.
Заключение
Необходимо подчеркнуть важность проведения ЛИТ у гистосовместимых супругов (пар). В последнем случае в первом триместре беременности были проведены два курса ЛИТ клетками мужа, что позволило смоделировать иммунный ответ материнского организма на аллогенные антигены плода, полученные от отца что, как результат, способствовало лучшей инвазии трофобласта. В данном клиническом наблюдении при проведении комплексной терапии, включая активную иммунизацию (ЛИТ), беременность удалось пролонгировать до рождения жизнеспособного ребенка в сроке 34 недели.
На данном примере можно проиллюстрировать, что совместимость матери и плода является дополнительным негативным фактором, способствующим формированию плацентарной недостаточности, препятствующей нормальному вынашиванию беременности.
Необходимо продолжить исследования в данной области для определения оптимальной тактики подготовки и ведения беременности у пациенток с мультифакториальными причинами репродуктивных неудач.



