Невынашивание беременности является одной из самых актуальных, до сих пор не решенных проблем современного акушерства и гинекологии. Согласно статистике, частота самопроизвольных выкидышей колеблется в диапазоне 15–20% клинически подтвержденных беременностей [1]. По разным данным около 50% репродуктивных потерь приходится на I триместр беременности; затем с ростом срока гестации частота самопроизвольных выкидышей снижается до 20%. Примерно 70–80% всех случаев самопроизвольного выкидыша приходится на первую половину гестации. Основными причинами потери беременности являются инфекционные, гормональные, иммунные, анатомические факторы [2–4]. Несмотря на многочисленные всесторонние исследования, направленные на установление причин невынашивания, до сих пор как минимум в 30% случаев идентифицировать причину не удается.
Помимо известных факторов, провоцирующих репродуктивные потери, в последнее время пристальное внимание уделяется изучению комплексных генетически обусловленных нарушений гомеостаза организма, оказывающих опосредованное влияние на течение беременности [1, 5]. В условиях современного мегаполиса организм женщины постоянно подвергается множеству негативных воздействий, как со стороны загрязненной окружающей среды, так и влиянию полиэтиологических стрессоров. Давно известно, что в организме существует целый ряд процессов и систем, обеспечивающих внутриклеточные взаимодействия. Одной из таких систем является каскад метаболизма катехоламинов. При стрессе возникает гиперпродукция катехоламинов, которые в норме инактивируются при участии фермента катехол-о-метилтрансферазы, вырабатываемого в результате экспрессии гена COMT [6, 7]. Однако в условиях недостаточности фермента происходит чрезмерное накопление катехоламинов, воздействующих через связывание со специфическими рецепторами на органы мишени, в том числе и на матку, вызывая изменение ее тонуса и ухудшение маточно-плацентарного кровотока. Также катехол-о-метилтрансфераза участвует в метаболизме эстрогенов и при снижении активности фермента происходит накопление катехолэстрагенов, которые в процессе связывания с гуанином формируют 4-гидроксиэстрогены, участвующие в генотоксическом типе гормонального канцерогенеза, вызывая прямые повреждения молекулы ДНК [7] .

Все повреждения ДНК находятся под контролем системы репарации, одним из основных механизмов которой является система эксцизионной репарации, выполняющая свою функцию посредствам «вырезания» дефектных участков из структуры ДНК [8]. Одним из наиболее важных ферментов эксцизионной репарации ДНК является фермент 8-оксогуанин-ДНК-гликозилаза, кодируемый геном OGG1. Снижение эффективности процессов репарации, обусловленное недостаточной активностью фермента 8-оксогуанин-ДНК-гликозилаза приводит к усилению мутагенной активности повреждающих агентов, что может крайне неблагоприятно сказываться на начальных этапах развития эмбриона [8]. Давно известно, что полиморфизм генов, кодирующих выработку ферментов может сопровождаться значительным изменением их активности, что, в свою очередь, отражается на их функциональной состоятельности [9].
В представленной работе впервые изучено влияние носительства полиморфизма G1947А (rs4680) гена COMT и полиморфизма С977G (rs1052133) гена OGG1 на течение первой половины беременности.
 Материал и методы исследования
Материал и методы исследования
Объектом проведенного исследования стали 274 женщины; 151 находились на стационарном лечении в гинекологическом отделении в связи с самопроизвольным прерыванием беременности на сроке 7–20 недель гестации. Нами были отобраны пациентки с несколькими эпизодами репродуктивных потерь в анамнезе, исключая анэмбрионии и случаи невынашивания беременности, наступившей в результате ЭКО. В качестве группы сравнения были выбраны 123 женщины с реализованной репродуктивной функцией, 2 и более нормальными беременностями в анамнезе, протекавшими без угрозы прерывания и закончившимися самопроизвольными родами. Также условием включения пациенток в контрольную группу было отсутствие эпизодов невынашивания беременности в анамнезе. Все пациентки являлись представительницами славянской национальности, имели идентичные территориальные и климатические условия проживания (Москва и Московская область).
В рамках общего обследования всем пациенткам был проведен сбор анамнеза, общий осмотр, полное клинико-лабораторное обследование, включая оценку гормонального профиля и диагностику заболеваний передающихся половым путем методом полимеразной цепной реакции (ПЦР); с целью установления срока и характера течения беременности выполнялось ультразвуковое исследование органов малого таза. Пациенткам основной группы с самопроизвольным выкидышем производилось выскабливание слизистой матки. С целью исключения тяжелой хромосомной патологии эмбриона, как причины потери беременности всем пациенткам основной группы было выполнено кариотипирование абортусов, случаи хромосомных аберраций были исключены из исследования.
Для проведения молекулярно-генетического исследования нами был осуществлен забор 5 мл периферической венозной крови в пробирку, содержащую консервант – раствор К3EDTA, в соотношении 1:10. Хранение образцов осуществляли при температуре -20˚–-80˚C вплоть до постановки реакции. Выделение ДНК производили с использованием наборов реактивов Diatom DNA Prep 200 (Isogene Lab.Ltd, страна производитель Россия) согласно протоколу, заявленному производителем.
Генотипирование выполнялось методом аллель-специфической тетрапраймерной ПЦР [10]. Последовательности праймеров и условия реакции приведены в таблице. Метод отличается от известных аналогов аллель-специфической реакции тем, что позволяет в одной пробирке амплифицировать фрагменты ДНК различной длины, соответствующие альтернативным аллелям. Для постановки ПЦР использовали готовые лиофилизированные наборовы Master Mix (фирма Изоген) и праймеры (Евроген или Синтол). В дальнейшем выполняли электрофорез амплифицированных фрагментов ДНК в 2% агарозном геле с интеркалирующим красителем бромистым этидием.
 В ходе генотипирования выявляли полиморфные варианты G1947А (rs4680) гена COMT и С977G (rs1052133) гена OGG1 и в последующем проводили оценку частот распределения генотипов в группах обследуемых пациенток.
В ходе генотипирования выявляли полиморфные варианты G1947А (rs4680) гена COMT и С977G (rs1052133) гена OGG1 и в последующем проводили оценку частот распределения генотипов в группах обследуемых пациенток.
Для статистической обработки полученных результатов применяли методы χ2. Вклады различных генотипов в заболеваемость определяли с помощью традиционного для таких исследований показателя «odds ratio». В некоторых случаях, с целью оценки достоверности различий частот бинарных показателей, использовали также трендовый тест Армитажа.
Результаты исследования
Изучению полиморфизма генов, как предикторов развития различных заболеваний в современной науке уделяется большое внимание. Однонуклеотидный полиморфизм G1947А (rs4680) гена COMT характеризуется заменой гуанина на аденин в первичной структуре нуклеотида, что сопровождается заменой валина на метионин в аминокислотной последовательности белка. Такое изменение в структуре белка сопровождается выработкой фермента катехол-О-метилтансферазы со сниженной активностью. При этом, доказано, что у носителей генотипа G/G наблюдается экспрессия полноценного фермента, гетерозиготы G/A отличает некоторое снижение активности СОМТ, у гомозигот по мутантному аллелю А (генотип A/A) наблюдается 3–4-кратное снижение активности фермента, по сравнению генотипом дикого типа [11].
По данным разных авторов носители генотипа А/А значительно чаше страдают психическими заболеваниями, такими как шизофрения, биполярное и панические расстройства, болезнь Альцгеймера [12–14]. Ранее установлена корреляция повышенного риска развития миомы матки и некоторых онкологических заболеваний с носительствам аллеля А [5].
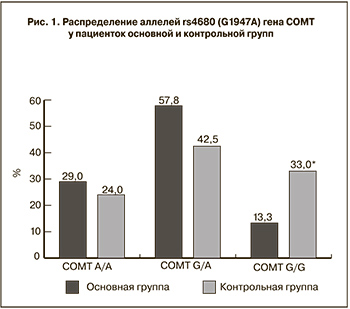
В контексте невынашивания беременности роль полиморфизма G1947А (rs4680) ранее не изучалась. Частота встречаемости генотипов данного полиморфизма в популяции распределилась следующим образом: гомозиготный мутантный генотип А/А выявляется у 30%, гетерозигота G/A около 45% и гомозигота по дикому аллелю G наблюдается у 17% европеоидов. В ходе проводимого общего обследования у пациенток основной группы достоверно чаще были выявлены такие эстроген зависимые заболевания, как миома матки, аденомиоз и фиброзно-кистозная мастопатия. Нам представлялось интересным также проследить взаимосвязь между данными заболеваниями и носительством аллелей rs4680. Распределение генотипов в основной и контрольной группах соответствовало равновесию Харди–Вайнберга. Уровень успешности генотипирования у обследованных пациенток составило 92%. По результатам проведенного нами генотипирования гомозигота G/G выявлена у 33% (n=37) здоровых испытуемых, что оказалось достоверно выше, чем у пациенток с невынашиванием беременности – 13% (n=12), χ2=10,31, р=0,0013 (рис. 1). Данный результат подтверждает протективную роль аллеля G, наличие которого в гомозиготном состоянии обеспечивает продукцию полноценно активного фермента СОМТ.
 Генотип А/А в основной группе встречался в 29% (n=26), что оказалось несколько выше, чем в группе общего контроля 24,4% (n=28) и совпало с общепопуляционными значениями, однако достоверная разница не была установлена (рис. 1).
Генотип А/А в основной группе встречался в 29% (n=26), что оказалось несколько выше, чем в группе общего контроля 24,4% (n=28) и совпало с общепопуляционными значениями, однако достоверная разница не была установлена (рис. 1).
В основной группе количество гетерозигот G/A оказалось на уровне 57,8% (n=52), тогда как среди здоровых женщин этот показатель был ниже и составил 42,47% (n=48), различия статистически незначимы (рис. 1).
С целью выяснения характера проявления наследуемого признака, нами был проведен аддитивный тест Кохрана–Армитажа. По результатам было установлено, что у пациенток основной группы имеется доминантная модель наследования аллеля А, из чего следует что оба генотипа А/А и G/А являются рисковыми по развитию невынашивания беременности у данных пациенток, χ2=5,47, р=0,02. Также нами установлено, что у пациенток носителей аллеля А в 1,61 раза выше шанс потери беременности в первой половине гестации, по сравнению с носителями аллеля G (OR=1,61, р=0,02, 95% df=1,06-2,43).
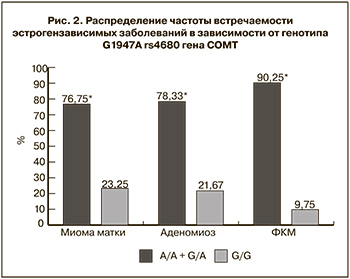
Также мы провели анализ ассоциации аллелей rs4680 гена СОМТ с эстрогензависимыми заболеваниями (миома матки, аденомиоз, фиброзно-кистозная мастопатия) (рис. 2).
Выявлено, что миома матки достоверно чаще наблюдалась у группы пациенток носительниц аллеля А (в гомозиготном и гетерозиготном состоянии), χ2=13,35, р=0,0003. Что касается аденомиоза, то у пациенток с генотипом А/А и G/А также наблюдалось значительное превалирование данного заболевания, по сравнению со здоровыми женщинами, χ2=12,78, р=0,0004. Фиброзно-кистозная мастопатия выявлена в подавляющем большинстве (более 90%) у носителей аллеля А в гомо- и гетерозиготном состоянии, тогда как среди группы с генотипом G/G практически не встречалась, χ2=28,71, р<0,0001 (рис. 2).
Основываясь на приведенных выше данных можно сделать вывод о том, что снижение активности фермента катехоламин-о-метилтрансферазы, обусловленное однонуклеотидной заменой rs-4680 гена СОМТ, приводит к недостаточно эффективной детоксикации эстрогенов и накоплению генотоксичных катехолэстрогенов, что может приводить к повышенному риску развития мультифакторных заболеваний, в том числе и невынашивания беременности.
Поддержание стабильности генома играет крайне важную роль в обеспечении гомеостаза организма. Одним из наиболее важных ферментов эксцизионной репарации ДНК является 8-оксогуанин-ДНК-гликозилаза (OGG1), осуществляющая репарацию окисленных и поврежденных оснований ДНК [15]. Однонуклеотидная замена С977G (rs1052133) гена OGG1 характеризуется заменой цитозина на гуанин в нуклеотидной последовательности, что сопровождается изменением в строении белка с заменой аминокислоты серина на цистеин. По результатам проведенных ранее генетических исследований минорный аллель G ассоциирован с повышенным уровнем спонтанных аберраций хромосомного типа в условиях радиационного загрязнения [15]. По данным ряда авторов генотип G/G был ассоциирован с повышенным риском рака ободочной и прямой кишки, плоскоклеточного рака пищевода, риском развития хронических заболеваний почек, сахарного диабета 2-го типа [6, 8, 16]. Также существуют данные об ассоциации аллеля G с риском развития эпителиального рака яичников, рака молочной железы у пациенток в постменопаузе, а также ряда онкологических заболеваний другой локализации [17].
Несмотря на столь широкое изучение полиморфизма С977G (rs1052133) как предиктора соматических заболеваний, в структуре невынашивания беременности его изучение ранее не проводилось. Частота распределения генотипов в популяции европеоидов выражается в подавляющем большинстве встречаемости дикого генотипа С/С – 60%; 30% европеоидов являются носителями гетерозиготного генотипа С/G, а мутантный генотип G/G является наименее распространенным и встречается всего у 6% европеоидов. В нашем исследовании распределение генотипов rs1052133 гена OGG1 соответствовало равновесию Харди–Вайнберга. Среди пациенток с репродуктивными потерями гомозиготный генотип С/С наблюдался в 59% (n=54), тогда как у здоровых женщин он составил 72% (n=87), однако достоверной разницы выявлено не было (рис. 3).
Гетерозигота C/G в обеих группах наблюдалась примерно в равном проценте случаев, у пациенток с невынашиванием генотип C/G выявлен в 36,3% (n=33), что достоверно не отличалось от группы контроля, где этот показатель оказался равен 27,2% (n=33) (рис. 3).
Генотип G/G наблюдался у 4,39% (n=4) женщин с репродуктивными потерями, тогда как в группе здоровых пациенток выявлен всего в одном случае, χ2=4,1, р=0,04. Установленная разница оказалась статистически достоверной, что позволяет рассматривать генотип G/G как неблагоприятный (рис. 3).
Рис. 3. показывает доминантную модель наследования, то есть рисковый генотип включает аллель G в гомо- и гетерозиготном состоянии.
При оценке odds ratio установлен эффект аллеля G в связи с повышенным риском потери беременности на сроках более 10 недель, (OR=1,72, р=0,04, 95%, df=0,34–0,99).
Заключение
Изученные полиморфные варианты генов ферментов обмена катехоламинов и эксцизионной репарации ДНК являются функционально и клинически значимыми. При включении в состав предгравидарного обследования пациенток генотипирования на выявление генотипов А/А и G/А rs4680 гена СОМТ и генотипов G/G и C/G rs1052133 гена OGG1 возможно сформировать группы риска по невынашиванию беременности. В дальнейшем большой практический интерес представляет разработка методов профилактики, приводящих к снижению негативного фенотипического проявления перечисленных генотипов, что позволит снизить процент репродуктивных потерь в первой половине беременности.



