1) OOO «Test-Tube Baby» Clinic for Assisted Reproductive Technologies, Moscow, Russia;
2) Department of Obstetrics and Gynecology, N.I. Pirogov Russian National Research Medical University, Ministry of Health of Russia, Moscow, Russia;
3) OOO «Center for Human Reproduction and IVF», Rostov-on-Don;
4) OOO «ANEKO», Ufa, Republic of Bashkortostan;
5) New Medical Technologies Clinic, OOO «Personalized Medicine Center», Institute of Chemical Biology and Fundamental Medicine, Siberian Branch, Russian Academy of Sciences, Novosibirsk 6«Istochnik» (Source) IVF Clinic, Chelyabinsk;
7) ZAO «Malysh» (Baby) Medical Center, Tyumen;
8) OOO «IVF» Reproductive Health Clinic, Samara;
9) OOO «Filosofiya Zhizni» (Philosophy of Life), Perm;
10) OOO «Tonus Mama», Nizhny Novgorod;
11) OOO «Genesis Clinic», Simferopol, Republic of Crimea;
12) OOO «Kuban Medical Center», Krasnodar;
13) D.O. Ott Research Institute of Obstetrics, Gynecology, and Reproductology, Saint Petersburg;
14) OOO «Nureevs Clinic», Clinical Medical Diagnostic Center, Kazan;
15) OOO «Infertility Treatment Center», Chelyabinsk;
16) ZAO «Family Medicine Center», Chelyabinsk;
17) OOO «Professor V.M. Zdanovsky Clinic», Moscow;
18) OOO «Perm Mother and Child», Perm;
19) OOO «Genome-Volga», Volgograd;
20) Department of Obstetrics and Gynecology, Institute of Advanced Professional Education, South Ural State Medical University, Ministry of Health of Russia, Chelyabinsk;
21) Academician V.I. Kulakov National Medical Research Center of Obstetrics, Gynecology, and Perinatology, Ministry of Health of Russia, Moscow;
22) Department of Obstetrics and Gynecology, Faculty of Advanced Professional Education, Stavropol State Medical University, Ministry of Health of Russia, Stavropol
Objective. To assess the quality of oocytes, embryos, and outcomes of in vitro fertilization (IVF) cycles in patients with diminished ovarian reserve (OR) who received inositol before infertility treatment.
Subjects and methods. An observational comparative multicenter study pre-IVF TIDOR included 270 patients. Group 1 (n=158) took inositol 4000 mg + folic acid 400 μg (Inofert, Italfarmaco S.p.A., Italy); Group 2 (n=112) did not receive inositol before infertility treatment using IVF. The inclusion criteria were age <38 years; a history of ovarian surgery; AMH <1.0 pg/ml, transfer of ≤2 embryos (ET) in the ovarian stimulation (OS) cycle.
Results. In Group 1 and Group 2, mature oocytes (n=5 (0–7) and 2 (0–5); p = 0.049) and good-quality embryos (42.2 and 30.1%; p = 0.049) were retrieved; there was a high rate of ET-induced pregnancy (38.1and 30.0%; p = 0.041).
Conclusion. It is expedient to use inositol (Inofert, Italfarmaco S.p.A., Italy) in women younger than 38 years after ovarian surgery in order to enhance the efficiency of IVF.
ovarian reserve diminution
infertility
inositol
myo-inositol
in vitro fertilization
pregnancy
Бесплодный брак до сих пор остается глобальной проблемой в медицинских и социальных сферах современного общества. Достигнуты успехи в диагностике и лечении здоровья супружеской пары, но тенденции к снижению числа бесплодия в браке не прослеживается. В России этот показатель неизменно растет и достиг в 2016 г. отметки 278,8 на 100 тыс. женщин в возрасте 18–49 лет, что считается критическим [1]. Доля женского бесплодия в браке достигает 60% [2]. Основная задача репродуктолога при проведении программ овариальной стимуляции (ОС) – получение достаточного числа зрелых ооцитов и эмбрионов хорошего качества. У молодых женщин со сниженным овариальным резервом (ОР) чаще всего в анамнезе отмечаются оперативные вмешательства: резекция яичника (наличие образований), тубэктомия, сальпингоовариолизис. Объем оперативного вмешательства – важный для прогноза реализации репродуктивной функции фактор [3]. Первое место в структуре заболеваний яичников занимает поражение эндометриоидными гетеротопиями, частота которых при бесплодии, по данным разных авторов, составляет от 17 до 44% и может достигать 64% [4]. Лапароскопия – золотой стандарт лечения пациенток с эндометриозом яичников [5]. Травматичное выделение капсулы эндометриоидной кисты с последующим термическим гемостазом области ворот яичника может привести к его острой ишемии и утрате части фолликулярного аппарата, причем в ряде случаев – значимой для реализации фертильности. Данные последних зарубежных метаанализов [6, 7] свидетельствуют о значимом снижении сывороточной концентрации антимюллерова гормона (АМГ), основного маркера ОР, после хирургических вмешательств на органах малого таза. Потенциально низкий уровень ОР – причина не только женского бесплодия, но и неудач экстракорпорального оплодотворения (ЭКО) [8]. В этих условиях оценка качества ооцитов становится одной из главных задач эмбриолога при проведении ЭКО. Оценить морфологию ооцитов и эмбрионов непросто, поскольку основные механизмы, оказывающие влияние на внешний вид ооцита, включают в себя множество факторов [9]. Измененные морфологические характеристики ооцитов негативно сказываются на эффективности оплодотворения и вероятности имплантации эмбрионов [10]. Данные характеристики ооцитов и эмбрионов зависят от таких факторов, как возраст, образ жизни, наличие генетических поломок, вид программы ОС, условия культивирования и др. Исследователи продолжают изучать не только эти факторы, потенциально отражающиеся на качестве гамет и эмбрионов, но и возможности влияния на эту составляющую. В частности, результаты многих последних зарубежных научных исследований продемонстрировали положительный эффект в отношении качества ооцитов и эмбрионов при применении мио-инозитола (инозита) [11].
Инозитолзависимые сигналы играют важную роль на заключительных стадиях созревания яйцеклетки в рамках подготовки к ее успешной активации в момент оплодотворения. Проспективные контролируемые рандомизированные исследования показали, что мио-инозитол улучшает качество не только женских, но и мужских гамет [12, 13]. Важно отметить, что добавление мио-инозитола к фолиевой кислоте у пациенток, которым проводилось лечение бесплодия с помощью ЭКО, позволило уменьшить дозы рекомбинантного фолликулостимулирующего гормона (ФСГ) в программах ОС. Таким образом, удалось увеличить число зрелых ооцитов, полученных в программах ЭКО. В настоящее время остается актуальным вопрос о получении достаточного количества эмбрионов хорошего качества у пациенток со сниженным ОР для повышения частоты наступления беременности (ЧНБ) в программах ЭКО.
Цель исследования pre-IVF TIDOR – оценить качество ооцитов, качество эмбрионов и исходы циклов ЭКО у пациенток со сниженным ОР, получавших инозит перед лечением бесплодия методом ЭКО.
Материалы и методы
В наблюдательное сравнительное многоцентровое исследование pre-IVF TIDOR отобраны 270 пациенток с первичным и вторичным бесплодием, обратившихся в клиники вспомогательных репродуктивных технологий России, входящие в состав саморегулируемой организации «Ассоциация клиник ВРТ» (президент – д.м.н. Э.В. Вартанян, директор ООО «Клиника вспомогательных репродуктивных технологий “Дети из пробирки”») на клинической базе кафедры акушерства и гинекологии (заведующая кафедрой – д.м.н., проф. Ю.Э. Доброхотова) лечебного факультета ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России в период с 01.07.2015 по 31.12.2018 включительно: 1-я группа (n=158) – женщины со сниженным ОР, получавшие инозит 4000 мг + фолиевая кислота 400 мкг (Иноферт, Italfarmaco S.p.A., Италия) перед лечением бесплодия методом ЭКО; 2-я группа (n=112) – женщины со сниженным ОР, не получавшие инозит до наступления беременности в программе ЭКО. Критерии включения: возраст моложе 38 лет, отсутствие генетических и тяжелых экстрагенитальных заболеваний, оперативные вмешательства на яичниках в анамнезе, уровень АМГ <1,0 пг/мл, перенос эмбрионов (ПЭ) ≤2 в цикле ОС. Критерии исключения: возраст 38 лет и старше, наличие генетических и тяжелых экстрагенитальных заболеваний, отсутствие оперативных вмешательств на яичниках в анамнезе, АМГ ≥1,0 пг/мл, перенос размороженных эмбрионов, программы ЭКО с донацией ооцитов. Нами оценены исходы программ ЭКО: количество зрелых ооцитов, количество эмбрионов хорошего качества, ЧНБ на ПЭ.
Перед вступлением в программу ЭКО, на 2–3-й день менструального цикла, выполняли трансвагинальное ультразвуковое исследование (ТВУЗИ) согласно стандартизованной методике [14, 15]. Мониторинг роста фолликулов в цикле контролируемой ОС проводили путем фолликулометрии. Концентрации АМГ, ФСГ, лютеинизирующего гормона (ЛГ), эстрадиола в сыворотке крови определяли микроиммунофлюоресцентным методом.
На этапе прегравидарной подготовки пациентки 1-й группы получали инозит 4000 мг + фолиевая кислота 400 мкг (Иноферт, Italfarmaco S.p.A., Италия), перорально по 4 саше/сут в течение 3 месяцев и во время ОС. После получения ооцитов инозит отменяли. Пациентки 2-й группы получали только фолиевую кислоту 400 мкг + цианокобаламин 2 мкг (Фолибер, Italfarmaco S.p.A., Италия), перорально по 1 табл./сут в течение 3 месяцев и во время протокола ОС. При наступлении беременности пациентки всех групп продолжали прием данного фолатсодержащего препарата до 12 недель гестации.
Контролируемую ОС проводили по следующим схемам: 1) протокол с применением препарата, содержащего ФСГ (фоллитропин альфа 225 ME/сут, подкожно, по схеме), назначая его с 3–5-го дня менструального цикла. Продолжительность введения препарата ФСГ составила от 9 до 12 дней и зависела от размеров доминантного фолликула по данным фолликулометрии. С 5-го по 12-й день на фоне продолжающейся стимуляции суперовуляции применяли также препарат антагониста гонадотропин-рилизинг-гормона (ант-ГнРГ) (цетрореликс 0,25 мг по 1 шпр./сут, подкожно, по схеме); 2) протокол с десенситизацией гипоталамо-гипофизарно-яичниковой системы, которую проводили с применением агониста гонадотропин-рилизинг-гормона (аГнРГ) (трипторелина ацетат 0,1 мг/сут, подкожно, по схеме), начиная с 21-го дня предыдущего цикла и в течение 18 дней с непосредственным переходом к ОС препаратом, содержащим ФСГ (фоллитропин альфа 225 ME/сут, внутримышечно по схеме).
В качестве триггера овуляции во всех группах назначали рекомбинантный человеческий хорионический гонадотропин (ХГЧ) хориогонадотропин альфа 250 мкг, 6500 МЕ, подкожно, однократно («Овитрель», Merk Serono, S.p.A., Италия). Учитывая малое количество полученных ооцитов у пациенток со сниженным ОР после оперативных вмешательств на яичниках, оплодотворение зрелых ооцитов MII единичным сперматозоидом при ЭКО проводили методом интрацитоплазматической инъекции сперматозоида (ICSI – IntraCytoplasmic Sperm Injection) [16]. Качество эмбрионов оценивали по классификации D.K. Gardner и W.B. Schoolcraft (1999) [17]. В полость матки производили перенос 1 или 2 эмбрионов хорошего качества на стадии бластоцисты (эмбрионы 5-го дня развития классов А и В).
Для поддержки лютеиновой фазы цикла использовали микронизированный прогестерон 200–600 мг/сут («Ипрожин», Catalent France Beinheim SA, Capsugel Ploermel SAS France, Laboratorios Effik для Italfarmaco S.p.A., Италия) интравагинально в течение всего периода прегравидарной подготовки с 15-го по 25-й день каждого менструального цикла, в том числе в программе ЭКО до определения уровня β-ХГЧ, и далее до 12 недель гестации [18].
Всем пациенткам определяли уровень β-ХГЧ в периферической крови через 14 дней после ПЭ. При уровне β-ХГЧ >50 МЕ/л тест на наличие беременности считали положительным.
Статистический анализ: математическую обработку результатов проводили с помощью методов описательной статистики, применяя программы Excel 2007, Statistical Package for Social Sciences (IBM SPSS v.23.0), Statistica v.10.0 (StatSoft Inc.). Количественные переменные представлены с помощью N и n, где N – количество пациенток в группе, а n – количество наблюдений в группе. Описательная статистика количественных переменных, имеющих нормальное распределение, представлена в виде M (SD), где М – среднее арифметическое, SD – стандартное отклонение, и 95% доверительного интервала (ДИ); при распределении, отличающемся от нормального, – медианами (Ме) и квартилями (Q1; Q3). Для определения статистической значимости различий количественных переменных в независимых выборках применены непараметрические тесты (критерий Манна–Уитни). Сравнительный анализ количественных переменных выполняли с помощью критерия t Стьюдента. При анализе таблиц сопряженности 2×2 использовали поправку Йетса/точный критерий Фишера. Различия считали статистически значимыми при р<0,05.
Результаты
Средний возраст и индекс массы тела в группах были сопоставимы; средний возраст составил 32,2 (5,7) года, средний индекс массы тела 22,0 (6,7) кг/м2. Частота первичного и вторичного бесплодия в группах была также сопоставима. Так, первичное бесплодие зарегистрировано у 86 (54,4%) женщин 1-й и у 70 (62,5%) пациенток 2-й групп. Сочетание причин бесплодия встречалось у женщин 1-й группы значимо чаще (122 (77,2%) против 63 (56,3%); p=0,047) (табл. 1).
Перед назначением ОС всем женщинам проводили оценку гормонального статуса (табл. 2).
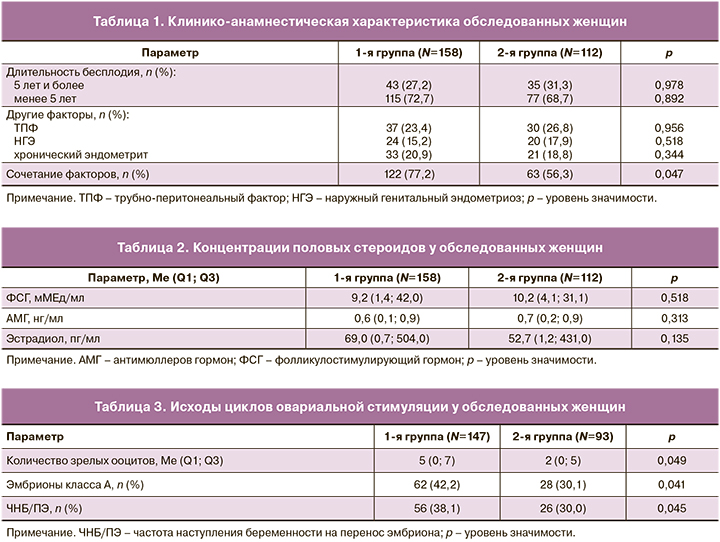
Во всех группах чаще применяли протокол ОС с препаратом, содержащим ФСГ. Однако протокол ОС с десенситизацией гипоталамо-гипофизарно-яичниковой системы значимо чаще использовали у пациенток 2-й группы (75 (47,5%) против 30 (27,2%); p=0,041), что объяснимо несколько более высокой частотой наружного генитального эндометриоза – у 20 (17,9%) женщин. Отмена цикла ОС произошла у 11 (7,0%) женщин 1-й группы и у 19 (12,0%) 2-й группы и была обусловлена отсутствием адекватной динамики роста фолликулов при ОС.
Исходы циклов ЭКО участвовавших в нашем исследовании пациенток представлены ниже (табл. 3). Эмбрионы хорошего качества получены у женщин 1-й группы, которым назначали инозит на этапе прегравидарной подготовки значимо чаще (62 (42,2%) против 28 (30,1%); p=0,041).
Перенос 2 эмбрионов выполнен большинству женщин – 111 (75,5%) в 1-й и 67 (72,0%) во 2-й группах, при этом многоплодная беременность бихориальной биамниотической двойней наступила только у одной пациентки из 1-й группы. Эффективность ЭКО, оцененная по ЧНБ/ПЭ, имела существенные различия в группах. Так, ЧНБ/ПЭ у женщин со сниженным ОР, не получавших инозит на этапе подготовки к лечению бесплодия методом ЭКО, была значимо ниже в сравнении с теми, кому данная терапия была назначена (20 (30,0%) против 56 (38,1%); p=0,045).
Обсуждение
Результаты научных исследований последних лет убедительно доказали связь неблагоприятного прогноза фертильности при длительности бесплодия свыше 5 лет и сочетании причинных факторов [19, 20]. По данным литературы, наиболее часто среди причин бесплодия в браке встречается мужской фактор (до 40–60%) [21], а среди женских факторов бесплодия преобладают хроническая ановуляция (до 30%) и трубный фактор (от 30 до 50%) [22, 23].
В нашем исследовании pre-IVF TIDOR бесплодие продолжительностью 5 лет и более отмечалось у 43 (27,2%) женщин 1-й группы и у 35 (31,3%) 2-й группы, что, вероятно, обусловлено их ранним обращением за медицинской помощью в сфере вспомогательных репродуктивных технологий после перенесенных ранее операций на яичниках. Среди других факторов бесплодия в обеих группах преобладал трубно-перитонеальный фактор (37 (23,4%) и 30 (26,8%); p=0,956). Обращало на себя внимание, что сочетание причин бесплодия отмечалось у подавляющего большинства пациенток 1-й группы (122 (77,2%) против 63 (56,3%); p=0,047). Таким образом, 1-я группа характеризовалась исходно большим риском неудач ЭКО по сравнению со 2-й группой, и это следует принять во внимание при сравнительном анализе результатов данного исследования.
Известно, что ЧНБ при лечении бесплодия методом ЭКО зависит от уровня АМГ [24] и ухудшается по мере прогрессивного снижения данного показателя, не превышая 12% при уровне менее 1,1 нг/мл [25–29]. Результаты некоторых исследований показали, что при сниженном ОР после оперативных вмешательств на яичниках по поводу эндометриом отмечаются не только снижение ЧНБ в программах ВРТ [30–32], но и высокая частота отмены цикла ЭКО – до 30% [24, 25].
В исследовании pre-IVF TIDOR уровень АМГ у женщин 1-й и 2-й групп составил 0,6 (0,1; 0,8) и 0,7 (0,2; 0,9) нг/мл соответственно, что, бесспорно, указывало на снижение ОР после перенесенных оперативных вмешательств на яичниках. Перед вступлением в программу ЭКО у 11 (7,0%) пациенток 1-й группы и у 19 (12,0%) 2-й группы уровень АМГ составил менее 0,5 нг/мл, в связи с чем была предложена донация ооцитов, от которой эти женщины категорически отказались. Адекватной динамики роста фолликулов при ОС у них достичь не удалось, в связи с чем произошла отмена программы ОС, что, безусловно, было связано с крайне низким уровнем АМГ.
Определение базальных концентраций эстрадиола (Е2) и фолликулостимулирующего гормона (ФСГ) – рутинный тест для оценки овариального резерва перед началом программы ЭКО. Доказано, что высокий базальный уровень Е2, даже при нормальном уровне ФСГ, – предиктор «бедного ответа» и риска отмены цикла ОС [26]. Кроме того, результаты некоторых исследований продемонстрировали связь высоких базальных значений Е2 с риском неэффективного ПЭ [27, 28].
В нашем исследовании pre-IVF TIDOR у пациенток обеих групп определялись высокие базальные концентрации Е2 (69,0 (0,7; 504,0) и 52,7 (1,2;431,0) пг/мл) и ФСГ (9,2 (1,4; 42,0) и 10,2 (4,1; 31,1) мМЕд/мл соответственно), что, бесспорно, указывало на наличие сниженного овариального резерва и высокий риск отмены цикла ОС и/или неэффективного ПЭ. В 1-ю группу вошли 43 (27,2%), а во 2-ю – 35 (31,3%) пациенток с длительностью бесплодия 5 лет и более. Отмена цикла ОС была обусловлена отсутствием адекватной динамики роста фолликулов при ОС, что имело место у 11 (7,0%) пациенток 1-й и у 19 (12,0%) пациенток 2-й группы. Детальный анализ лечебных мероприятий по коррекции уровней Е2 и ФСГ до включения в наше исследование не входил в перечень поставленных задач.
Доказано, что возраст – основной фактор, негативно влияющий на качество гамет и эмбрионов, и у пациенток в возрасте моложе 38 лет, даже при сниженном ОР, сохраняется возможность получения эмбрионов хорошего качества в программах ВРТ при условии адекватного роста фолликулов, а ЧНБ/ПЭ может достигать 26% [34].
У пациенток со сниженным ОР, не получавших инозит до вступления в программу ЭКО, достигнуто значимо меньшее количество зрелых ооцитов (2 (0–5) против 5 (0–7); p=0,049), в сравнении с теми женщинами, кому данная терапия была назначена. При сравнении количества эмбрионов хорошего качества в группах установлено, что значимо чаще эмбрионы хорошего качества получены у пациенток с назначением инозита в составе прегравидарной подготовки (62 (42,2%) против 28 (30,1%); p=0,041) перед лечением бесплодия методом ЭКО. ЧНБ/ПЭ у женщин со сниженным ОР, не получавших инозит на этапе прегравидарной подготовки, была также значимо ниже в сравнении с теми, кому данная терапия была проведена (26 (30,0%) против 56 (38,1%); p=0,045). Следует отметить, что у женщин со сниженным ОР после перенесенных оперативных вмешательств на яичниках, характеризующихся повышенным риском неудач ЭКО, после включения инозита в комплекс мероприятий по подготовке к зачатию удалось достичь ЧНБ/ПЭ, сопоставимой со средними показателями эффективности ЭКО в России и в мире [35, 36].
Заключение
Результаты нашего исследования pre-IVF TIDOR убедительно показали, что назначение инозита (Иноферт, Italfarmaco S.p.A., Италия) женщинам моложе 38 лет со сниженным ОР после операций на яичниках, которым предстоит лечение бесплодия методом ЭКО, – оправданный шаг для получения большего числа ооцитов и улучшения качества эмбрионов. Такая тактика на этапе подготовки к программам ЭКО позволит повысить ЧНБ/ПЭ у пациенток с оперативными вмешательствами на яичниках в анамнезе.
- Здравоохранение в России. 2017. Статистический сборник. М.: Росстат; 2017. 170 с. [Health care in Russia. 2017. Statistical compilation. M.: Rosstat; 2017. 170 p. (In Russian)]
- Мелконьянц Т.Г., Мингалева Н.В. Регуляторно-адаптивный статус женщин с бесплодием трубно-перитонеального генеза, эндокринного генеза, с бесплодием, ассоциированным с эндометриозом. Современные проблемы науки и образования. 2015; 6: 170. Доступно по: http://www.science-education.ru/ru/article/view?id=23441. Дата обращения 19.04.2019. [Melkonyants T.G., Mingaleva N.V. The regulatory and adaptive status of women with tubal-peritoneal genesis infertility, endocrine genesis, with infertility associated with endometriosis. Modern problems of science and education. 2015; 6: 170. Available by: http://www.science-education.ru/en/article/view?id=23441 The date of appeal is 04/19/2019.(In Russian)]
- Серебренникова К.Г., Кузнецова Е.П. Хирургическое лечение доброкачественных опухолей яичников. Фундаментальные исследования. 2011; 9: 155. [ Serebrennikova K.G., Kuznetsova E.P. Surgical treatment of benign ovarian tumors. Basic research. 2011; 9: 155. (In Russian)]
- Сахаутдинова И.В., Кулешова Т.П., Зулкарнеева Э.М., Хабибуллина Р.Н. Функциональное состояние яичников у пациенток репродуктивного возраста с эндометриоидными кистами. Медицинский вестник Башкортостана. 2016; 11(4): 29-35. [Sakhautdinova I.V., Kuleshova T.P., Zulkarneeva E.M., Khabibullina R.N. The functional state of the ovaries in patients of reproductive age with endometrial cysts. Medical Bulletin of Bashkortostan. 2016; 11 (4): 29-35. (in Russian)]
- Эндометриоз: диагностика, лечение и реабилитация. Клинические рекомендации. М.; 2013. 86 с. [Endometriosis: diagnosis, treatment and rehabilitation. Clinical guidelines. M.; 2013. 86 p. (In Russian)]
- Allaire C. Endometriosis and infertility: a review. J. Reprod. Med. 2006; 51(3): 164-8.
- Хамзин И.З., Шуйская Д.А., Месропян Э.Д., Степанян Э.С. Влияние биполярной коагуляции на овариальный резерв при энуклеации эндометриоидных кист. В кн.: Тезисы 8-го Международного научного конгресса «Оперативная гинекология – новые технологии». СПб.; 2016: 64 с. [Khamzin I.Z., Shuyskaya D.A., Mesropyan E.D., Stepanyan E.S. The effect of bipolar coagulation on the ovarian reserve during enucleation of endometrial cysts. In: Abstracts of the 8th International Scientific Congress «Operational gynecology – new technologies». SPb; 2016: 64 p. (In Russian)]
- Donnez J., Lousse J.C., Jadoul P., Donnez O., Squifflet J. Laparoscopic management of endometriomas using a combined technique of excisional (cystectomy) and ablative surgery. Fertil. Steril. 2010; 94(1): 28-32.
- Balaban B., Urman B. Effect of oocyte morphology on embryo development and implantation. Reprod. Biomed. Online. 2006; 12(5): 608-15.
- Akande A.V., Asselin J., Keay S.D., Cahill D.J., Muttukrishna S., Groome N.P., Wardle P.G. Inhibin A, inhibin B and activin A in follicular fluid of infertile women with tubal damage, unexplained infertility and endometriosis. Am. J. Reprod. Immunol. 2000; 43(2): 61-9.
- Best M.D., Zhang H., Prestwich G.D. Inositol polyphosphates, diphosphoinositol polyphosphates and phosphatidylinositol polyphosphate lipids: structure, synthesis, and development of probes for studying biological activity. Nat. Prod. Rep. 2010; 27(10): 1403-30. https://dx.doi.org/10.1039/b923844c.
- Korosi T., Barta C., Rokob K., Torok T. Physiological Intra-Cytoplasmic Sperm Injection (PICSI) outcomes after oral pretreatment and semen incubation with myo-inositol in oligoasthenoteratozoospermic men: results from a prospective, randomized controlled trial. Eur. Rev. Med. Pharmacol. Sci. 2017; 21(2, Suppl.): 66-72.
- Bevilacqua A., Carlomagno G., Gerli S., Montanino Oliva M., Devroey P., Lanzone A. et al. Results from the International Consensus Conference on myo-inositol and D-chiro-inositol in Obstetrics and Gynecology – assisted reproduction technology. Gynecol. Endocrinol. 2015; 31(6): 441-6. https://dx.doi.org/10.3109/09513590.2015.1006616.
- Van den Bosch T., Dueholm M., Leone F.P.G., Valentin L., Rasmussen C.K., Votino A. et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: a consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet. Gynecol. 2015; 46(3): 284-98. https://dx.doi.org/10.1002/uog.14806.
- Leone F.P.G., Timmerman D., Bourne T., Valentin L., Epstein E., Goldstein S.R. et al. Terms, definitions and measurements to describe the sonographic features of the endometrium and intrauterine lesions: a consensus opinion from the International Endometrial Tumor Analysis (IETA) group. Ultrasound Obstet. Gynecol. 2010; 35(1): 103-12. https://dx.doi.org/10.1002/uog.7487.
- Приказ Министерства здравоохранения Российской Федерации №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» от 12 февраля 2013 г. [Order of the Ministry of Health of the Russian Federation No. 107n «On the procedure for the use of assisted reproductive technologies, contraindications and restrictions to their use» dated February 12, 2013. (In Russian)]
- Gardner D.K., Schoolcraft W.B. In vitro culture of human blastocysts. In Jansen R., Mortimer D. (eds). Toward Reproductive Certainty. Fertility and Genetics Beyand. 1999. London: Parthenon Publishing. 1999: 378-88.
- Радзинский В.Е., и др. Прегравидарная подготовка: клинический протокол. М.: StatusPraesens. 2016; 80. [Radzinsky V.E., et al. Pregravid preparation: a clinical protocol. M.: StatusPraesens. 2016; 80. (In Russian)].
- Kessler L.M., Craig B.M., Plosker S.M., Reed D.R., Quinn G.P. Infertility evaluation and treatment among women in the United States. Fertil. Steril. 2013; 100(4): 1025-32. https://dx.doi.org/10.1016/j.fertnstert.2013.05.040.
- Вартанян Э.В., Девятова Е.А., Цатурова К.А., Аглямова Д.Р. Роль системной терапии при бесплодии и неудачах реализации репродуктивной функции. Акушерство, гинекология и репродукция. 2018; 12(1): 5-16. [Vartanyan E.V., Devyatova E.A., Tsaturova K.A., Aglyamova D.R. The role of systemic therapy for infertility and reproductive function failure / Obstetrics, gynecology and reproduction. 2018; 12 (1): 5-16. (In Russian)]. https://dx.doi.org/10.17749/2313-7347.2018.12.1.
- Sihag P., Tandon A., Pal R., Jain B.K., Bhatt S., Kaur S., Sinha A. Sonography in male infertility: a look beyond the obvious. J. Ultrasound. 2018; 21(3): 265-76. https://dx.doi.org/10.1007/s40477-018-0294-5.
- Kamel R.M. Management of the infertile couple: an Evidence based protocol Reprod. Biol. Endocrinol. 2010; 8: 21.
- Aslam I., Azhar T., Awais N. Laparoscopic evaluation of tubal factors in infertile patients. Professional Med. J. 2016; 23(4): 472-7. https://dx.doi.org/10.17957/ TPMJ/16.3294.
- Pereira N., Setton R., Petrini A.C., Lekovich J.P., Elias R.T., Spandorfer S.D. Is anti-Müllerian hormone associated with IVF outcomes in young patients with diminished ovarian reserve? Womens Health. 2016; 12(2): 185-92. https://dx.doi.org/10.2217/whe.15.102.
- Yun B.H., Kim G., Park S.H., Noe E.B., Seo S.K., Cho S. et al. .In vitro fertilization outcome in women with diminished ovarian reserve. Obstet. Gynecol. Sci. 2017; 60(1): 46-52. https://dx.doi.org/10.5468/ogs.2017.60.1.46.
- Rasool S. et Shah D. Fertility with early reduction of ovarian reserve: the last straw that breaks the Camel’s back / Fertil Res Pract. 2017;3:15. DOI: 10.1186/s40738-017-0041-1.
- Kultu T., Özkaya E., Sanverdi I. The relationship between estradiol-progesterone alterations after ovulation trigger and treatment success in intrauterine insemination cycles / Turk J Obstet Gynecol. 2016;13(2):56-61. DOI: 10.4274/tjod.45656.
- Prasad S., Kumar Y., Sindhal M. et al. Estradiol Level on Day 2 and Day of Trigger: A Potential Predictor of the IVF-ET Success / J Obstet Gynaecol India. 2014;64(3):202-207. DOI: 10.1007/s13224-014-0515-6.
- Kedem A., Haas J., Geva L.L., Yerushalmi G., Gilboa Y. et al. Ongoing pregnancy rates in women with low and extremely low AMH levels. A multivariate analysis of 769 cycles. PLoS One. 2013; 8(12): e81629. https://dx.doi.org/10.1371/journal.pone.0081629.
- Fadhlaoui A., de la Joiniere J.B., Feki A. Endometriosis and infertility: how and when to treat? Front. Surg. 2014; 1: 24. https://dx.doi.org/10.3389/fsurg.2014.00024.
- Bongioanni F., Revelli A., Gennarelli G., Guidetti D., Delle Piane L.D., Holte J. Ovarian endometriomas and IVF: a retrospective case-control study. Reprod. Biol. Endocrinol. 2011; 9: 81. Available at: http://www.rbej.com/content/9/1/81.
- Maignien C., Santulli P., Gayet V., Lafay-Pillet M.C., Korb D., Bourdon M. et al. Prognostic factors for assisted reproductive technology in women with endometriosis-related infertility. Am. J. Obstet. Gynecol. 2017; 216(3): 280. e1-9.
- Mavrelos D., Saridogan E. Treatment of endometriosis in women desiring fertility. J. Obstet. Gynecol. India. 2015; 65(1): 11-6. https://dx.doi.org/10.1007/s13224-014-0652-y.
- Almog B., Eldar I., Barkan G., Amit A., Wagman I., Levin I. Embryo quality in controlled ovarian stimulation for in vitro fertilization in young poor responders. Gynecol. Endocr. 2014; 30(9): 657-9. https://dx.doi.org/10.3109/095113590.2014.920003.
- Российская ассоциация репродукции человека. Регистр ВРТ. Отчет за 2016 год. СПБ.: Изд-во «Типография», 2018. 71 с. [Russian Association of Human Reproduction. Register of ART. Report for 2016. SPB.: Publishing house «Typography», 2018. 71 p. (In Russian)]
- ESHRE Annual Report, 2017. https://www.eshre.eu/-/media/sitecore-files/AboutESHRE/913479_ESHRE_AnnualReport2017_WEB_DEF.pdf?la=en&hash=47C0F3A9BE8ECFA7DD5DF306F899CEB2ABCF920F (date of appeal 14.06.2019).
Received 27.05.2019
Accepted 21.06.2019
Vartanyan Emma Vramovna, MD, professor of the Department of Obstetrics and Gynecology of Pirogov Russian National Research Medical University; President of the self-regulating society Association of VRT Clinics, obstetrician-gynecologist, reproductologist, director of «Test-Tube Babies» Clinic for Assisted Reproductive Technologies.
117997 Russia, Moscow, Ostrovitianov str., 1. 123182 Russia, Moscow, Schukinskaya str., 2.
Tsaturova Kristina Ashotovna, MD, chief physician of «Test-Tube Babies» Clinic for Assisted Reproductive Technologies, obstetrician-gynecologist, reproductologist.
123182 Russia, Moscow, Schukinskaya str., 2.
Devyatova Ekaterina Aleksandrovna, PhD, doctor of ultrasound diagnostics, obstetrician-gynecologist, «Test-Tube Babies» Clinic for Assisted Reproductive Technologies.
123182 Russia, Moscow, Schukinskaya str., 2.
Mikhaylyukova A.S., obstetrician-gynecologist, reproductologist, «Test-Tube Babies» Clinic for Assisted Reproductive Technologies.
123182 Russia, Moscow, Schukinskaya str., 2.
Levin V.A., endocrinologist, «Test-Tube Babies» Clinic for Assisted Reproductive Technologies. 123182 Russia, Moscow, Schukinskaya str., 2.
Sagamonova K.Y., MD, director of «Centre of Human Reproduction and IVF», professor of the Department of Obstetrics and Gynecology №4 of Rostov State Medical University, obstetrician-gynecologist, reproductologist. 344068 Russia, Rostov-on-Don, Bodraya str., 90А.
Gromenko D.S., MD, director of «АNEKO», urologist. 450029 Russia, Republic of Bashkortostan, Ufa, Puteyskaya str., 2.
Ovsyannikova T.V., MD, chief physician of Clinic NMT, IChBFM of SA RAS, OOO «CPM», obstetrician-gynecologist, reproductologist, doctor of ultrasound diagnostics.
630090 Russia, Novosibirsk, Pirogov str., 25/4.
Erlihman N.M., PhD, obstetrician-gynecologist, reproductologist, doctor of ultrasound diagnostics, Clinica IVF ISTOCHNIK. 454100 Russia, Chelyabinsk, Chicherina str., 36B.
Kolosova E.A., chief of the Medical Department of Medical Centre «Baby», obstetrician-gynecologist, reproductologist.
625002 Russia, Tumen, Sverdlov str., 35-1a.
Safronova Е.V., PhD, obstetrician-gynecologist, reproductologist, Clinic of Reproductive Health «IVF». 443030 Russia, Samara, K. Marx av., 6.
Fotina О.V., chief physician of Clinic «Philosophy of Life», obstetrician-gynecologist, reproductologist. 614107 Russia, Perm, Kim str., 64.
Krasnovskaya Е.V., chief physician of Clinic «Tonus Mother», obstetrician-gynecologist, reproductologist. 603000 Russia, Nizhny Novgorod, Vorovsky str., 22.
Pozharischenskaya Т.G., chief of the Department of Family Planning and Human Reproduction of «Genesis Clinic», obstetrician-gynecologist, reproductologist.
295026 Russia, Crimea Republic, Simferopol, Semashko str., 4.
Autleva S.R., PhD, obstetrician-gynecologist, reproductologist of «Kuban Medical Centre». 350072 Russia, Krasnodar, Moskovskaya str., 65.
Gzgzyan А.М., MD, professor of the Department of Obstetrics, Gynecology and Reproductology of Saint-Petersburg State University, chief of the Department of ART of Ott Research Institute of Russia, obstetrician-gynecologist, reproductologist. 199034 Russia, Saint-Petersburg, Mendeleev Line, 3.
Nuriev I.R., director of CMDC «Nurievs’ Clinic», urologist. 420110 Russia, Kazan, Kasimovs’ Brothers str., 40a.
Voropaeva Е.Е., MD, chief physician of «Centre of Management of Infertility», obstetrician-gynecologist, reproductologist, doctor of ultrasound diagnostics.
454048 Russia, Chelyabinsk, Yablochkina str., 3.
Pestova Т.I., PhD, chief physician of «Centre of Family Medicine», obstetrician-gynecologist, reproductologist. 454021 Russia, Chelyabinsk, Logovaya str., 13.
Zdanovsky V.М., MD, professor, director of LLC Clinic of Professor V. M. Zdanovsky, obstetrician-gynecologist, reproductive specialist.
115191 Russia, Moscow, Holodilny 2-2.
Кim N.А., PhD, obstetrician-gynecologist, reproductive specialist of «Mother and Child Perm», assistant lecture of the Department of Obstetrics and Gynecology of Faculty of Advanced Studies of Perm State Medical University named after academician E.A. Vagner. 614000 Russia, Perm, Ekaterininskaya str., 64.
Kotelnikov А.N., PhD, director of «Genom-Volga», anesthesiologist, reanimation specialist. 400078 Russia, Volgograd, Lenin av., 102A.
Safronov O.V., PhD., associate Professor, head of the Department of obstetrics and gynecology IPDO FSBEI HE South-Ural State Medical University, obstetrician-gynecologist.
454092, Russia, Chelyabinsk,Vorovskogo str., 64.
Nazarenko T.A., MD, professor, director of the institute reproductive medicine, National Medical Research Center of Obstetrics, Gynecology and Perinatology named after Academican V.I.Kulakov Ministry of Health of Russia, obstetrician-gynecologist, reproductologist. 117997 Russia Moscow, Ac. Oparina str., 4.
Ionova R.M., PhD., assistant of the Department of Obstetrics and Gynecology of FDPO GBOU VPO Stavropol State Medical University, obstetrician-gynecologist.
355017, Stavropol, ul. Mira, d. 310. For correspondence: the responsible author is Ekaterina Devyatova, e-mail:
devyatova@baby-ivf.ru, tel .: 8 (495) 981-85-80.
For citations:Vartanyan E.V., Tsaturova K.A., Devyatova E.A., Mikhailyukova A.S., Levin V.A., Sagamonova K.Yu., Gromenko D.S., Ovsyannikova T.V., Erlikhman N.M., Kolosova E.A., Safronova E.V., Fotina O.V., Krasnovskaya E.V., Pozharischenskaya T.G., Autleva S.R., Gzgzyan A.M., Nuriev I.R., Voropaeva E.E., Pestova T.I., Zdanovsky V.M., Kim N.A., Kotelnikov A.N., Safronov O.V., Nazarenko T.A., Ionova R.M. Preparation for the in vitro fertilization treatment of infertility in diminished ovarian reserve.
Akusherstvo i Ginekologiya/Obstetrics and Gynecology. 2019; 8: 134-42 (in Russian)
https://dx.doi.org/10.18565/aig.2019.8.




