Преэклампсия (ПЭ) возникает в 2–8% беременностей и является ведущей причиной материнской и перинатальной смертности и заболеваемости [1].
В настоящее время не вызывает сомнений «плацентарная» теория развития ПЭ, особенно при ее клинической манифестации до 34 нед. беременности (так называемая «ранняя», или «плацентарная» ПЭ), которая заключается в нарушения формирования плаценты в самые ранние сроки гестации. При этом неполноценное ремоделирование и обструктивные повреждения спиральных артерий в зоне соединения или в миометрии рассматриваются как ранний этиологический фактор ПЭ, ведущий к неполноценной инвазии трофобласта [2, 3].
Активное изучение плацентарного ложа было начато в конце 50-х годов прошлого столетия. Объектом исследования служили как удаленные матки (что было оптимальным), так и биоптат плацентарного ложа (плацентарной площадки) при самопроизвольных родах или во время операции кесарева сечения. При этом важное значение имела интраоперационная техника биопсии, от корректности проведения которой зависела целостность представлений о происходящих на территории маточно-плацентарного взаимодействия процессах при физиологически протекающей беременности и при различных осложнениях, в частности при ПЭ.
В настоящее время существует несколько способов биопсии плацентарного ложа при самопроизвольных родах, операции кесарева сечения и гистерэктомии. В пионерских исследованиях при оперативном родоразрешении использовались биопсийные щипцы. При гистерэктомии биопсия плацентарного ложа производилась под непосредственным визуальным контролем. Используя изогнутые ножницы, исследователи получили образец тканей в виде круга диаметром около 1 см. В случае самопроизвольных родов биопсия плацентарного ложа проводилась с помощью остроконечных окончатых щипцов. Эта технология требовала ручного определения локализации плацентарной площадки. При этом окончатые щипцы располагались между ладонью и стенкой матки, а полученный образец для биопсии включал децидуальную оболочку и несколько миллиметров нижележащего миометрия. Авторы рекомендовали проводить взятие образцов таким образом, чтобы можно было получить перпендикулярные срезы децидуальной оболочки и миометрия, что позволяло прослеживать расположение радиальных артерий в миометрии и затем определять, как каждая из спиральных артерий проходит через плацентарное ложе [4]. Биопсия плацентарной площадки может осуществляться под ультразвуковым контролем [5].
Гистологическое подтверждение того, что биопсийный материал взят из плацентарного ложа, основывалось на наличии трофобластных клеток, ворсинок или измененных спиральных артерий. Однако отсутствие этих морфологических компонентов не свидетельствовало о том, что образец не был взят из плацентарного ложа.
Основные сведения о роли цитотрофобластической инвазии в маточно-плацентарной области (плацентарная площадка) и недостаточной гестационной перестройки спиральных артерий эндо- и миометрия при ПЭ были получены в 80-е годы и описаны в ставших классическими исследованиях [6]. С развитием медико-биологических исследований наши знания о плацентарном ложе значительно расширились.
Известно, что при ПЭ не происходит физиологической перестройки (ремоделирования) спиральных артерий, которая состоит из децидуальной и трофобласто-зависимой стадий. Эти процессы имеют место в децидуальной и переходно-соединительной зоне (ПСЗ) миометриальных сегментов артерий, которые рассматриваются как их отдельный структурный компонент. В decidua раннее сосудистое ремоделирование по крайней мере частично осуществляется путем лейкоцитарной инфильтрации, в том чсиле маточными NК-клетками, которые появляются при ранней децидуализации эндометрия в период поздней лютеиновой фазы цикла и группируются вокруг спиральных артерий в начале процесса ремоделирования [7].
NK-клетки играют важную роль в инвазии трофобласта и ремоделировании спиральных артерий. Маточные NK-клетки являются важным источником ангиогенных факторов роста и, в отличие от NK-клеток периферической крови, не обладают цитотоксической активностью, особенно по отношению к клеткам трофобласта, однако продуцируют высокий уровень цитокинов: γ-интерферона (IFN-γ), интерлейкина (ИЛ)-10, гранулоцит-макрофагального колониестимулирующего фактора (GM-КSF), лейкемия-ингибирующего фактора (LIF), фактора некроза опухоли (TNF-α) [8, 9]. На клетках трофобласта человека отсутствуют так называемые классические человеческие лейкоцитарные антигены I класса главного комплекса гистосовместимости (HLA-А и HLA-B), которые являются мишенью для цитотоксического действия NK-клеток периферической крови. В то же время клетки трофобласта экспрессируют HLA-С, HLA – E, HLA – G, которые взаимодействуют с NK-клетками эндометрия и децидуальной ткани и участвуют в процессах развития беременности. Ранняя сосудистая гладкомышечная дезорганизация происходит и в ПСЗ миометрия, где отсутствуют NK клетки. Таким образом, NK клетки играют важную роль в инвазии трофобласта и ремоделировании спиральных артерий. При физиологически развивающейся беременности NK-клетки способствуют замещению клеток эндотелия в спиральных артериях клетками трофобласта, что позволяет спиральным артериям обеспечивать все возрастающие потребности в кровотоке. Однако при ПЭ часто встречается экспрессия на децидуальных NK-клетках варианта АА иммуноглобулинподобных рецепторов киллерных клеток (KIR AA) и на клетках трофобласта – HLA-C2, что приводит к недостаточной функции NK-клеток, снижению продукции сосудисто-эндотелиального фактора роста (VEGF) и IFN-γ и нарушению ремоделирования спиральных артерий. В отличие от decidua, сосудистое ремоделирование в миометрии усиливается за счет наличия интерстициальных трофобластных клеток и локализованных внутри них ангиогенных факторов роста, вносящих вклад в процесс раннего сосудистого ремоделирования [10]. Только после этого этапа сосудистой дезорганизации эндоваскулярные трофобласты появляются в спиральных артериях с последующим их включением в стенку сосуда. Во время этого процесса эндотелий, по-видимому, исчезает, в то время как гладкомышечный и эластический слои сосудов в дальнейшем фрагментируются вследствие трофобласт-индуцированного апоптоза эндотелиальных и гладкомышечных клеток [11].
Трофобластной инвазии предшествуют отек стенки, дезинтеграция эластических элементов и изменения в гладкомышечных клетках, такие как округление ядер, потеря миофибрилл и плотных телец и накопление гликогена. Изменения сосудов, включая и дезорганизацию мышечной стенки, не связаны исключительно с присутствием трофобласта: процесс дезорганизации в гладкомышечных клетках сосудов начинается до появления в них эндоваскулярных трофобластных клеток и усиливается в их присутствии. Кроме того, отмечается высокая частота эндоваскулярной инвазии в ПСЗ миометрия, так называемая «вторая волна» инвазии трофобласта, которая происходит, как правило, после 4-недельного периода присутствия трофобластных клеток в децидуальной оболочке. В ПСЗ миометрия можно выделить 3 различных типа нарушения трансформации спиральных артерий: частичная трансформация, отсутствие трансформации и отсутствие трансформации с обструктивным поражением [5]. Описанные особенности трофобластной инвазии, взятые за основу, представляют важную информацию о формировании в дальнейшем неполноценной плацентации.
Ремоделирование спиральных артерий можно описать как многоступенчатый процесс, который наступает с началом беременности [5, 12]. На основании гистологических исследований образцов, полученных при гистерэктомии в ранние сроки беременности и многочисленных биопсий плацентарной площадки в третьем триместре, выделяют 4 стадии ремоделирования спиральных артерий: начальная стадия ремоделирования, ассоциированного с децидуальной оболочкой (1), интраартериальная миграция трофобластных клеток (2), интрамуральная инвазия и трофобласт-ассоциированное ремоделирование (3) и реэндотелизация и другие изменения, индуцированные со стороны матери (4).
Два главных фактора являются определяющими для кровотока от матери к плаценте: размер плацентарного ложа, который зависит от числа спиральных артерий, сообщающихся с межворсинчатым пространством, и степень физиологической трансформации спиральных артерий, которая наиболее выражена в центре плацентарного ложа.
Исследования плацентарного ложа с помощью биопсии подтверждают, что большинство спиральных артерий подвергаются полному изменению в ПСЗ миометриального сегмента, что согласуется с результатами ультразвуковых исследований. Исследования во втором триместре беременности с использованием импульсно-допплеровского метода с окрашиванием показали, что сопротивление тока крови в центральной области плацентарного ложа меньше, чем на периферии. Результаты скринингового трехмерного ультразвукового допплерометрического исследования c определением сосудистого индекса плацентарного ложа в первом триместре у 4325 беременных в сопоставлении с данными кровотока в маточных артериях в 12 и 22 нед., объемом плаценты и концентрацией РАРР-А выявили высокую прогностическую значимость определения сосудистого индекса плацентарного ложа в развитии тяжелых осложнений беременности, в том числе ПЭ [13].
При тяжелой ПЭ только некоторые из спиральных артерий в центре плацентарного ложа полностью трансформированы в ПСЗ миометрального сегмента. В дополнении к этому повреждения артерий обструктивного характера (например, тромбозы, острые атерозы) могут приводить или способствовать неполноценной плацентации.
Плацентарное ложе пациенток с ПЭ характеризуется уменьшением количества спиральных артерий с трансформированным миометриальным сегментом. Такой сегмент сохраняет гипертрофированную структуру гладкомышечного слоя, несмотря на присутствие интерстициальных трофобластов, иногда даже в избыточном количестве [14]. Определяемые изменения более выражены в миометриальных, нежели в децидуальных сегментах. Плацентарная площадка у пациенток с ПЭ и задержкой роста плода (ЗРП) аналогична описанной у пациенток с ПЭ. Она характеризуется большим количеством нетрансформированных спиральных артерий миометрия, и эти артерии часто имеют обструктивные повреждения, такие как острая атерома и тромбоз. Острая атерома является не только характерным повреждением мелких децидуальных артерий, но также и типичным повреждением спиральных артерий миометрия при ПЭ и ЗРП. Нарушенная глубокая плацентация при ПЭ и ЗРП приводит к появлению центральных зон с трансформированными артериями. Количество интерстициальных вневорсинчатых трофобластных клеток снижено при ПЭ, и наоборот, повышено при ЗРП [15, 16]. Протяженность нарушенной трансформации спиральных артерий миометрия и наличие его обструктивных сосудистых поражений объясняют частое сочетание с инфарктами плаценты.
Исследователями предлагается классификации нарушений глубокой плацентации, которая имеет место при ПЭ, по степени снижения физиологической трансформации спиральных артерий и наличию артериальных повреждений в ПСЗ миометрия плацентарной площадки (таблица).
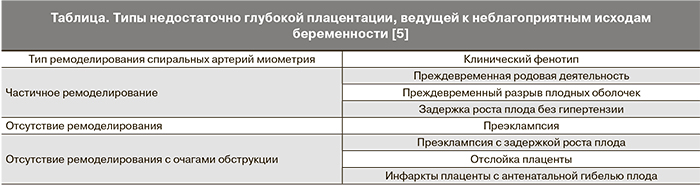
Степень и протяженность физиологической трансформации спиральных артерий различна в зависимости от зоны плацентарной площадки и менее выражена на периферии, чем в центральной части плацентарной площадки. При нормальном течении беременности 90% спиральных артерий в ПСЗ миометрия плацентарной площадки полностью трансформированы.
Сопоставление определенных клинических ситуаций и степени выраженности нарушений ремоделирования спиральных артерий позволило предположить, что процесс циклической децидуализации и последующей менструации служит механизмом подготовки матки для глубокой плацентации. И менструация, и имплантация являются воспалительными состояниями, которые вызывают определенный физиологический ишемический-реперфузионный тканевой стресс. По мнению авторов, регулярные менструации могут иметь решающее значение в защите ткани матки от глубокого воспалительного и оксидативного стресса, ассоциированного с глубокой плацентацией. Этот процесс назван «прекондиционированием» [17].
Отсутствие адекватного «прекондиционирования» может объяснить, почему первая беременность у молодых женщин до 20 лет ассоциирована со значительным риском неблагоприятного исхода (преждевременные роды, ЗРП и ПЭ), по сравнению с первой беременностью у женщин после 20 лет, у которых произошло «прекондиционирование». С другой стороны, нарушения плацентации даже на доклинических стадиях имеются у пациенток с ПЭ и ЗРП. В таких условиях нарушенная глубокая плацентация характеризуется наличием нетрансформированных спиральных артерий ПСЗ, которые могут быть поражены обструктивными васкулярными повреждениями. Артериальные повреждения, такие как гиперплазия интимы, острая атерома и тромбоз могут развиться в этих артериях за очень короткий период времени даже при незначительной гипертензии.
Сочетание акушерских осложнений и различных васкулярных заболеваний в соединительной зоне миометрия указывает на то, что «прекондиционирование» в этой зоне во время оплодотворения может быть решающим фактором для успешной имплантации и нормальной плацентации.
В настоящее время существуют убедительные данные, что патология плацентарного ложа вследствие ишемии и иммунологически опосредованных процессов ведет к различным осложнениям беременности (ПЭ, ЗРП, преждевременные роды, преждевременных разрыв плодных оболочек при недоношенной беременности, отслойка плаценты). А развитие конкретного из перечисленных осложнений зависит от генетических факторов, факторов окружающей среды, срока беременности, длительности и распространенности ишемической зоны. Кроме того, детерминирование клинического фенотипа и тяжесть его проявлений зависят от состояния и взаимодействия системы мать-плод [5, 18, 19].
Молекулярно-биологические исследования последних лет установили важную роль в репродукции микро-РНК (miR) – особого класса коротких одноцепочечных молекул РНК длиной 20–25 нуклеотидов, осуществляющих посттранскрипционную регуляцию экспрессии генов-мишеней путем деградации мРНК или ингибирования ее трансляционной активности [20].
В клетках трофобласта микро-РНК регулируют процессы дифференцировки, пролиферации, апоптоза, инвазии и ангиогенеза [21]. В плацентарных клетках идентифицированы ключевые молекулы, вовлеченные в их биогенез – Drosha, Exportin 5, Dicer, подтверждая активную роль микроРНК в развитии плаценты [22]. Экспрессия микроРНК регулируется факторами окружающей среды, сигнальными молекулами и эпигенетическими факторами.
На сегодняшний день установлена функциональная роль немногих микроРНК. Однако известно, что они участвуют практических во всех процессах развития плаценты, и отклонение уровня их экспрессии от нормы ассоциируется с нарушениями плацентации и различными осложнениями беременности, в том числе ПЭ [23, 24], поскольку она связана с дефектами плацентации [25]. МикроРНК miR-378a-5p и miR-376c усиливают пролиферацию клеток трофобласта путем ингибирования NODAL сигнального компонента из семейства трансформирующего фактора роста бета (TGF-β), ингибирующего пролиферацию и активирующего апоптоз в клетках трофобласта. Снижение экспрессии этих РНК в плаценте ассоциируется с развитием ПЭ. Эти же микроРНК вместе с miR-195 участвуют в активации миграции и инвазии трофобласта. В активации пролиферации клеток трофобласта участвует также микроРНК miR-141. Сниженный уровень ее связан с ЗРП. МикроРНК miR-155 и miR-675, наоборот, ингибируют пролиферацию и активируют апоптоз клеток трофобласта, воздействуя на сигнальную систему Nodal/TGF-β [26]. Вместе с тем продолжается активное изучение детальных эффектов микроРНК на развитие различных патобиологических процессов. Что касается роли аберрантной экспрессии микроРНК в патогенезе ПЭ, то она сводится к нарушению ключевых процессов плацентации – снижению пролиферации, неглубокой инвазии, неполноценному ремоделированию материнских спиральных артерий и нарушению ангиогенеза. У пациенток с ПЭ имеет место повышенная экспрессия в плаценте miR-210 [27], miR-20b [28], miR-29b [23], miR-16, miR-155 [29] and miR-675 [30], которые подавляют ангиогенез и/или пролиферацию, миграцию и инвазию трофобластных клеток. С другой стороны отмечается сниженная экспрессия miR-378a-5p [31], miR-376c [24], and miR-195 [32], которые усиливают трофобластную пролиферацию, выживаемость клеток и/или инвазию. При тяжелой ПЭ была выявлена повышенная экспрессия miR-210, ответственной за митохондриальную дисфункцию за счет подавления активности ISCU (iron-sulfur cluster scaffold homologue) [33, 34].
Таким образом, представленные литературные данные о плацентарном ложе при ПЭ могут способствовать разработке более точных предикторов и биомаркеров. Так, классификация нарушений глубокой плацентации имеет важное значение для исследований и диагностики плаценто-зависимых заболеваний с помощью визуализирующих методик. Справедливости ради следует отметить, что метод исследования биоптатов плацентарного ложа имеет ограничения, поскольку дает информацию лишь о небольшом участке, а распределение трофобластных клеток в ПСЗ миометрия, как известно, является неравномерным. В связи с этим некоторые авторы попытались стандартизировать методику путем использования ультразвукового сканирования для получения биопсии из центра плацентарной площадки. Данная методика может уменьшить частоту ошибок, но не определяет наличие патологических изменений и их выраженность в парацентральных областях. Аналогично, цветное допплеровское и спектральное доплеровское ультразвуковые исследования спиральных артерий также имеют ограничения, потому что они не определяют латеральную протяженность ремоделирования спиральных артерий. Это означает, что результаты, полученные в этих неинвазивных исследованиях, должны интерпретироваться с осторожностью [5]. Несмотря на эти ограничения, метод исследования плацентарного ложа имеет важное значение при сопоставлении с клиническими признаками и при сравнении с образцами при неосложненной беременности.
Инвазия трофобласта контролируется комплексом растворимых ауто- и паракринных факторов, сигнальных путей и регуляторных транскрипционных факторов. Прогресс в понимании молекулярных процессов, происходящих при имплантации, показывает, что экспрессия различных микроРНК является объектом разработки панели предикции и ранней диагностики ПЭ. Действие miR-210 и miR-518c направлено на фермент гидростероид (17ß) дегидрогеназу, экспрессируемый плацентой и ответственный за конверсию эстрона в эстрадиол [35]. В проспективном исследовании было обнаружено, что концентрация этого фермента в плазме была значительно ниже на 20–23-й и 27–30-й неделях беременности у женщин накануне клинической манифестации ПЭ, что может служить потенциальным биомаркером-предиктором.
В настоящее время из числа биомаркеров с целью предикции в основном «ранней» ПЭ используются ангиогенные факторы в более поздние сроки беременности, когда уже сформировались все предпосылки для развития данного мультисистемного расстройства. Вместе с тем, комплексное изучение плацентарного ложа c использованием инновационных технологий при акушерских осложнениях, в том числе при ПЭ, с последующей разработкой панели биомаркеров будет способствовать не только ранней диагностике и прогнозированию риска развития ПЭ, но, возможно, откроет новые горизонты в плане раннего превентивного таргетного вмешательства на маточно-плацентарной территории для обеспечения нормального развития беременности.



