Работа частично поддержана Государственным контрактом Министерства образования и науки РФ № 16.522.12.2009 от 29.09.2011.
Преждевременная недостаточность яичников (ПНЯ) – это клинический синдром, типичным проявлением которого является преимущественно стабильная и в редких случаях эпизодически преходящая гипергонадотропная аменорея у женщин моложе 40 лет [1]. Ведущей причиной заболевания являются молекулярно-генетические нарушения, касающиеся в основном половых хромосом [2]. Однако в 50–80% случаев наблюдается идиопатическая форма заболевания, в связи с чем поиск новых этиологических причин, приводящих к преждевременному истощению примордиального пула яичников, является, безусловно, весьма актуальным направлением, позволяющим в значительном проценте случаев не только снизить представленность идиопатических форм заболевания, но и, возможно, наметить новые диагностические и лечебные подходы, способствующие преодолению наиболее серьезной и трудно решаемой задачи – лечение бесплодия яичникового генеза.
Исследованиями последних лет установлено, что железо (Fe2+) и в первую очередь его свободные фракции могут быть вовлечены в генерацию токсичных свободных радикалов и перекисное окисление липидов, приводя к окислительному повреждению белков и нуклеиновых кислот с наступлением гибели клеток путем ускорения апоптоза [3]. При избыточном ферментативно неконтролируемом содержании железа образуется лабильный пул железа, который, поступая в клетку, оказывает повреждающее воздействие на клеточные мембраны, нуклеиновые кислоты, а также влияет на активность цитокинов, вызывая процесс фиброзообразования. В ряде случаев, когда «емкости системы трансферрин-ферритин» заполнены железом, в плазме крови может находиться железо, связанное с другими белками плазмы, прежде всего с альбумином (так называемое нетрансферрин-связанное железо – НТСЖ), впервые идентифицированное Hersko и соавт. [4]. Такая нестабильная и неуправляемая форма железа представляет собой опасность, так как является источником образования свободных ионов двухвалентного железа. В плазме здоровых людей НТСЖ почти не определимо, однако оно может выявляться в значительном количестве в плазме больных при перегрузке железом [5].
Патологическое накопление железа в паренхиматозных органах ассоциируется с дегенеративными изменениями клеточной паренхимы и прогрессирующим развитием фиброзной ткани, что ведет к необратимому нарушению функции органа. Мишенями токсического воздействия железа оказываются в первую очередь паренхиматозные органы (печень, поджелудочная железа), а также половые железы и миокард [6]. В настоящее время такие заболевания, как диабет, туберкулез, патология сердечно-сосудистой системы обоснованно связывают с недостаточностью работы системы гомеостаза железа в организме и высокой степенью корреляции с мутациями в гене HFE (наследственного гемохроматоза). Заболевание, характеризующееся врожденным или приобретенным нарушением обмена железа в организме, называется гемохроматозом. Чаще всего встречается первичный, или наследственный гемохроматоз, вызванный дефектом гена HFE1 (OMIM 235200), локализованном на 6-й хромосоме в локусе р21.3. Его продукт – трансмембранный белок, который в литературе известен как белок наследственного гемохроматоза – HFE [7]. Белок HFE может регулировать поступление и распределение железа несколькими путями: подавлять перенос комплекса трансферрин-железо через мембрану, блокируя трансферриновый рецептор (TfR1), который формирует сигнал о содержании железа в организме, модулировать экспрессию гепсидина, который в норме регулирует метаболизм железа и процессы его интестинальной абсорбции. Наличие мутаций в гене HFE приводит к тому, что нарушается регуляция всасывания и распределения железа в организме, вследствие чего происходит избыточное накопление железа в различных клетках вне зависимости от реальных потребностей в нем [8].
Самая частая мутация гена HFE1 (обнаруживается у 87–90% больных гемохроматозом) – это С282Y – замена цистеина на тирозин в 282-й позиции, что приводит к полной неспособности взаимодействия белка HFE с TfR1. Реже встречается мутация Н63D – замена цитидина на гуанин в 63-й позиции (примерно 3–5% больных), при которой аффинность HFE к TFR1 снижается в меньшей степени. Большинство пациентов с типичным фенотипом наследственного гемохроматоза являются гомозиготами 282Y/282Y и меньшая часть – гомозиготами 63D/63D. Гомозиготы 63D/63D имеют, как правило, нетяжелую форму заболевания. Еще одна значимая мутация: S65C – при гомозиготности по этой мутации обычно развивается легкая форма гемохроматоза. Также небольшой процент больных является смешанными или компаунд-гетерозиготами (чаще всего C282Y/H63D) [9]. Компаунд-гетерозигота – это гетерозигота по двум мутантным аллелям одного гена (на одной хромосоме мутация в одном положении, а на аллельной хромосоме – в другом. В результате обе копии гена так или иначе повреждены.

При проведении генетического скрининга в США было установлено, что даже гомозиготное состояние по мутациям в гене HFE не всегда приводит к развитию классической триады симптомов наследственного гемохроматоза («бронзовый диабет» с поражением печени), то есть заболевание обладает неполной пенетрантностью и чаще всего развивается после 40–50 лет, что в первую очередь обусловлено тем, что для накопления токсической дозы железа (около 20 г) необходимо продолжительное время. В случае рациона, насыщенного железом, заболевание может развиться и в более раннем возрасте [10]. Пациенты, имеющие только одну дефектную копию гена HFE, обычно не имеют клинических признаков гемохроматоза, однако при изучении обмена железа у гетерозиготных носителей мутации С282Y показано, что для таких людей характерен избыточный запас железа в организме, а в ряде случаев могут наблюдаться лабораторные признаки перегрузки железом и стертая клиническая симптоматика [11].
О связи мужского бесплодия с перегрузкой организма железом при наследственном гемохроматозе известно давно [12]. В литературе есть данные об атрофии яичек при наследственном гемохроматозе. Известно, что 80% мужчин с этой патологией страдают тестикулярной дисфункцией. Гипогонадизм развивается вторично вследствие скопления железа в печени и нарушения продукции ТЭСГ с развитием относительной гиперэстрогении на фоне андрогенного дефицита или может быть первичным как результат депонирования этого микроэлемента в яичках. При электронной микроскопии ткани тестикул этих пациентов выявлено большое количество гранул гемосидерина и липофусцина в клетках Сертоли и Лейдига, что в дальнейшем привело к атрофии яичек. Имеются также данные о скоплении железа в гипофизе, приводящего к дисфункции гипоталамо-гипофизарно-тестикулярной системы. В зарубежной литературе имеются единичные публикации, посвященные влиянию избытка железа на репродуктивную функцию женщин [13, 14]. Однако работ, в которых на современном уровне анализировалось бы токсическое влияние избытка железа на фолликулярный аппарат женщин, практически нет.
 Считается, что частота встречаемости гемохроматоза у женщин в 5–10 раз ниже, чем у мужчин и в большинстве случаев развивается только после менопаузы, что чаще всего объясняют профилактическим эффектом физиологической потери крови в период менструаций. Показано, что содержание железа в печени у женщин после гистерэктомии или ранней менопаузы выше, чем у нормально менструирующих женщин (Powell). Масштабные исследования, включавшие 10 центров США, показали, что уровень ферритина сыворотки у здоровых женщин составляет около 30 мкг/л до менопаузы, далее растет, достигая примерно 80 мкг/л [15].
Считается, что частота встречаемости гемохроматоза у женщин в 5–10 раз ниже, чем у мужчин и в большинстве случаев развивается только после менопаузы, что чаще всего объясняют профилактическим эффектом физиологической потери крови в период менструаций. Показано, что содержание железа в печени у женщин после гистерэктомии или ранней менопаузы выше, чем у нормально менструирующих женщин (Powell). Масштабные исследования, включавшие 10 центров США, показали, что уровень ферритина сыворотки у здоровых женщин составляет около 30 мкг/л до менопаузы, далее растет, достигая примерно 80 мкг/л [15].
Исходя из этого, понятна трудность установления этиологических факторов первичного повреждения яичников у женщин с преждевременной недостаточностью яичников, при нарушении обмена железа. С одной стороны имеется нарушение менструального цикла в виде аменореи, что, безусловно, может способствовать накоплению железа, а с другой стороны, само по себе накопление железа может способствовать первичному повреждению яичников.
Целью нашего исследования стало изучение гомеостаза железа на системном и тканевом уровне у пациенток с преждевременной недостаточностью яичников.
Материалы и методы
Функциональное состояние гипоталамо-гипофизарно-яичниковой системы оценивали у 102 пациенток, включенных в исследование по содержанию в сыворотке крови фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ) гормонов, эстрадиола (Е2), антимюллерова гормона (АМГ). Концентрацию гормонов исследовали методом иммуноферментного анализа с помощью соответствующих тест-систем на автоматическом анализаторе «Cobar Core II».
Для выявления признаков перегрузки железом у больных с ПНЯ нами проведено комплексное 4-этапное обследование. Молекулярно-генетическое исследование на наличие мутаций гена HFE проводилось у 102 пациенток. Контрольную группу составила 101 женщина с физиологической менопаузой. ДНК выделяли из цельной крови с помощью системы выделения «Проба-ГС». Проводился SNP анализ гена HFE в трех позициях: 845G>A (Cys282Tyr, rs1800562), 187 C>G (His63Asp,rs1799945) и 193 A>T (Ser65Cys,rs1800730). Определение замен одиночных нуклеотидов (SNP) проводили модифицированным методом «примыкающих проб» (adjacent probes, kissing probes) с использованием наборов реагентов ООО «НПО ДНК-Технология», Россия. Полимеразную цепную реакцию и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия), согласно инструкции производителя.
 На втором этапе 22 пациентки с выявленными мутациями в гене HFE были обследованы в гематологическом центре специалистами по гемохроматозу. Уровень железа и общей железосвязывающей способности сыворотки крови определяли калориметрическим методом Генри с β-фенантралином с помощью стандартных наборов фирмы «Иммунотех». Трансферрин – методом радиальной иммунодиффузии в агаре. Ферритин – стандартным радиоиммунологическим методом с использованием наборов ИРМО-ферритин. Насыщение трансферрина железом – отношение концентрации сывороточного железа к общей железосвязывающей способности сыворотки, выраженное в процентах.
На втором этапе 22 пациентки с выявленными мутациями в гене HFE были обследованы в гематологическом центре специалистами по гемохроматозу. Уровень железа и общей железосвязывающей способности сыворотки крови определяли калориметрическим методом Генри с β-фенантралином с помощью стандартных наборов фирмы «Иммунотех». Трансферрин – методом радиальной иммунодиффузии в агаре. Ферритин – стандартным радиоиммунологическим методом с использованием наборов ИРМО-ферритин. Насыщение трансферрина железом – отношение концентрации сывороточного железа к общей железосвязывающей способности сыворотки, выраженное в процентах.
Для определения НТСЖ у 102 пациенток с ПНЯ на третьем этапе работы нами применен метод спектроскопии электронного парамагнитного резонанса (ЭПР). Контрольную группу составила 91 женщина – донор крови с регулярным ритмом менструации среднего возраста 45±1,8 года. Исследования образцов гепаринизированной крови и сыворотки проводили с помощью прибора фирмы «Брукер» ECS-106 в 3 см диапазона (Х-диапазон) в кварцевом дьюаре при температуре –146оС. Количественную оценку проводили методом двойного интегрирования с последующей нормировкой на величину площади ЭПР сигнала стандартного образца и выражали в относительных единицах. Математическая процедура вычитания проделана с помощью программного обеспечения прибора ECS-106, реализованная на базе компьютера Motorolla. Условия регистрации спектра: Х-диапозон, амплитуда модуляции 5 гаус, СВЧ-мощность 20 мВт, усиление 2-5×105 , 2–8 накоплений.
На четвертом этапе исследования для выявления гранул гемосидерина проведено гистохимическое исследование 8 образцов яичниковой ткани от больных с ПНЯ, имеющих мутации в гене HFE. Биопсийный материал получен при ранее произведенной лапароскопии. В качестве контроля был использован аутопсийный материал яичниковой ткани от 4 женщин, погибших при чрезвычайных обстоятельствах (средний возраст – 49,6±4,4 года) и биопсийный материал яичниковой ткани от 5 женщин, которым производилась экстирпация матки и придатков по поводу несостоятельности мышц тазового дна (средний возраст 49,6±17 лет). Гистологические препараты окрашивали гематоксилин-эозином, подвергали гистологическому исследованию. Для выявления гранул гемосидерина как агрегированной и нерастворимой формы отложений железа гистохимически проводилась реакция Перлса.
Статистическая обработка данных проводилась с помощью свободно распространяемого программного продукта WINPEPI версии 11.4 [16]. Для определения статистической значимости различий применялись точный двухсторонний критерий Фишера, критерий χ2 и U-тест Манна–Уитни для несвязанных совокупностей.
Результаты
Средний возраст пациенток составил 31,46±4,4 года. Уровень ФСГ составил 105,7±35,1 МЕ/мл, ЛГ – 64,3±41,3 МЕ/мл, Е2 – 75,9±54,2 пг/мл. Концентрация АМГ не превышала 0,5 пг/мл.
При проведении SNP анализа гена HFE у 22 из 102 обследованных пациенток основной группы (21,6%) и 16 из 101 контрольной (15,8%) выявлены различные мутации в этом гене (табл. 1).
При сравнении распределения генотипов гена HFE в основной и контрольной группах (табл. 1) достоверных различий выявлено не было (р>0,05). У 5 пациенток одновременно сочетались мутации С282T и H63D, у одной – H63D и S65C. Анализ родословной этих больных показал, что у одной из пациенток с двумя гетерозиготными мутациями дядя страдал классической формой первичного гемохроматоза с характерной триадой симптомов: цирроз печени, меланодермия и сахарный диабет, которые стали причиной его смерти в молодом возрасте. В контрольной группе пациенток с компаунд гетерозиготой было всего 2, однако данные различия не достигали уровня статистической значимости.
Изучение преморбидного фона и проведение физикального обследования показало, что у всех пациенток с гомозиготной мутацией H63D отмечен бронзовый оттенок кожи. При этом одна из них страдала гепатитом В, у двоих отмечена стойкая гипербилирубинемия в анамнезе и неоднократные подъемы уровня печеночных ферментов на фоне нормальных УЗ параметров печени.
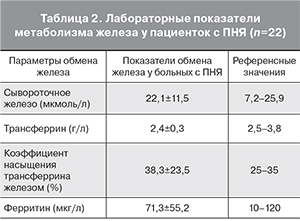
 Уровень сывороточного железа крови пациенток с ПНЯ составил в среднем 22,1±11,5 мкмоль/л, при этом у 31,8% (7 из 22) этот показатель был выше верхнего допустимого предела. Концентрация трансферрина была снижена у 45,5% (10 из 22) пациенток, составляя 2,4±0,3 г/л, при этом коэффициент НТЖ был повышен у каждой второй пациентки (11 из 22), составляя 38,3±23,5%. Уровень ферритина в крови превышал допустимую норму у 27,3% (6/22) и составил в среднем 172±37,5 мкг/л.
Уровень сывороточного железа крови пациенток с ПНЯ составил в среднем 22,1±11,5 мкмоль/л, при этом у 31,8% (7 из 22) этот показатель был выше верхнего допустимого предела. Концентрация трансферрина была снижена у 45,5% (10 из 22) пациенток, составляя 2,4±0,3 г/л, при этом коэффициент НТЖ был повышен у каждой второй пациентки (11 из 22), составляя 38,3±23,5%. Уровень ферритина в крови превышал допустимую норму у 27,3% (6/22) и составил в среднем 172±37,5 мкг/л.
Отклонения от нормативных показателей обмена железа отмечены у 15 из 22 пациенток (68,2%), при этом одной из пациенток с гомозиготной мутацией H63D и пациентке с сочетанием двух мутаций C282Y и H63D гематологами был выставлен и подтвержден диагноз классической формы наследственного гемохроматоза, что потребовало проведения специфической терапии.
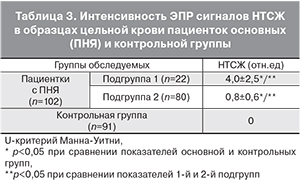
На третьем этапе обследования для удобства анализа мы сочли возможным разделить пациенток с ПНЯ на 2 подгруппы. Первую подгруппу составили 22 пациентки с мутациями в гене HFE, вторую подгруппу – 80 пациенток с нормальным геном HFE (табл. 3).
У 40,9 % (9 из 22) пациенток с ПНЯ подгруппы 1 методом ЭПР обнаруживалось парамагнитное нетрансферрин-связанное железо (gсреднее=2,8). При проведении сравнительного анализа пациенток с мутацией и без мутаций в гене HFE по уровню НТСЖ в крови было установлено достоверное повышение интенсивности сигналов НТСЖ у больных с ПНЯ 1-й подгруппы (4,0±2,5 против 0,8±0,6). У женщин контрольной группы уровень НТСЖ соответствовало фоновому значению (р<0,001) (табл. 3, рис. 1).
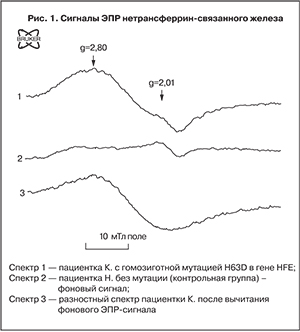
На рис. 1 показан разностный спектр ЭПР нетрансферрин-связанного железа пациентки К., до (линия 1) и после вычитания фонового (контрольный образец крови – линия 2) ЭПР сигнала в области g~2,8. Сигнал имеет форму синглета, проведенный нами анализ позволяет считать распределение парамагнитных комплексов железа в организме пациентов близким к нормальному. Это свидетельствует о том, что за ЭПР-сигнал ответственны парамагнитные центры одной и той же структуры и соответственно природы.
При гистологическом исследовании яичниковой ткани было установлено, что несмотря на стойкую гипергонадотропную аменорею, примордиальные фолликулы были сохранены у 25% (2 из 8) больных с ПНЯ, у остальных 75% (6 из 8) фолликулы отсутствовали. Атретичные фолликулы были выявлены у 25% (2 из 8), желтое тело на стадии регресса – у 12,5% (1 из 8), фиброз стромы у 75% (6 из 8), инклюзионные кисты – у 25% (2 из 8), дистрофия теки интерны – у 12,5% (1 из 8) пациенток.
При гистохимическом окрашивании образцов яичниковой ткани (рис. 2 см. на вклейке) обнаружено, что у 6 из 8 образцов (75%) внутри и вне клеток в корковом, а также в периваскулярном пространстве мозгового слоев имеются единичные скопления гранул гемосидерина. Наличие этих гранул, а также фиброза стромы и стенок сосудов в мозговом слое ткани яичников пациенток с ПНЯ могут свидетельствовать о перегрузке яичниковой ткани железом. В контрольных образцах яичниковой ткани (n=9) отложений железа выявлено не было, что подтверждает выдвинутую нами гипотезу о возможном токсическом влиянии нетрансферрин-связанного железа на фолликулярный аппарат пациенток с ПНЯ при наличии мутаций в гене HFE.
Исходя из полученных результатов, несмотря на отсутствие статистически значимых различий по частоте выявления мутаций в гене HFE, можно предположить, что у части пациенток с ПНЯ при наличии мутаций в гене HFE одной из причин яичниковой дисфункции является отложение в ткани яичников гемосидерина или органических комплексов железа.
Обсуждение
В связи с доказанной ролью ускоренного апоптоза как ведущей причины истощения фолликулярного пула при преждевременной недостаточности яичников нами предприняты попытки поиска новых молекулярных и генетических механизмов, оказывающих токсическое воздействие на фолликулярный аппарат яичников. Для объяснения запуска процесса ускоренного апоптоза в фолликулярном аппарате пациенток с ПНЯ мы сочли возможным в качестве гипотезы рассматривать эти процессы на клеточном уровне с позиции определяющей роли железа в денитрозилировании каспазы 3 (или каспаз) [17]. Согласно современным представлениям о процессе апоптоза в клетке [18, 19] оксиду азота отводится важная роль в реакции нитрозилирования белков. Апоптоз блокируется за счет ингибирования одной из ключевых каспаз – каспазы 3. Это достигается присоединением оксида азота к атому серы цистеина в активном центре каспазы 3. В настоящее время известно более двух сотен белков, активность которых понижается при связывании оксида азота, то есть их нитрозилировании [20]. Мы полагаем, что выявленное нами избыточное железо в тканях яичников у пациенток с ПНЯ может препятствовать переносу оксида азота на каспазу 3 и тем самым создавать условия для запуска всего каскада реакций апоптоза. Учитывая высокую афинность железа и оксида азота, участие этого микроэлемента в денитрозилировании каспазы 3, на наш взгляд, является вполне обоснованным, так как в настоящее время не обнаружен фермент, непосредственно ответственный за данный процесс.
В результате проведенного исследования выявлена высокая частота носительства мутаций в гене HFE как в основной (21,6%), так и в контрольной группах (15,8%). Причина высокой частоты встречаемости мутантного HFE гена в популяции неизвестна. Возможно, что в прошлом, когда дефицит железа был чрезвычайно распространенным, гетерозиготы имели селективное преимущество, так как они могли более эффективно восполнять недостаток железа и были относительно защищены от дефицита железа [2].
Определение биохимических маркеров обмена железа является решающей ступенью в диагностике гемохроматоза. Рекомендуемые методы определения этих маркеров описаны в 1990 г. Международным комитетом по стандартизации в гематологии (ICSH) [21].
Изучение в нашей работе основных биохимических параметров обмена железа у больных с ПНЯ с мутациями в гене HFE продемонстрировало повышенный уровень сывороточного железа у 31,8% пациенток, увеличенную насыщенность трансферрина у 50% больных при снижении его концентрации у 45,5% больных. В нашем исследовании уровень ферритина превышал норму у каждой третьей пациентки. НТЖ – это ключевой параметр, отражающий основную метаболическую аномалию у пациентов с гемохромотозом [22].
В связи с гетерогенностью НТСЖ мы использовали физический метод спектроскопии магнитного резонанса – электронный парамагнитный резонанс. Он позволяет обнаружить тонкие нарушения в системах снабжения, транспорта и депонирования железа [23].
Проведение ЭПР-спектроскопии цельной крови и сыворотки позволило выявить признаки перегрузки организма железом, о чем свидетельствуют наличие нетрансферрин-связанного железа у 40,9% пациенток, имеющих мутации в гене HFE. Гистохимическое исследование показало наличие гранул гемосидерина в корковом и периваскулярном пространстве мозгового слоя ткани яичников 75% обследованных пациенток с мутациями в гене HFE.
Исходя из полученных результатов, несмотря на отсутствие статистически значимых различий по частоте выявления мутаций в гене HFE, можно предположить, что у части пациенток с ПНЯ при наличии мутаций в гене HFE одной из причин яичниковой дисфункции является отложение в ткани яичников гемосидерина или органических комплексов железа.
Заключение
Таким образом, все выше представленное свидетельствует об определенной роли перегрузки железом и сопряженного с ним снижения антиоксидантной активности в развитии ПНЯ, что на клеточном уровне может способствовать запуску процесса ускоренного апоптоза в ткани яичников.
При выявлении мутации в гене HFE у больных с ПНЯ показана необходимость направлять этих пациенток к врачу-гематологу для углубленного исследования обмена железа.
С нашей точки зрения группу риска по развитию наследственного гемохроматоза необходимо расширить за счет включения в нее больных с ПНЯ. Целесообразным представляется проведение в этой группе молекулярно-генетического исследования на наличие мутаций гена HFE.



