Синдром гиперстимуляции яичников (СГЯ) – ятрогенное осложнение овариальной стимуляции в программах вспомогательных репродуктивных технологий, в основе которого лежит гиперэргический неконтролируемый ответ яичников на введение гонадотропинов. СГЯ характеризуется широким спектром клинических и лабораторных проявлений: от легких биохимических изменений до выраженного увеличения размеров яичников с формированием в них фолликулярных и лютеиновых кист на фоне выраженного отека стромы; увеличением сосудистой проницаемости, массивным переходом жидкой части крови из внутрисосудистого в «третье пространство» [1, 2]. Частота СГЯ различной степени тяжести варьирует от 0,5 до 33% при различных схемах стимуляции овуляции [3, 4]. Выделяют раннюю и позднюю формы СГЯ. Эти две формы разграничены не только по временным параметрам, но и по механизму развития. Ранняя форма СГЯ обычно проявляется на 3–9-е сутки после введения овуляторной дозы хорионического гонадотропина человека (ХГч) и связана с чрезмерным ответом яичников на экзогенную гонадотропную стимуляцию. В случае отсутствия имплантации явления СГЯ спонтанно купируются с наступлением менструации, редко достигая тяжелой формы. При поздней форме СГЯ клиническая симптоматика манифестирует на 9–12-е сутки после введения овуляторной дозы ХГч, что, как правило, связано с эндогенной секрецией ХГч при наступившей беременности. Этот вариант СГЯ обычно протекает в более тяжелой форме и разрешается медленнее [5].
Lyons и соавт. в 1994 году первыми предположили, что ранние и поздние формы СГЯ могут развиваться как разные нозологические формы. У пациенток с ранней формой СГЯ выявляли значимое повышение уровня эстрадиола (Е2) в день назначения триггера овуляции ХГч и большее количество полученных ооцитов по сравнению с пациентами без СГЯ. У пациенток с поздним СГЯ были выявлены многоплодные беременности по данным ультразвукового исследования (УЗИ) через 4 недели после переноса эмбрионов. Симптомы раннего СГЯ купировались самостоятельно и не переходили в поздние формы, тогда как симптомы позднего СГЯ были гораздо более выраженными и требовали медикаментозной коррекции [6]. В исследовании Mathur и соавт. (2000) было подтверждено, что пациенты с ранними формами СГЯ имеют значимо более высокие уровни Е2 и обладают лучшим овариальным ответом на введение меньших доз гонадотропинов по сравнению с пациентами с поздними формами и пациентами без СГЯ [7].
Пусковым механизмом развития СГЯ традиционно считают экзогенное введение или эндогенную выработку ХГч. Прогрессирование данного осложнения поддерживается также лютеиновыми кистами и возрастающей циркуляцией ХГч. Несмотря на то, что СГЯ возникает, как правило, в циклах ЭКО при гонадотропной стимуляции, описаны случаи спонтанных форм СГЯ [8, 9]. Спонтанный СГЯ обычно развивается между 8-й и 14-й неделями беременности. Ранее его развитие объясняли чрезмерной секрецией ХГч при многоплодной беременности, пузырном заносе, синдроме поликистозных яичников [10, 11]. Выявление пациенток с развившимся спонтанным СГЯ, не обусловленным вышеперечисленными факторами, положило начало генетической теории развития спонтанных форм СГЯ и послужило толчком к углубленному изучению полиморфизма генов гормонов и их рецепторов, участвующих в патогенезе данного состояния [12–15]. В частности, эпизоды СГЯ, спонтанно возникающие во время беременности, связывают с мутацией гена рецептора фолликулостимулирующего гормона (ФСГ) [8, 16], в результате которой изменяется способность рецептора взаимодействовать с гормоном, он становится более чувствительным к ХГч, что приводит к чрезмерной стимуляции рецепторов гранулезных клеток и, как следствие, к интенсивному росту и развитию фолликулов [8].
В настоящее время интерес исследователей сконцентрирован в основном на поиске генетических предикторов развития данного осложнения, как спонтанного, так и ятрогенного. Практическую значимость представляет анализ клинических проявлений СГЯ, в частности, времени начала манифестации и течения данного осложнения, в зависимости от генотипа пациентки, чему и посвящено настоящее исследование.
Цель исследования – поиск молекулярно-генетических маркеров, ассоциированных с различными вариантами клинического течения СГЯ в программе ЭКО.
Материал и методы исследования
В исследование включены 59 пациенток с манифестировавшим клинически значимым СГЯ (средней и тяжелой степени), госпитализированных в стационар для проведения терапии, направленной на купирование симптомов данного осложнения.
Критериями постановки диагноза СГЯ были: увеличение размеров яичников d>6 см, гемоконцентрация (гематокрит ≥40%), ультразвуковые/клинические признаки асцита и/или гидроторакса, гастроинтестинальные явления (тошнота, рвота и/или диарея), гиперкоагуляция, лейкоцитоз >10×109/л, явления абдоминального дискомфорта [3, 8, 9].
Все пациентки проходили программу ЭКО в протоколе с антагонистом гонадотропин-рилизинг-гормона (ГнРГ). При наличии у пациентки факторов риска развития СГЯ, определяемых по клинико-лабораторным маркерам (возраст до 35 лет, индекс массы тела до 29 [17], базальный уровень ФСГ <12 мМЕ/мл, уровень антимюллерового гормона (АМГ) >3 нг/мл [18, 19], число антральных фолликулов >14 [20]), в зависимости от клинической ситуации применялись следующие меры профилактики: стартовая доза рекомбинантного ФСГ не превышала 200 МЕ, производилась замена триггера овуляции на агонист ГнРГ, назначались препараты агонистов допаминовых рецепторов 2-го типа, отменялся перенос эмбрионов в стимулированном цикле, при отмене переноса эмбриона в день трансвагинальной пункции яичников использовали 0,75 мг антагониста ГнРГ с целью блокирования гипоталамо-гипофизарно-яичниковой системы.
На основании особенностей клинического течения разных форм СГЯ пациентки были разделены на 2 группы:
- Группа 1 – пациентки с ранней формой СГЯ (клиническая симптоматика развилась на 3–9-е сутки после введения триггера овуляции) (n=42).
- Группа 2 – пациентки с поздней формой СГЯ (клиническая симптоматика развилась на 9–12-е сутки после введения триггера овуляции) (n=17).
Было проведено исследование широкой панели генетических маркеров, потенциально участвующих в развитии и клинических проявлениях СГЯ. Генотипирование проводили методом полимеразной цепной реакции с анализом кривых плавления модифицированным методом «примыкающих проб» (adjacent probes, kissing probes) с помощью коммерческих тест-систем ООО «НПО ДНК-Технология», Россия. ДНК для генотипирования выделяли из образцов периферической крови, взятой с ЭДТА в качестве антикоагулянта, с помощью комплекта реагентов «Проба-ГС-генетика» ООО «НПО ДНК-Технология», Россия. Определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Статистическая обработка данных выполнена на персональном компьютере с использованием программы IPM SРSS Statistics, версия 22. Все полученные количественные анамнестические, клинические, лабораторные и инструментальные данные обработаны методом вариационной статистики. При нормальном характере распределения данных результаты представлены как среднее ± стандартная ошибка среднего (М±m). При распределении данных, отличных от нормального (значение теста Колмогорова–Смирнова менее 0,05), исследованные количественные показатели представлены в виде Ме (L–H), где Ме – медиана, L – 25-й (нижний) квартиль, H – 75-й (верхний) квартиль, 95% доверительный интервал, качественные данные – в виде частот (%). Для сравнения количественных данных, имеющих распределение, отличное от нормального, применяли метод Манна–Уитни (для 2 групп) для несвязанных совокупностей; критерий χ2 для таблиц сопряженности признаков 2*2 (для сравнения частот встречаемости признаков в анализируемых группах). Статистически значимыми считали отличия при р<0,05 (95% уровень значимости). Анализ неравновесности сцепления проводился с помощью свободно-распространяемого продукта Haploview версии 4.2.
Результаты исследования
Проведена оценка клинико-анамнестических данных и анатомо-функционального состояния репродуктивной системы пациенток, включенных в исследование. Анализ клинико-анамнестических характеристик пациенток двух групп не выявил статистически значимых различий в возрасте (в группе 1 медиана составила 30 лет, интерквартильный интервал 27,0–34,0 года; в группе 2 – 32 года, интерквартильный интервал 29,0–34,0 года; р=0,275), индексе массы тела (медиана – 21,2 и 22,5; р=0,434), среднем возрасте менархе пациенток (13,3±0,19 года и 12,8±0,44 года; р=0,209). Все пациентки имели регулярный менструальный цикл. Средняя длительность менструального цикла у пациенток группы 1 составила 32,5±1,79 дня; в группе 2 – 33,1±2,52 дня, р=0,944.
Первичное бесплодие было выявлено у 71,4% женщин 1-й группы и у 35,3% пациенток 2-й группы; вторичное бесплодие – у 28,6 и 64,7% пациенток, соответственно, что статистически значимо различалось в двух группах (p=0,011). Оценка репродуктивного анамнеза показала, что у 21,4% пациенток 1-й группы с вторичным бесплодием в анамнезе была 1 беременность, у 2,4% – 2 беременности, у 4,8% – 3 и более. Исходами беременности в 14,3% случаев были роды, в 4,8% – искусственное прерывание беременности на раннем сроке, в 7,2% случаев – самопроизвольный выкидыш, в 9,5% была диагностирована внематочная беременность. У 41,2% пациенток 2-й группы с вторичным бесплодием в анамнезе была 1 беременность, у 5,9% – 2 беременности, у 17,7% – 3 и более. Беременности завершились родами в 11,8% случаев, искусственным абортом – в 23,5%, самопроизвольным выкидышем – в 5,9%, в 35,3% случаев была диагностирована внематочная беременность, у 11,8% пациенток – неразвивающаяся беременность. Были выявлены статистически значимые различия между группами в показателях количества беременностей (р=0,007), искусственных прерываний беременностей (р=0,030), неразвивающихся беременностей (р=0,025) и внематочных беременностей (р=0,016).
Средний показатель длительности бесплодия в 1-й группе составил 5,1±0,5 года, во 2-й группе – 4,5±0,8 года; р=0,305. Не выявлено существенных различий в причинах бесплодия между группами. Бесплодие было обусловлено трубно-перитонеальным фактором у 35,7% пациенток 1-й группы, у 52,9% пациенток 2-й группы (р=0,226), мужским – у 59,5% пациенток 1-й и 47,1% пациенток 2-й группы (р=0,386), сочетание факторов наблюдалось у 23,8 и 23,5% женщин (р=0,982), идиопатическое бесплодие отмечались у 21,4 и 11,8% пациенток соответственно (р=0,392). Наружный генитальный эндометриоз как фактор бесплодия отмечался у 7,1% пациенток 1-й группы.
Базальные уровни ФСГ, лютеинизирующего гормона (ЛГ), Е2, АМГ и тиреотропного гормона (ТТГ) на 2–3-й день менструального цикла были сопоставимы в двух группах: ФСГ МЕ/л (медиана 6,8 и 6,7 МЕ/Л, р=0,706), ЛГ МЕ/л (медиана 5,2 и 4,8 МЕ/л, р=0,744), Е2 пмоль/л (медиана 130,0 и 135,0 пмоль/л, р=0,887), АМГ нг/мл (медиана 5,0 и 4,7 нг/мл; р=0,600) и ТТГ мМЕ/л (медиана 2,0 и 2,1 нг/мл; р=0,147).
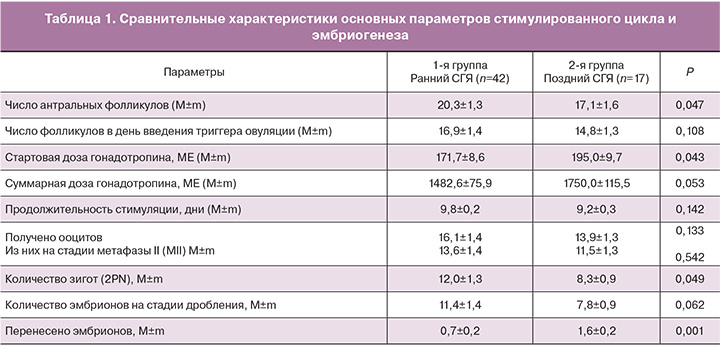
Параметры стимулированного цикла и эмбриогенеза у пациенток обеих групп представлены в табл. 1.
При анализе параметров стимулированного цикла выявлены статистически значимые различия в числе антральных фолликулов (20,3±1,3 и 17,1±1,6; р=0,047); число фолликулов диаметром >11 мм на день введения триггера овуляции несколько различалось в двух группах, однако различия не достигали статистической значимости (16,9±1,4 и 14,8±1,3; р=0,108). Стартовая доза гонадотропина была существенно ниже в 1-й группе (171,7±8,6 против 195,0±9,7; р=0,043). Суммарные дозы гонадотропина были ниже в 1-й группе (1482,6±75,9 против 1750,0±115,5), однако различия были погранично значимы (р=0,053). Количество полученных ооцитов было несколько выше в группе 1 (16,1±1,4 по сравнению с 13,9±1,3; р=0,133). Анализ эмбриологических показателей двух групп не выявил различий в количестве зрелых ооцитов (МII) (13,6±1,4 и 11,5±1,3; р=0,542) и числе эмбрионов на стадии дробления (11,4±1,4 и 7,8±0,9; р=0,062), однако были выявлены различия в количестве зигот (2PN) (12,0±1,3 и 8,3±0,9; р=0,049), а также количестве перенесенных эмбрионов (0,7±0,2 и 1,6±0,2; р=0,001).
Из 59 пациенток с развившимся клинически значимым СГЯ 49 женщин (83%) исходно входили в группу риска развития СГЯ (по АМГ, числу антральных и растущих фолликулов), в связи с чем им были проведены профилактические мероприятия, тогда как 10 (17%) женщин (из них – 4 с ранней формой СГЯ, 6 – с поздней) исходно имели «нормальные» показатели овариального резерва, в связи с чем профилактика СГЯ не проводилась. Профилактические мероприятия, направленные на предотвращение СГЯ в двух группах: замена триггера овуляции на агонист ГнРГ произведена в 17 случаях (40,5%) в 1-й группе и в 1 случае (5,9%) – во 2-й (р=0,010); препараты агонистов допаминовых рецепторов 2-го типа после трансвагинальной пункции назначены 21 пациентке (50,0%) 1-й группы и 10 женщинам (58,8%) – 2-й группы (р=0,542), перенос эмбрионов отменен в 18 (42,9%) случаях в 1-й группе, у 14 (33,3%) пациенток 1-й группы с отменой переноса в день трансвагинальной пункции использовали 0,75 мг антагониста ГнРГ с целью блокирования гипоталамо-гипофизарно-яичниковой системы.
Все пациентки при обращении в стационар имели жалобы на увеличение объема живота, абдоминальный дискомфорт, слабость. Основными жалобами в обеих группах были: головокружение (каждая третья пациентка обеих групп), тошнота и/или диарея (81,6% пациенток 1-й группы и 80% пациенток 2-й группы), задержка мочеиспускания (79,6 и 69% пациенток, соответственно), рвота (10,2% в 1-й группе и 10% – во 2-й группе). Оценка степени тяжести течения синдрома показала, что СГЯ средней степени тяжести имел место у 31 пациентки 1-й группы (73,8%) и у 15 (88,2%) пациенток 2-й группы. СГЯ тяжелой степени имел место у 11 (26,2%) пациенток 1-й группы и 2 (11,8%) пациенток 2-й группы, что было сопоставимо между группами (р=0,230). По данным УЗИ органов малого таза и брюшной полости на момент поступления в стационар у всех пациенток имело место увеличение размеров яичников от 7 до 18 см в диаметре с формированием в них лютеиновых кист, а также визуализировалась свободная жидкость в полости малого таза. У 39 женщин 1-й группы (92,9%) и всех пациенток 2-й группы обнаружена свободная жидкость в брюшной полости в количестве от 800 мл до 3000 мл (р=0,262). Патологических изменений со стороны печени, почек, поджелудочной железы при УЗИ не было выявлено ни у одной пациентки. При УЗИ плевральных полостей свободная жидкость визуализировалась у 8 пациенток 1-й группы (19,0%) и 4 пациенток 2-й группы (23,5%), что статистически значимо не различалось (р=0,701).
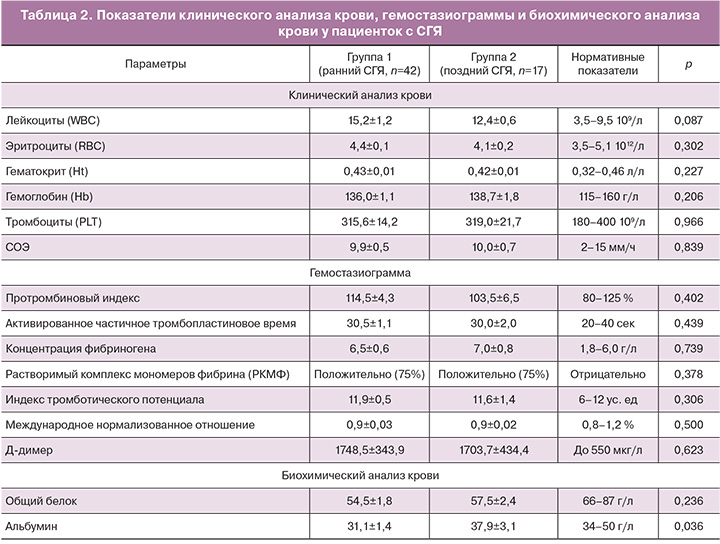
У всех пациенток при поступлении в стационар проводили клинический и биохимический анализ крови, развернутую гемостазиограмму (табл. 2).
Средний показатель уровня гематокрита (>40) не выходил за рамки референсных значений в обеих группах, однако свидетельствовал о наличии гемоконцентрации. Лейкоцитоз отражал выраженность системной воспалительной реакции, характерной для патофизиологии СГЯ [17]. Различий по всем приведенным параметрам клинического анализа крови выявлено не было (р>0,05). По данным гемостазиограммы в обеих группах отмечено увеличение среднего уровня концентрации фибриногена (6,5±0,6 и 7,0±0,8; р=0,739), более частое выявление положительного РКМФ (75% в обеих группах; р=0,378). Обращало на себя внимание увеличение уровня Д-димера, более выраженное в 1-й группе (1748,5±343,9 и 1703,7±434,4), однако, статистически значимо не различавшееся (р=0,623). Вышеперечисленные изменения свидетельствовали о гиперкоагуляции, в связи с чем 37 пациенткам (88,1%) группы 1 и всем пациенткам группы 2 проводилась профилактика тромбоэмболических осложнений препаратами низкомолекулярных гепаринов. В биохимическом анализе крови в обеих группах отмечено уменьшение уровня общего белка (54,5±1,8 и 57,5±2,4; р=0,236). Средний уровень альбумина был значимо меньше в 1-й группе (31,1±1,4 против 37,9±3,1; р=0,036), однако в большинстве случаев данные изменения не требовали внутривенного введения альбумина [21].
Всем пациенткам, госпитализированным в стационар, проводилась инфузионная терапия растворами кристаллоидов с последующим введением коллоидов под контролем клинико-лабораторных параметров. При нормализации уровня гематокрита (<40%) и восстановлении мочеотделения инфузионную терапию прекращали.
При появлении у пациентки прогрессирующего напряженного асцита прибегали к эвакуации асцитической жидкости трансабдоминальным или трансвагинальным доступом под ультразвуковым контролем. Показания для эвакуации асцитической жидкости были у 10 пациенток 1-й группы (23,8%). Из них 4 пациенткам (9,5%) была проведена пункция трансвагинальным доступом, 6 женщинам (14,3%) – трансабдоминальным, с установкой катетера для порционного удаления перитонеального транссудата. Во 2-й группе у 4 женщин (23,5%) была проведена эвакуация асцитической жидкости трансвагинальным доступом.
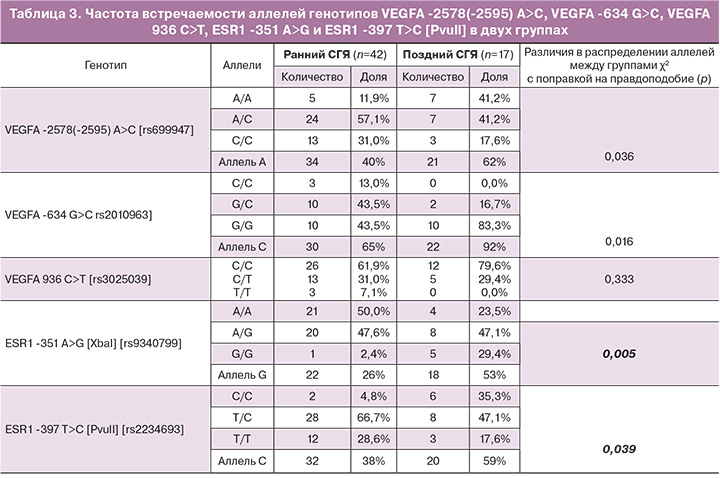
При анализе распределения частоты генотипов исследуемых генов в зависимости от времени начала манифестации СГЯ выявлена статистически значимая ассоциация полиморфизма генов сосудисто-эндотелиального фактора роста А (VEGFA) -2578(-2595) A>C [rs699947], VEGFA -634 G>C [rs2010963], эстрогеновых рецепторов первого типа (ESR1) -351 A>G [XbaI] [rs9340799] и ESR1 -397 T>С [PvuII] [rs2234693] со временем начала клинических проявлений СГЯ (см. табл. 3). По остальным исследованным маркерам не было получено статистически значимых различий в распределении аллелей и генотипов между группами (данные не приводятся).
Из трех исследованных полиморфных локусов в гене VEGFA два (VEGFA -2578(-2595) A>C [rs699947], VEGFA-634 G>C [rs2010963]) продемонстрировали статистически значимую ассоциацию с формой СГЯ. Согласно аутосомно-рецессивной модели генотип VEGFA -634G/G и генотип VEGFA -2578А/А ассоциированы с поздним СГЯ (р=0,016; ОШ=5,87 (95% ДИ 1,22–28,19) и р=0,035; ОШ=2,38 (95% ДИ 1,05–5,38) соответственно). Для третьего локуса (VEGFA 936 C>T [rs3025039]) распределение аллелей и генотипов между группами не различалось. Был проведен анализ сцепления исследуемых локусов гена VEGFA, в ходе которого выявлено выраженное неравновесное сцепление между локусами -2578 A>C и 634 G>C (LOD=14,9, D’=0,97 (0,83–1,0)). Локус VEGFA 936 C>T, расположенный в геноме на некотором удалении наследовался практически независимо (LOD=0,3, D’=0,13 (0,1–0,3). Интересно, что гаплотип AG, который, согласно нашим данным ассоциирован с поздним СГЯ, характеризуется низкой экспрессией гена VEGFA [22]. В то же время полиморфизм 936 C>T, который по данным литературы [23] ассоциирован с изменением уровня VEGFA в плазме крови, не продемонстрировал связи с формой СГЯ.
При исследовании полиморфизма гена ESR1 установлено, что согласно аутосомно-рецессивной модели генотипы -397C/C и -351G/G повышают риск развития поздних форм СГЯ (ОШ=2,32 (95% ДИ 1,03–5,23), р=0,039 и ОШ=3,17 (95% ДИ 1,38–7,28), р=0,005 соответственно). Выраженное неравновесное сцепление полиморфных локусов -397C>T (PvuII) и -351G>A (XbaI) в гене ESR1 хорошо изучено [24]. По-видимому, полиморфизм данного региона связан с изменением чувствительности рецептора к эстрогенам [25], поэтому фенотипические проявления того или иного генотипа во многом зависят от внешних факторов. Наиболее часто встречаются низкоактивный гаплотип TA и высокоактивный гаплотип CG, значительно реже – рекомбинантный гаплотип СА [26]. В нашем исследовании гаплотип CG статистически значимо ассоциирован с развитием поздней формы СГЯ (генотипическая частота составила 52,9 и 26,2% в группе с поздним и ранним СГЯ соответственно, p=0,0054), а гаплотип TA чаще встречался у пациенток с ранним СГЯ (61,9% против 41,2, р=0,04).
Обсуждение
При анализе клинических характеристик пациенток с разными формами СГЯ получены данные, согласующиеся с результатами исследований, опубликованных в мировой литературе. Так, в группе пациенток с ранней формой СГЯ отмечено большее число антральных фолликулов и полученных ооцитов при меньших стартовых и суммарных дозах гонадотропинов. При анализе особенностей клинического течения СГЯ группы не имели принципиальных различий, в том числе и по степени тяжести течения данного осложнения. В настоящем исследовании впервые выявлена ассоциация особенностей клинического течения СГЯ с генотипом пациентки, что может свидетельствовать о принципиальных различиях в молекулярных механизмах развития ранних и поздних форм данного осложнения. Это может объяснить различия в патогенезе двух вышеуказанных форм СГЯ, подразделяя их на две независимые нозологические формы.
Так, вполне объяснима связь полиморфизма VEGFA с развитием и клиническими проявлениями СГЯ. Рядом авторов показано, что полиморфизм гена VEGFA и его рецептора (VEGFR1) ассоциированы с развитием и клиническим течением СГЯ [27, 28].
Также в литературе широко обсуждается связь полиморфизма гена эстрогеновых рецепторов, при этом большее внимание уделяется ESR1. Наиболее изученными полиморфизмами гена ESR1 являются 397С>Т [rs2234693] при расщеплении участка рестриктазой PvuII и 351A>G [rs9340799] при расщеплении рестриктазой XbaI. При изучении СС генотипа PvuII было выявлено, что его носители имеют большее количество фолликулов, зрелых ооцитов, эмбрионов хорошего качества и лучшие показатели наступления беременности [29, 30]. Также Altmae и соавт. (2007) была описана связь другого распространенного полиморфизма гена ESR1 А>G [XbaI] с исходами стимуляции функции яичников: количество зрелых ооцитов и частота наступления беременности были выше у пациенток с генотипом G/G гена ESR1 А>G [XbaI]. Кроме того, у пациенток с данным генотипом отмечается более высокий уровень Е2 в процессе стимуляции суперовуляции [30]. При этом авторами не проводилось сопоставление пациенток с развившимся СГЯ, имеющих разные генотипы ESR1, в зависимости от времени начала манифестации СГЯ.
Заключение
Полученные данные свидетельствуют о возможном различии ранней и поздней форм СГЯ по молекулярным механизмам развития, потенциально определяющим патогенетические особенности течения данного осложнения.
Молекулярно-генетические предикторы, такие как VEGFA и ESR1, могут помочь в оценке предрасположенности конкретной пациентки к той или иной форме СГЯ, что позволит индивидуально подобрать и вовремя применить необходимые меры профилактики (например, отменить перенос эмбриона у пациентки с генотипом риска) и минимизировать риски, связанные с развитием и течением СГЯ.



