Хронический эндометрит (ХЭ) рассматривается как клинико-морфологический воспалительный синдром, характеризующийся комплексом морфофункциональных изменений эндометрия, приводящих к нарушению его циклической трансформации и рецептивности, что клинически проявляется аномальными маточными кровотечениями (АМК) и нарушениями репродуктивной функции. АМК наравне с бесплодием и привычным невынашиванием беременности являются основной причиной обращения женщин к врачу и показанием для дальнейшего углубленного их обследования с целью верификации диагноза ХЭ [1–4].
Ведущая роль в генезе этого полимикробного заболевания принадлежит условло-патогенным аэробно-анаэробных микроорганизмам (УПМ), частота выявления которых достигает 58–77,5% [5, 6].
Редкими возбудителями ХЭ в современных условиях считается вирус простого герпеса, а также другие микроорганизмы, ассоциированные с инфекциями передаваемыми половым путем [4, 7, 8].
Большинство зарубежных исследователей рекомендуют при ХЭ проведение монотерапии антибактериальными (АБ) препаратами [9, 10], в то время как отечественные ученые сходятся во мнении о целесообразности назначения комплексной двухэтапной терапии ХЭ [3, 4, 7, 11, 12]. Первый этап заключается в элиминации инфекционного агента из эндометрия, которая достигается назначением АБ препаратов. Однако вопрос о целесообразности назначении противомикробных препаратов, при отсутствии микроорганизмов или выявление только лактобацилл/бифидобактерий в биоптатах эндометрии дискутируется [7, 11–14].
На втором этапе лечебные мероприятия направлены на восстановление морфофункционального потенциала эндометрия: устранение вторичных повреждений, завершение регенерации, восстановление локальной гемодинамики и активности его рецепторного аппарата. Для этой цели предложены различные варианты гормональной, противовоспалительной (стероидные, нестероидные противовоспалительные средства (НПВС) и др.), метаболической терапии (антиагреганты, антигипоксанты, иммуномодуляторы, фибринолитики и др.) и физиотерапия, в зависимости от степени выраженности процесса [3, 4, 12, 13].
Большинство исследователей судят об успешности проведенной терапии на основании клинической симптоматики и данных ультразвуковой картины эндометрия. В современной литературе представлены немногочисленные исследования, посвященные адекватной оценке эффективности терапии с учетом восстановления морфологической картины эндометрия и лабораторно подтвержденной элиминации инфекционного агента.
Целью нашего исследования стало проведение сравнительной оценки эффективности различных схем лечения ХЭ с учетов эрадикации возбудителя, нормализации морфологической структуры эндометрия и восстановления репродуктивного потенциала.

Материал и методы исследования
В исследование были включены 132 женщины (средний возраст 32,3±5,5 года), обратившиеся в Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова. У 101 пациентки в дальнейшем морфологически был подтвержден диагноз ХЭ, остальные пациентки составили группу сравнения – условно здоровые женщины с эндометрием без признаков воспаления и патологических изменений (n=31). Всем пациенткам, включенным в исследование, проведены общеклинические обследования, ультразвуковое исследование (УЗИ) органов малого таза и исследование микрофлоры биоптатов эндометрия методом полимеразной цепной реакции (ПЦР) в реальном времени. Гистероскопия и диагностическое выскабливание слизистой оболочки полости матки проведена 69 женщинам, пайпель биопсия эндометрия с помощью аспирационной кюретки Pipelle de Cornie – 63. Биопсию эндометрия осуществляли на 7–11-й день менструального цикла всем пациенткам, включенным в исследование, для верификации диагноза ХЭ. Морфологическое исследование биоптатов эндометрия проводили по общепринятой методике. Диагностика ХЭ была основана на выявлении следующих морфологических признаков: наличие воспалительных лимфоплазмоклеточных инфильтратов и очагового фиброза в строме эндометрия, склеротических изменений стенок спиральных сосудов слизистой оболочки полости матки.
После проведенного лечения у пациенток с ХЭ проанализирована динамика следующих показателей: клиническая симптоматика и УЗИ органов малого таза оценены у 101 пациентки; морфологические изменения эндометрия – у 71; анализ эрадикации микробных агентов из полости матки при их наличии до лечения – у 34.
Пациенткам с ХЭ на протяжении 2 месяцев проводилось лечение сочетанием различных групп медикаментозных препаратов:
- АБ препараты (амоксициллин/клавулановая кислота 875/125 × 2 раза в день) назначались в течение 7 дней двух последовательных менструаций.
- Селективные НПВС (целекоксиб 200 мг × 1 раз в день), являющиеся высокоспецифичными ингибиторами циклооксигеназы-2 и обладающие высоким профилем переносимости и безопасности при длительном приеме, назначались в течение двух менструальных циклов.
- Антиагреганты (дипиридамол 25 мг × 3 раза в день) назначались в течение двух менструальных циклов с перерывом в дни менструации для улучшения микроциркуляции в эндометрии.
- Антигипоксанты (экстракт из крови телят – 200 мг × 2 раза в день) назначались в течение двух менструальных циклов для улучшения метаболических процессов и устранения сосудистых нарушений в эндометрии.
В состав комплексной терапии ХЭ у всех пациенток были включены антиагреганты и антигипоксанты, при этом лечение в разных группах больных отличалось за счет противовоспалительного компонента (АБ и/или НПВС). Пациентки с морфологически подтвержденным ХЭ (n=101) были рандомизированы случайным образом на две группы:
- Пациенткам I группы (n=54) согласно рекомендациям СDC 2010 года и экспертному мнению ведущих специалистов ACOG от 2015 проводилась эмпирическая АБ терапия. В дальнейшем после рандомизации проведена стратификация по наличию этиологического возбудителя в эндометрии:
- Iа подгруппа (n=37) – при наличии возбудителя в полости матки;
- Ib подгруппа (n=17) – при отсутствии возбудителя в полости матки.
- Пациенткам II группы (n=47) назначалось персонифицированное лечение на основе детальной оценки микробного пейзажа в эндометрии:
- IIа подгруппа (n=9) – при наличии возбудителя в полости матки пациентки получали комбинированную терапию АБ препаратом и селективным НПВС;
- IIb подгруппа 2 (n=9) – при отсутствии возбудителя в полости матки пациентки получали комбинированную терапию АБ препаратом и селективным НПВС;
- IIс подгруппа (n=24) – при отсутствии возбудителя в полости матки пациентки получали селективные НПВС;
- IId подгруппа (n=5) – при отсутствии возбудителя в полости матки пациентки противовоспалительной терапии не получали.
Контрольная пайпель-биопсия была проведена 71 пациентке, планирующей беременность в ближайшие 6 месяцев, остальные больные, включенные в исследование, вопрос о реализации репродуктивной функции не ставили, контрольная биопсия им не проводилась.
Взятие биоматериала из эндометрия производили по специальной методике с помощью атравматической аспирационной кюретки «Pipelle de Cornier» для исследования микрофлоры методом ПЦР в режиме реального времени по общепринятой методике. Для выделения ДНК использовали наборы «Проба ГС» («ДНК-Технология», Россия). При количественной оценке микробного спектра эндометрия учитывали контроль взятия материала, общую бактериальную массу (ОБМ), массу Lactobacillus spp. и 14 основных групп микроорганизмов, представляющих условно-патогенную флору (стандартная панель фемофлор 16), а также абсолютные патогены: Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis и вирусы: Herpes simplex 1-го и 2-го типов, Cytomegalovirus («ДНК-Технология», Россия). Далее определяли количество геном-эквивалентов микроорганизмов, затем его сравнивали с пороговым значением, при котором результат является диагностически значимым для конкретного микроорганизма.
При статистической обработке полученных результатов для оценки достоверности различий между группами использовали критерий Стьюдента (t) и непараметрический критерий Манна–Уитни для количественных признаков, метод χ2 для сравнения дискретных величин, критерий Мак-Нимара для внутригруппового анализа. Для всех видов анализа статистически значимым считали значения р<0,05. Статистическая обработка проведена с применением пакета прикладных программ Statistica 7.0.
Результаты исследования и обсуждение
В ходе работы у пациенток с ХЭ была проанализирована динамика клинической симптоматики и частоты наступления беременности. Об эффективности лечения судили на основании элиминации инфекционного агента из полости матки и нормализации морфологической картины эндометрия при ХЭ.
Во всех подгруппах (кроме IId подгруппы) отмечены положительные результаты купирования АМК. Наравне с этим у пациенток IIc подгруппы, получавших НПВС с ранее выявленным гипоменструальном синдромом, отмечен доказанный положительный эффект нормализации менструаций (р=0,045). В Ia и IIc подгруппах отмечено купирование синдрома тазовых болей (p=0,014 и p=0,025 соответственно) и дисменореи (p=0,008 и p=0,008 соответственно).
В ходе выполненного исследования нами сформированы два блока пациенток для проведения межгруппового анализа. Первый включал пациенток, получавших одинаковые схемы лечения и различавшихся по наличию или отсутствию в эндометрии возбудителей (Ia и Ib подгруппы, IIa и IIb подгруппы). Второй включал пациенток, получавших разные схемы лечения, но схожих по наличию (Ia и IIa подгруппы) или отсутствию (Ib, IIb, IIc, IId подгруппы) в эндометрии возбудителей.
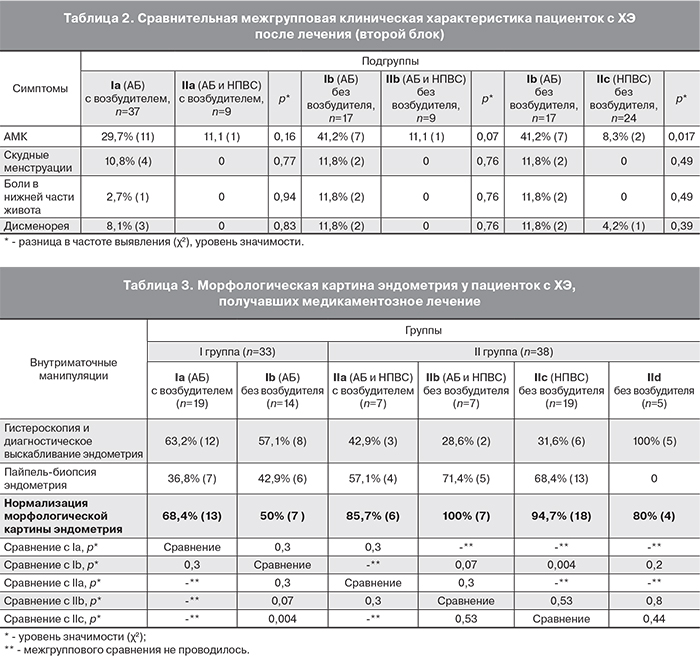
При межгрупповом сравнении пациенток, включенных в первый блок, статистически значимых различий по частоте выявления АМК, скудных менструаций и болевого синдрома не выявлено (Ia и Ib подгруппы, IIa и IIb подгруппы) (табл. 1). То есть эффективность лечения на основе анализа купирования симптоматики при назначении АБ терапии или ее в комплексе с НПВС не зависела от наличия или отсутствия возбудителя в эндометрии.
При межгрупповом сравнении пациенток, включенных во второй блок, при наличии инфекционных агентов в эндометрии (Ia и IIа подгруппы) статистичеcки значимых различий по комплексу предъявляемых жалоб также не выявлено (табл. 2). Однако в группе пациенток без инфекционных агентов в эндометрии при добавлении в схему лечения НПВС к АБ препаратам у пациенток IIb подгруппы по сравнению с женщинами Ib подгруппы (только АБ терапия) отмечена тенденция уменьшения частоты АМК (р=0,07) (табл. 2). При сравнении подгрупп пациенток без возбудителей в эндометрии выявлено статистически значимое отличие уменьшения частоты жалоб на АМК после лечения во IIc подгруппе, получавшей только НПВС, в сравнении с Ib подгруппой (только АБ терапия) (р=0,017) (табл. 2). Таким образом, монотерапия НПВС у пациенток с ХЭ при отсутствии возбудителей в эндометрии вносит более выраженный эффект для купирования клинических проявлений заболевания.
В ходе работы была отмечена положительная динамика ультразвуковых признаков, характерных для ХЭ (гиперэхогенные включения в базальном слое, неоднородность структуры эндометрия, неравномерность толщины эндометрия, внутриматочные синехии и др.) во всех группах, в сравнение с ультразвуковой картиной до лечения (р<0,05).
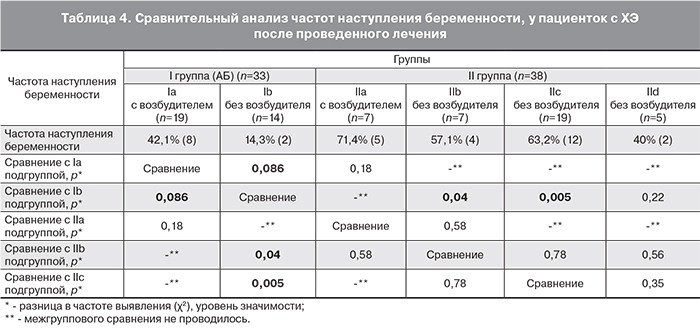
«Золотым» стандартом при постановке диагноза ХЭ является морфологическое исследование, поэтому анализ изменения архитектоники эндометрия, безусловно, считается объективным критерием эффективности проведенных лечебных мероприятий. Данные по нормализации морфологической картины эндометрия после проведения различных схем лечения представлены в табл. 3.
Контрольное исследование морфологической картины эндометрия после лечения проведено 71 пациентке, которые планировали беременность в ближайшие 6 месяцев. Межгрупповой сравнительный анализ пациенток, включенных в первый блок показал, что в 68,4% случаев при выявлении возбудителя в эндометрии АБ терапия способствовала исчезновению основных морфологических признаков ХЭ, а при отсутствии инфекционного агента – в 50% случаях, при этом статистически значимых различий по нормализации морфологической картины эндометрия внутри I группы не выявлено (р=0,3). При анализе исчезновения основных морфологических признаков ХЭ во IIa и IIb подгруппах, получавших АБ терапию в комплексе НПВС, нормализация гистологической картины эндометрия достигнута в 85,7 и 100% случаях соответственно (р=0,3).
Межгрупповой сравнительный анализ пациенток, включенных во второй блок, при наличии инфекционных агентов в эндометрии (Ia и IIa подгруппы) показал, что в 68,4% случаев назначение АБ монотерапии способствовало исчезновению основных морфологических признаков ХЭ, при добавлении к АБ препаратам НПВС данный показатель составил 85,7% (р=0,3). Однако при отсутствии инфекционных агентов в эндометрии (Ib и IIb подгруппы) назначение АБ монотерапии в 50% случаев также способствовало исчезновению основных морфологических признаков ХЭ, при добавлении к АБ препаратам НПВС данный показатель составил 100% (р=0,07). Также при сравнении подгрупп пациенток без возбудителей в эндометрии (Ib и IIc подгруппы) выявлено статистически значимое достижение нормализации морфологической картины эндометрия после лечения, у пациенток получавших монотерапию НПВС – 94,7%, в сравнении с монотерапией АБ препаратами – 50% (р=0,004).
Таким образом, добавление селективных НПВС к АБ терапии или использование монотерапии НПВС приводит к повышению эффективности проводимой терапии при ХЭ при отсутствии инфекционного агента в эндометрии. В современных работах также продемонстрированы данные, что НПВС (целекоксиб) является лекарственным средством, которое активно участвует в подавлении воспалительной реакции в органах репродуктивной системы и тазовой боли [15, 16].
Для анализа динамики изменения представленности микробных агентов, вызывающих ХЭ, были изучены образцы эндометрия от 71 пациентки, планирующей беременность. При этом в Ia подгруппе пациенток (n=19), получавших АБ, в 100% случаях до лечения были выявлены инфекционные агенты, представленные УПМ: Enterobacteriасеае, Streptococcus spp., Staphylococcus spp.,. Eubacterium spp., Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp., Megasphaera spp./Veillonella spp./Dialister spp., Mobiluncus spp./ Corynebacterium spp., Atopobium vaginae, Ureaplasma spp. При этом после лечения в данной подгруппе частота выявлении УПМ (Enterobacteriасеае, Eubacterium spp., Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp.) составила 36,8%. Во IIа подгруппе пациенток (n=7), получавших АБ и селективные НПВС, у всех женщин до лечения также выделены инфекционные агенты, представленные УПМ: Enterobacteriасеае, Eubacterium spp., Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp., Ureaplasma spp. При этом после лечения частота выявления УПМ (Enterobacteriасеае, Gardnerella vaginalis) составила 14,3%. В Ib, IIb, IIc, IId подгруппах инфекционные агенты до лечения не выявлены, поэтому дальнейший анализ микробного спектра после лечения у этих пациенток не проводился.
Статистически значимые различия по эрадикации инфекционных агентов из эндометрия при их выявлении до лечения отмечены в Ia и IIa подгруппах (р=0,0025 и р=0,012 соответственно), в которых пациентки получали терапию АБ средствами или их сочетание с НПВС.
Таким образом, назначение АБ средств вносит весомый вклад в борьбе с возбудителем при его наличии. Отметим, что монотерапия защищенными пенициллинами не обеспечивает полной элиминации всех возбудителей, при этом эррадикация достигнута: Enterobacteriасеае – в 62,5%, Gardnerellа vaginalis/Prevotella bivia/Porphyromonas spp. – в 40%, Eubacterium spp. – в 66,7%. В то же время при использовании АБ совместно с НПВС элиминация УПМ составила: Enterobacteriасеае – 75%, Gardnerellа vaginalis/Prevotella bivia/Porphyromonas spp. – 66,7%, Eubacterium spp. – 100%. Добавление НПВС к АБ препаратам, также вносит положительный вклад при эрадикации инфекционных агентов.
Из 101 пациентки с ХЭ, включенных в исследование, 71 – на момент включения планировала беременность. За время наблюдения беременность наступила у 33 пациенток, из которых у 7 – завершилась самопроизвольным выкидышем на ранних сроках, у 22 женщин – своевременными родами с рождением живых, доношенных детей, у 4 женщин в настоящее время беременность пролонгируется.
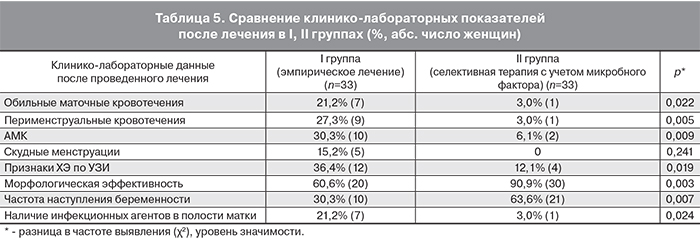
Межгрупповой сравнительный анализ пациенток, включенных в первый блок показал, что внутри I группы при выявлении возбудителя в эндометрии до лечения и при назначении АБ монотерапии беременность наступала в 42,1% случаев, а при отсутствии инфекционного агента – в 14,3% (р=0,086). При анализе IIa и IIb подгрупп, получавших АБ терапию в комплексе с НПВС, частота наступления беременности была достигнута в 71,4 и 57,1% случаев соответственно (р=0,58) (табл. 4).
Межгрупповой сравнительный анализ пациенток, включенных во второй блок, при наличии до лечения инфекционных агентов в эндометрии (Ia и IIa подгруппы) показал, что в 42,1% случаев назначение АБ монотерапии способствовало наступлению беременности, при добавлении к АБ препаратам НПВС данный показатель составил – 71,5% (р=0,18). При отсутствии инфекционных агентов в эндометрии (Ib и IIb подгруппы) назначение АБ монотерапии в 14,3% случаев способствовало наступлению беременности, при добавлении к АБ препаратам НПВС данный показатель составил 57,1% (р=0,04). Также при сравнении подгрупп пациенток без возбудителей в эндометрии (Ib и IIc подгруппы) выявлены статистически значимые различия по наступлению беременности после лечения, у пациенток получавших монотерапию НПВС – 63,2%, в сравнении с монотерапией АБ препаратами – 14,3% (р=0,005) (табл. 4).
Таким образом, добавление в схемы комплексного лечения ХЭ селективных НПВС эффективно блокирует воспалительный процесс в эндометрии и улучшает реализацию репродуктивной функции. В настоящее время НПВС успешно применяются при наличии факторов риска преждевременных родов, при симптомах внутриматочной инфекции, эндометриозе и хронической тазовой боли [17].
Заключение
Несмотря на широкую представленность в современной фармакологии противоспалительных средств, лечение ХЭ представляет методические трудности. Это связано с хронизацией процесса в эндометрии и выраженными иммунологическими нарушениями на локальном уровне. Наравне с этим окончательно не решен вопрос о роли микробного фактора в генезе этой патологии. Исходя из этого в основном всем пациенткам предлагается обязательная эмпирическая АБ терапия, однако проведение последней в ряде случаев не только не улучшает состояние, но и способствует развитию микроэкологических нарушений во влагалище, что приводит к повышению риска восходящей инфекции [10]. Таким образом, профилактическое эмпирическое назначение противомикробных средств при подозрении на ХЭ, не всегда оправданно [10, 18].
В ходе нашей работы было показано, что для выбора адекватной терапии ХЭ в каждом конкретном клиническом случае необходимо обязательное изучение микробного пейзажа слизистой оболочки полости матки с использованием не только культурального метода, но и более удобного для практического здравоохранения метода ПЦР в режиме реального времени.
При наличии инфекционных агентов в эндометрии при морфологически подтвержденном ХЭ, согласно нашим данным, целесообразно назначение комплексной терапии совместно с АБ препаратами с учетом выявленного возбудителя, при этом морфологическая эффективность составляет 68,4%, репродуктивная функция реализуется в 42,1%. Добавление НПВС к АБ достоверно не повышает эти показатели (р<0,05).
При отсутствии инфекционных агентов в полости матки для лечения ХЭ целесообразно в состав комплексного лечения включать НПВС, при этом морфологическая эффективность составляет 94,7%, частота наступления беременности – 63,2%. Добавление АБ препаратов к НПВС достоверно не повышает эффективность лечения (р<0,05).
Таким образом, в ходе работы показано, что селективная терапия с учетом наличия или отсутствия микробного агента в сравнении с эмпирически назначаемым АБ лечением была эффективнее относительно купирования всех клинических вариантов АМК (р=0,009), нормализации морфологической картины эндометрия (р=0,03) и частоты наступления беременности (р=0,007) (табл. 5).



