Исторически подмышечная лимфодиссекция являлась стандартной процедурой при выполнении радикальных операций у больных раком молочной железы (РМЖ). Главным аргументом в пользу лимфодиссекции являются: профилактика аксиллярного рецидива и получение прогностической информации, необходимой для планирования последующей адъювантной терапии [1]. Но, с другой стороны, у больных РМЖ без метастазов в регионарные лимфатические узлы (50–60% от общего числа пациентов) данная хирургическая процедура является не только бесполезной, но и вредной, т.к. увеличивает количество ранних (длительная лимфорея, формирование лимфокисты) и поздних (ограничение движений и отек верхней конечности, нейропатии, болевой синдром) послеоперационных осложнений, частота которых достигает 70% [2, 3].
Для уменьшения объема аксиллярной лимфодиссекции и снижения частоты послеоперационных осложнений в последнее время применяется биопсия сигнальных лимфатических узлов (БСЛУ). Необходимо констатировать, что БСЛУ позволила значительно снизить количество осложнений, но не исключила их полностью. Частота послеоперационных осложнений после применения БСЛУ, по данным разных авторов, может достигать 25% [2, 4]. В исследовании Lucci A. и соавт. парестезии подмышечной области регистрировались у 22% пациенток, повреждение плечевого сплетения – у 0,7% и лимфедема – у 7% соответственно [2]. В другом проспективном мультицентровом исследовании из 431 больной, которой была выполнена БСЛУ, 10,9% пациенток жаловались на парестезии, 8,1% – на боль в области верхней конечности или плеча и 7,7% – на боль в молочной железе [4]. Поэтому в последние годы начинают активно дискутироваться вопросы полного отказа от хирургического вмешательства на регионарных лимфоузлах при отсутствии клинических и инструментальных данных, свидетельствующих об их поражении. Для этого клиницист должен иметь надежные предикторы метастатического поражения регионарных лимфоузлов, в первую очередь основываясь на биологической характеристике первичной опухоли. По данным литературы, наиболее частыми факторами, определяющими метастатическое поражение лимфоузлов у больных РМЖ, являются: возраст пациента, размер опухоли, лимфоваскулярная инвазия, гистологический вариант, мультифокальность, HER2-статус и степень злокачественности (G) [5–8]. Большинство указанных факторов хорошо известны; вместе с тем, необходимо отметить, что большинство исследований носили ретроспективный характер без дополнительной валидации. Более того, величина каждого прогностического фактора широко варьирует, и точность индивидуального прогноза метастатического поражения регионарных лимфоузлов зависит от анализа комбинации этих факторов. В данном случае на помощь приходит номограмма, которая представляет собой прогностический алгоритм, позволяющий оценить вероятность определенного исхода индивидуально для каждого конкретного пациента. Bevilacqua и соавт. из Memorial Sloan-Kettering Cancer Center (MSKCC) разработали математическую модель, предсказывающую вероятность метастатического поражения СЛУ у больных РМЖ. Данная модель базируется на анализе 9 факторов: возраст, размер опухолевого узла, гистологический вариант, локализация опухоли, лимфоваскулярная инвазия, мультифокальность, степень злокачественности, статус эстрогеновых (ЭР) и прогестероновых рецепторов (ПР). Площадь под кривой операционных характеристик (AUC) составила 0,754, что свидетельствует о достаточно хорошей прогностической ценности данной номограммы [9]. Данная номограмма была с успехом перепроверена в Германии [10] и Китае [11].
Желание улучшить MSKCC-номограмму заставляет искать новые прогностические факторы метастатического поражения регионарных лимфоузлов у больных РМЖ и разрабатывать новые математические модели. Сотрудниками Ульяновского государственного университета (УлГУ) была разработана номограмма, предсказывающая метастатическое поражение регионарных лимфатических узлов у больных РМЖ на основе анализа таких факторов, как возраст, размер и локализация опухолевого очага, суммарный балл злокачественности, HER2-статус [12, 13]. Площадь под ROC-кривой (AUC) в разработанной номограмме (УлГУ-номограмме) составила 0,737, что говорит о высокой точности прогнозирования разработанной модели. Настоящая работа посвящена валидации и сравнительному анализу УлГУ-номограммы и MSKCC-номограммы в точности предсказания метастатического поражения регионарных лимфоузлов в одной и той же популяции больных РМЖ.
Материалы и методы
В исследование вошли 420 пациенток с морфологически верифицированным инвазивным РМЖ. Из общего числа пациенток 260 проходили лечение в ГУЗ «Областной клинический онкологический диспансер Ульяновска» (ГУЗ ОКОД) и 160 − в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» (ФГБУ «НМИЦ АГП им. В.И. Кулакова). Критериями исключения стали неоадъювантная терапия и наличие злокачественных новообразований других локализаций до постановки диагноза РМЖ. Всем пациенткам было выполнено хирургическое лечение, 137/420 (32,6%) больных имели по меньшей мере метастаз в один подмышечный лимфатический узел. Средний возраст пациенток составил 58 (51–66) лет. В анализ включены следующие клинико-морфологические и иммуногистохимические параметры: возраст, размер и локализация первичного опухолевого узла, мультицентричность, гистологический вариант (классификация ВОЗ, 2012 г.), степень злокачественности (согласно критериям Ноттингемской классификации), лимфоваскулярная инвазия, суммарный балл злокачественности и результаты, статус ЭР и ПР, HER2-статус. Вероятность поражения аксиллярных лимфоузлов рассчитывалась с помощью MSKCC-номограммы, доступной на сайте http://www.mskcc.org/mskcc/html/15938.cfm, и с использованием УлГУ-номограммы.
Для количественных данных описательной статистики показатели представлены в виде медианы (Me) и межквартильного интервала (IQR). Для оценки значимости различий при сравнении двух групп применялся тест Вилкоксона–Манна–Уитни. За критическое значение для отклонения нулевой гипотезы принималось значение p-value=0,05. Для качественных признаков данные представлены в виде абсолютного числа и доли в процентах (n (%)). Для оценки статистической значимости различий долей применялся тест хи-квадрат (χ2) Пирсона либо, при малом количестве наблюдений, – точный тест Фишера. Критическим значением для отклонения нулевой гипотезы принималось значение p-value=0,05. Обработку данных проводили с использованием статистического пакета R v.3.5.
Результаты и обсуждение
При проведении однофакторного анализа было выявлено, что размер первичного опухолевого узла (р=0,001), лимфоваскулярная инвазия (р<0,001), суммарный балл злокачественности (р<0,001), статус ЭР (р=0,025) и HER2-статус (р=0,032) статистически значимо ассоциированы с метастатическим поражением регионарных лимфатических узлов у больных РМЖ (таблица).
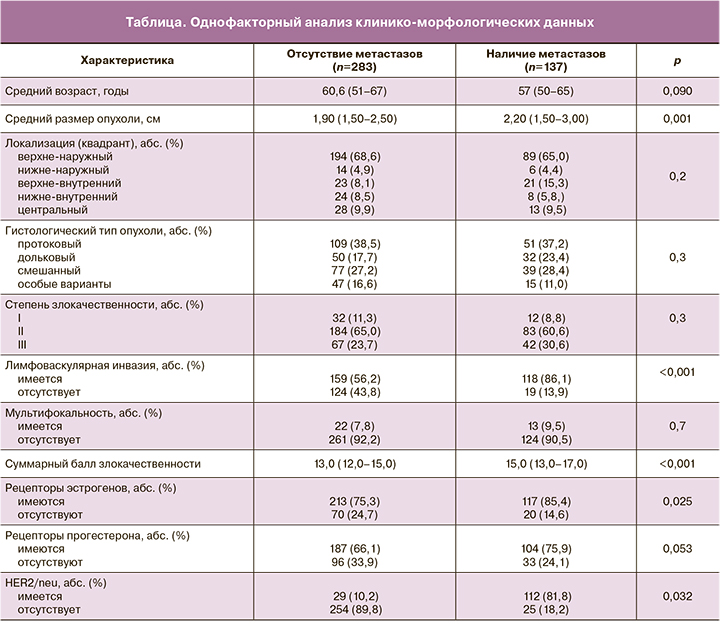
Полученные результаты некоторым образом отличаются от данных, опубликованных в других работах. Американские специалисты из MSKCC в 2004 г. на основании анализа результатов хирургического лечения 702 больных РМЖ продемонстрировали, что только размер опухолевого очага (р=0,001) и лимфоваскулярная инвазия (р=0,003) являются факторами риска метастазирования в регионарные лимфоузлы [14]. В работе немецких авторов под руководством Klar M. (2009) статистически значимыми предикторами метастатического поражения регионарных лимфоузлов у 545 больных РМЖ явились размер опухоли (р<0,001), гистологический вариант (р<0,001), степень злокачественности (р=0,015), HER2-статус (р=0,039), лимфоваскулярная инвазия (р<0,001) и мультифокальность (р=0,007) [10]. В работе китайских ученых в исследование были включены 1227 пациенток с РМЖ, которым была выполнена БСЛУ. Как показали результаты исследования, размер (р<0,001) и локализация (р=0,004) опухоли, степень злокачественности (р<0,001), лимфоваскулярная инвазия (р<0,001), мультифокальность (р<0,001), статус ЭР (р<0,001) и ПР (р=0,002) коррелируют с вероятностью метастатического поражения подмышечных лимфоузлов [11]. Сотрудниками УлГУ был проведен ретроспективный анализ клинико-морфологических данных 529 пациентов с диагнозом РМЖ, проходивших лечение в ГУЗ ОКОД. Двести тридцать пять из 529 пациентов (44,4%) имели по меньшей мере метастаз в один подмышечный лимфатический узел.
Следующим этапом оценивали диагностические характеристики УлГУ-номограммы в сравнении с MSKCC-номограммой, которая на данный момент является общепризнанной среди онкологического сообщества. С этой целью производили оценку вероятности поражения регионарных лимфоузлов у одной и той же популяции пациенток. Для каждой номограммы были построены ROC-кривые (кривые операционных характеристик); интегральная оценка диагностического потенциала номограмм определялась площадью под ROC-кривой (AUC) (рисунок).
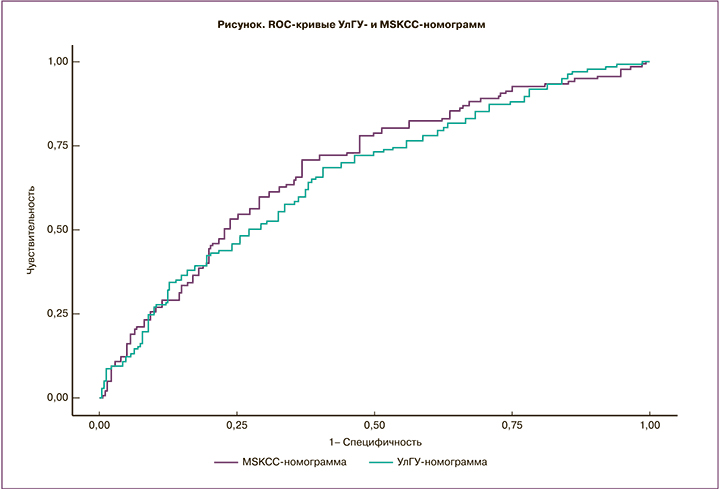
Как видно из представленных данных, AUC ROC для УлГУ-номограммы и MSKCC-номограммы статистически значимо не отличаются. Так, AUC (95% ДИ) для УлГУ-номограммы составила 0,669 (0,6141–0,7239), для MSKCC-номограммы 0,694 (0,6405–0,7479). Оба значения характеризуют соответствующие индексы, как обладающие умеренной предиктивной способностью. Выбор граничного значения для обеих номограмм был обусловлен максимизацией суммы чувствительности и специфичности. Для УлГУ-номограммы граничное значение составило 46, для MSKCC-номограммы – 40. Соответствующие этой граничной точке значения специфичности и чувствительности составили 0,686 и 0,593, 0,708 и 0,632 соответственно. Чувствительность и специфичность обеих номограмм статистически значимо не отличались друг от друга. Вместе с тем необходимо отметить, что УлГУ-номограмма отличается в положительную сторону меньшим количеством анализируемых факторов (5 против 9) и соответственно, большим удобством для пользователей.
Заключение
По результатам настоящего исследования, размер первичного опухолевого узла (р=0,001), лимфоваскулярная инвазия (р<0,001), суммарный балл злокачественности (р<0,001), ЭР-статус (р=0,025) и HER2-статус (р=0,032) являются независимыми факторами риска метастатического поражения регионарных лимфоузлов у больных РМЖ. Валидация в проспективной группе и сравнительный анализ с MSKCC-номограммой продемонстрировали, что УлГУ-номограмма характеризуется равной прогностической ценностью и является более удобной в использовании.



