На заживление раны матки при кесаревом сечении оказывают влияние разные факторы, обусловленные как техникой и ходом операции (условия в которых выполняется операция, расположение разреза, характеристики шовного материала, тип хирургического шва, а также величина кровопотери), течением послеоперационного периода, так и особенностями репарации поврежденных тканей [1].
Одним из важных факторов, влияющих на заживление раны на матке, могут быть исходные морфологические особенности миометрия, которые прямо связаны с процессами формирования рубца. Изучению состоятельности рубца на матке посвящено много работ, однако все они исследовали рубец, как конечный результат заживления [2, 3]. На данном этапе актуальным является изучение морфологических и иммуногистохимических особенностей миометрия, как первичной матрицы, на которой будет происходить формирование рубца. Изучение влияния родовой деятельности и излития околоплодных вод позволит расширить представления о патофизиологических процессах в миометрии и косвенно судить о формировании рубца.
Цель исследования: на основе клинико-морфологического анализа установить значение преждевременного излития околоплодных вод и слабости родовой деятельности как предикторов нарушенной репарации миометрия после кесарева сечения.
Материал и методы исследования
В исследование вошли 129 пациенток, родоразрешенных путем кесарева сечения. Из них 44 были родоразрешены до начала родовой деятельности, 85 пациенток – в 1-м периоде родов. До излития околоплодных вод – 49 женщин, с излитием околоплодных вод – 80. Для проведения морфологического и иммуногистохимического исследования пациенток разделили на 4 группы. В 1-ю группу (Р+В+) вошли пациентки с проведенной операцией кесарева сечения при наличии регулярной родовой деятельности и излитием околоплодных вод. Ко 2-й группе (Р+В-) отнесли наблюдения, которые включали пациенток с родовой деятельностью при целых околоплодных водах. 3-я группа (Р-В-) наблюдений включала в себя проведение кесарева сечение в условиях отсутствия родовой деятельности при целых околоплодных водах. К 4-й группе (Р-В+) отнесены пациентки с преждевременным излитием вод, без родовой деятельности. Для морфологического и иммуногистохимического исследований методом случайной выборки было отобрано 36 наблюдений (по 9 случаев в каждой группе). Исследовали ткань стенки матки, полученную во время операции кесарева сечения из верхнего края раны из области нижнего маточного сегмента, взятых от женщин при первом кесаревом сечении. С этой целью скальпелем иссекали на всю глубину передней стенки матки участок размерами 10×12 мм. Для забора ткани матки у всех пациенток перед операцией было взято информированное согласие.

Материал фиксировали в 10% нейтральном формалине с фосфатным буфером, затем обрабатывали в аппарате гистологической проводки тканей «Pool Scientific instrumens» и заливали в парафин. Затем готовили серийные парафиновые срезы, которые фиксировали на предметные стекла, покрытые адгезивом. Далее срезы депарафинировали и обезвоживали и окрашивали гемотоксилином и эозином, толлудиновым синим и пикрофуксином по Ван Гизону.
 При морфологической оценке миометрия учитывали расположение гладко-мышечных волокон, сосудов, состояние лейомиоцитов, наличие и выраженность отека и дистрофии. Выраженность изменений оценивали полуколичественным способом по балльной шкале от 0 (отсутствие реакции) до 3 (выраженная реакция) баллов.
При морфологической оценке миометрия учитывали расположение гладко-мышечных волокон, сосудов, состояние лейомиоцитов, наличие и выраженность отека и дистрофии. Выраженность изменений оценивали полуколичественным способом по балльной шкале от 0 (отсутствие реакции) до 3 (выраженная реакция) баллов.
Для иммуногистохимического исследования использовали моноклональные антитела следующих маркеров: трансформирующий фактор роста (TGF)β, сосудисто-эндотелиальный фактор роста (VEGF), матриксная металлопротеиназа (MMP)2, тканевой ингибитор металлопротеиназ (TIMP)1, коллаген I и III типов, фактор некроза опухоли (TNF)α и тромбоцитарный фактор роста (PDGF). Выбор маркеров обусловлен тем, что они позволяют выявить нарушение процессов формирования рубца.
Иммуногистохимические реакции проводили на депарафинированных срезах толщиной 3–4 мкм, расположенных на стеклах покрытых APES слоем. Восстановление антигенности тканей проводили при кипячении срезов в ретриверре по стандартной методике (Daco protocols).
Интенсивность реакций с антигенами, локализованными в цитоплазме и на мембранах клеток, оценивали полуколичественным способом по бальной шкале от 0 (отсутствие реакции) до 6 (выраженная реакция) баллов.
 Экспрессию TGFβ, VEGF, TNF, PDGF, MMP2, TIMP1, коллагена I и III типов оценивали по проценту окрашенного экстрацеллюлярного матрикса: 2 балла – до 20%, 4 балла – от 20–40%, 6 баллов – более 40%. Ставились положительные и отрицательные контрольные реакции. Результаты реакции подвергались статистической обработке с использованием непараметрических методов по Манну–Уитни.
Экспрессию TGFβ, VEGF, TNF, PDGF, MMP2, TIMP1, коллагена I и III типов оценивали по проценту окрашенного экстрацеллюлярного матрикса: 2 балла – до 20%, 4 балла – от 20–40%, 6 баллов – более 40%. Ставились положительные и отрицательные контрольные реакции. Результаты реакции подвергались статистической обработке с использованием непараметрических методов по Манну–Уитни.
Результаты исследования
Гистологическое исследование
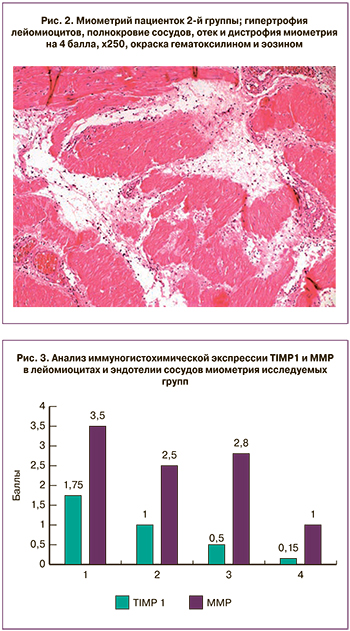
При морфологической оценке миометрия отмечена гипертрофия, отек и дистрофия лейомиоцитов, полнокровие сосудов. Отек и дистрофия были выражены на 1 балл в группе с преждевременным излитием вод, без регулярной родовой деятельности и в группе кесарева сечения до родов и до излития околоплодных вод (табл. 1, рис. 1).
В группе кесарева сечения во время родов при излитии околоплодных вод 1(Р+В+) отек и дистрофия миометрия были более выражены и соответствовали 2 баллам. В этой же группе в миометрии отмечали наличие воспалительного инфильтрата, состоящего из лимфоцитов, лейкоцитов и макрофагов. Во 2-й группе (Р+В-) в миометрии обнаруживали лейомиоциты с набуханием и гидропической дистрофией, а также выраженный отек стромы, которые были оценены в 3 балла. Наибольшие значения отека и дистрофии лейомиоцитов имели место в родах с целым плодным пузырем. (рис. 2).
Иммуногистохимическое исследование
Как показали полученные результаты, TGFβ отсутствовал во всех группах. VEGF экспрессировался в виде коричневого окрашивания в эндотелии сосудов и лейомиоцитах. Маркер находился в минимальной концентрации 0,1 балла в группе кесарева сечения с преждевременным излитием вод, без регулярной родовой деятельности 4(Р-В+), в остальных группах он был равен 1 баллу .
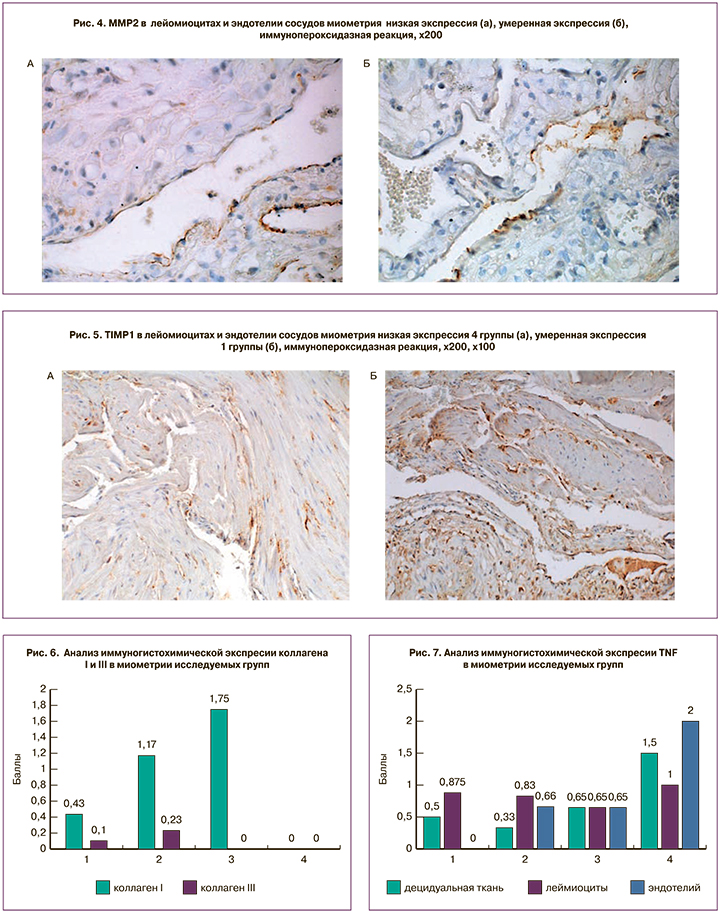
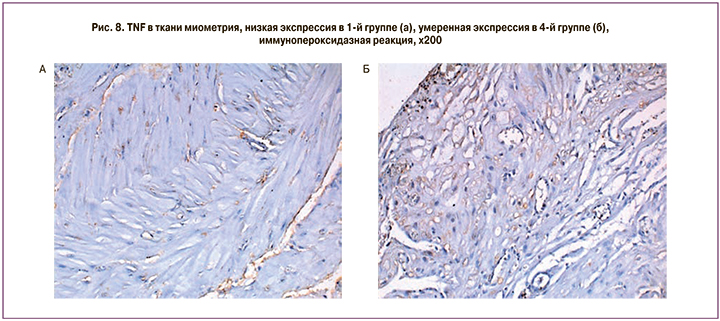
Проведенное нами исследование показало, что MMP2 и TIMP1 экспрессировались в минимальных концентрациях в лейомиоцитах и эндотелии сосудов миометрия в группе с преждевременным излитием вод, без регулярной родовой деятельности 4(Р-В+) (рис. 3).
При исследовании соотношения уровня экспрессии MMP2/TIMP1 (рис. 4) максимальные значения были выявлены в группе без схваток и излития вод (Р-В-), в остальных группах – средние соотношение (рис. 5).
Коллаген I и III экспрессировался в виде коричневого окрашивания в экстрацеллюлярном матриксе, отсутствовал в группе с преждевременным излитием вод, а в остальных обнаруживался в незначительном количестве (рис. 6).
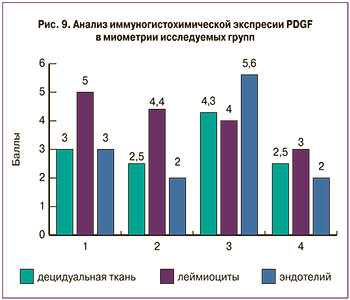
TNF (рис. 7) экспрессировался в виде коричневого окрашивания в децидуальной ткани, лейомиоцитах, эндотелии сосудов. В группе кесарева сечения с преждевременным излитием вод, без регулярной родовой деятельности 4(Р-В+) накопление TNF было максимальным, 1 и 2 балла соответственно (рис. 8).
PDGF экспрессировался в виде коричневого окрашивания в децидуальной ткани, лейомиоцитах, эндотелии сосудов. Полученные данные показали, что маркер PDGF выявлялся в минимальном количестве в лейомиоцитах группы с преждевременным излитием вод и без схваток (2–4 балла), тогда как в остальных группах его экспрессия была высокой (рис. 9).
 Обсуждение
Обсуждение
Одним из критериев, характеризующих заживление раны стенки матки, является морфофункциональная состоятельность рубца. Заживление операционной раны представляет собой сложный процесс репарации ткани, который включает в себя воспалительную реакцию, ангиогенез, формирование и ремоделирование экстрацеллюлярного матрикса, которые в конечном итоге приводят к частичной реконструкции стенки [4]. В этом каскаде событий важную роль играют факторы роста, которые выделяются из сыворотки после ранения кровеносных сосудов и дегрануляции тромбоцитов, нейтрофилов, моноцитов, лимфоцитов, фибробластов и тканеспецифичных клеток [5]. По данным А.Н. Стрижакова [6], увеличение безводного промежутка более 6 часов приводит к выраженной дистрофии и фрагментации мышечных волокон, к отеку и разволокнению соединительной ткани, что способствует вторичному заживлению раны на матке и формированию соединительнотканного рубца. Полноценный рубец характеризовался упорядоченным расположением мышечных волокон без явлений дистрофии, отсутствием значительного количества соединительной ткани и чрезмерной васкуляризации. Хаотичное расположение мышечных волокон, клетки с мелкими сморщенными ядрами, гиповаскуляризация, избыточный рост грубой гиалинизированной, соединительной ткани с лимфоцитарной инфильтрацией, склероз и запустевание артерий и венул были признаками неполноценного рубца [2]. По нашим данным, при разделении пациенток на группы в зависимости от наличия родовой деятельности и излития околоплодных вод были выявлены отличительные особенности для каждой из групп. В группе с регулярной родовой деятельностью и отсутствием излития вод (Р+В-) в миометрии обнаруживали отек стромы, лейомиоциты с набуханием и гидропической дистрофией, выраженные на 3 балла, в группе с преждевременным излитием вод и без схваток (Р-В+) – отек стромы и дистрофия лейомиоцитов были минимально выражены.
Наибольшего значения данные показатели достигали в группе пациенток вступивших в роды с целым плодным пузырем, что наиболее вероятно является характерными признаками протекающей родовой деятельности.

Наименее выраженные явления отека стромы миометрия и дистрофии лейомиоцитов отмечены в группе излития околоплодных вод без родовой деятельности; часть этой группы составили женщины с излитием околоплодных вод при «незрелой» шейке матки, что, по-видимому, может быть расценено как неготовность миометрия к родам.
В процессе ремоделирования ткани и образования рубца была показана роль TGF-β и его изоформы (TGF-β1 и β3), фактора роста соединительной ткани (CTGF), основного фактора роста фибробластов (bFGF), PDGF,VEGF и TNF-α [7, 8]. S. Werner в лабораторных условиях и на биологических моделях показал зависимость отложения в ране коллагена от факторов роста, а также количественные изменения факторов роста при нормальном или патологическом заживлении [5]. F. Pollio исследовал экспрессию факторов роста в миометрии у женщин с элективным кесаревым сечением, в сравнении с группой женщин с наличием состоятельного или несостоятельного рубца на матке, и показал отсутствие разницы между пациентками без рубца на матке и пациентами с состоятельным рубцом в нижнем маточном сегменте. При несостоятельности рубца на матке в нижнем маточном сегменте обнаружено высокое содержание коллагена, уменьшение TGF-β, снижение или отсутствие TGF-β3, снижение CTGF, увеличение bFGF, а также небольшое повышение PDGF,VEGF и TNF. Очаговое содержание ламинина визуализировалось в эндотелиоцитах и в отдельных гладкомышечных клетках. Коллаген IV типа в зоне гиалиноза отсутствовал и экспрессировался в области рубца. Виментин при несостоятельности рубца отсутствует, либо имеется его незначительное количество в эндотелии сосудов, в единичных фибробластах и миоцитах. В зоне неполноценного рубца экспрессия десмина отсутствует. Эти данные позволяют предположить, что несостоятельность рубца на матке может быть связана с нарушением процессов его формирования [9]. При анализе иммуногистохимических особенностей миометрия нами определено увеличение экспрессии MMP2 (3,5 балла) и TIMP (1,75 балла) в группе с продолжительным I периодом родов и излитием вод (1-я группа). Низкие показатели соотношения указывают на процессы деградации экстрацеллюлярного матрикса, которые могут быть следствием воспаления, происходящего в ткани, что приводит к нарушению синтеза коллагена и впоследствии мешает формированию полноценного рубца. С увеличением величины безводного промежутка и отсутствием схваток возрастала экспрессия TNF-α (1,5 балла), что указывает на воспалительные процессы происходящие в ткани миометрия, а снижение экспрессии PDGF (2,5 балла) указывает на нарушение васкуляризации в зоне будущей рубцовой ткани.
При оценке изменения содержания факторов роста было выявлено, что наибольшие изменения имели место у женщин с излитием околоплодных вод и без родовой деятельности. Так, было обнаружено снижение содержания VEGF, PDGF, а также MMP2 и TIMP1, в тоже время имело место повышение концентрации TNF. При этом высокий уровень TNF указывает на выраженность воспалительного процесса, низкий уровень PDGF – на сниженную пролиферацию фибробластов и формирования экстрацеллюлярного матрикса.
Оценка факторов риска течения послеоперационного периода, данных микроскопического и иммуногистохимического исследования миометрия позволяет определить связь клинических и морфологических данных для прогнозирования характера заживления раны на матке и формирования рубца (табл. 2). Полученные данные могут указывать на относительно меньший репаративный потенциал миометрия и более высокую готовность к воспалительной реакции в группе женщин с проведением операции кесарева сечения при преждевременном излитии околоплодных вод с отсутствующей родовой деятельностью.
Заключение
Таким образом, в результате проведения морфологического и иммуногистохимического анализа выявлены различия в состоянии миометрия в зависимости от типичных клинических факторов: излития околоплодных вод и наличия родовой деятельности. Заживление раны происходит под влиянием факторов роста и при различных патологических состояниях соотношение уровня экспрессии факторов роста может изменяться. Снижение экспрессии VEGF, MMP2, TIMP, PDGF и увеличение экспрессии TNF в группе с преждевременным излитием вод и отсутствием схваток (Р-В+), указывает на выраженные процессы воспаления и нарушения репарации в миометрии при увеличении безводного промежутка в отсутствие схваток, что позволяет отнести этих женщин в группу риска формирования несостоятельного рубца.



