Интенсивное развитие молекулярной медицины в течение последних десятилетий позволило пересмотреть классические взгляды на патогенез акушерской патологии и доказать, что многие осложнения гестационного периода базируются на «трех китах»: нарушении гемостаза, эндотелиопатии и синдроме системного воспалительного ответа, представляющие собой универсальный патофизиологический механизм в котором одно звено запускает другое [1, 2].
Одним из весьма распространенных в последние годы симптомокомплексов, способствующих формированию акушерских осложнений беременности является метаболический синдром (МС) [3, 4]. Распространенность МС среди беременных составляет от 5 до 20% [5–8]. Скрытая гипергликемия при метаболическом синдроме приводит к преобладанию регулирующего влияния на организм симпатоадреналовой системы [9], активации ренин-ангиотензин-альдостероновой системы [10–13] и определенной перестройке в работе гипоталамо-гипофизарно-надпочечниковой системы [14, 15]. Это способствует развитию системной эндотелиопатии и стойкой вазоконстрикции, тем самым нарушая два взаимосвязанных процесса – ангиогенез (неоваскуляризация из предшествующих кровеносных сосудов в ответ на гипоксию) и вазодилятацию, которые необходимы для морфогенеза плацентарного «дерева» и растущих потребностей плода [16–19].
Функциональные процессы в плаценте являются уникальным индикатором любого нарушения метаболизма в организме беременной. Оптимальная плацентарная перфузия требует контролируемой инвазии трофобласта и глубокого его проникновения в проксимальные участки спиральных артерий матки [20–22]. Снижение напряжения кислорода в крови, которое возникает на фоне неконтролируемой вазодилатации у пациенток с МС, вызывает гипоксию тканей, что приводит к поверхностной инвазии трофобласта [23, 24], ограничивающейся децидуальным сегментом спиральных артерий и, как следствие, они сохраняют свою высокую резистентность [25]. В результате формирующаяся гипоксическая дизрегуляция плацентарного ангиогенеза, обусловленная метаболической эндотелиопатией, приводит к различным осложнениям, в частности таким тяжелым, как гипотрофия плода, преэклампсия (ПЭ), вплоть до тяжелой формы эклампсии и в итоге к репродуктивным потерям [10, 23].
Таким образом, представляет значительный интерес изучение особенности формирования акушерской патологии на фоне МС.
Цель исследования: изучение особенностей эффекторных гормонов периферических желез внутренней секреции (адреналина, норадреналина, кортизола, ангиотензина-II, эндотелина-1) у женщин с МС и их влияние на формирование акушерской патологии.
Материал и методы исследования
Для решения поставленной цели в зависимости от характера метаболизма были сформированы, сопоставимые по численности клинические группы: I группа (основная) – 150 беременных с МС и II группа (контрольная) – 143 беременных с нормальным метаболизмом. В зависимости от клинического течения беременности были сформированы следующие подгруппы: беременные с МС без акушерской патологии – 58 пациенток; беременные с МС и ПЭ – 45 женщин и беременные с МС и задержкой роста плода (ЗРП) – 47 пациенток. В контрольной группе: беременные с нормальным метаболизмом без акушерской патологии – 56; беременные с нормальным метаболизмом и ПЭ – 44 пациентки; беременные с нормальным метаболизмом и ЗРП– 43 пациентки. Деление на подгруппы в зависимости от акушерских осложнений осуществлялось на основании данных ультразвукового исследования (УЗИ), критериев диагностики ПЭ (Российские клинические рекомендации).
Рандомизация выборки осуществлялась при помощи метода «Монета», суть которого состоит в равновероятности выпадения «орла» и «решки» в процессе статистического «подбрасывания» при нулевой гипотезе р=0,50.
В исследование были включены первобеременные женщины в возрасте от 18 до 28 лет с одноплодной беременностью.
Критерии включения в группу «Метаболический синдром» основались на критериях ВОЗ (1999): основной критерий: индекс резистентности HOMA (НОМА-IR) (≥2,77) + ≥2 из далее перечисленных: уровень глюкозы в плазме крови натощак ≥5,1 ммоль/л; дополнительные критерии: уровень триглицеридов ≥1,7 ммоль/л; уровень липопротеидов высокой плотности (ЛПВП) <1,0 ммоль/л; липопротеидов низкой плотности (ЛПНП)>3,0 ммоль/л; уровень экскреции альбумина с мочой>20 мкг/мин; АД>140/90 мм рт. ст. отношение окружности талии к окружности бедер для женщин в I триместре беременности (ОТ/ОБ) >0,85. В группу контроля вошли соматически здоровые беременные без признаков МС. Характер исследования – лонгитюдное, в динамике 1-го, 2-го и 3-го триместров.
Всем беременным по месту жительства проводились общепринятые лабораторные методы исследования, предусмотренные приказом Минздрава России от 1 ноября 2012 года № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)».
Определение содержания исследуемых факторов в сыворотке крови пациентов осуществляли методом иммуноферментного анализа 1 раз в триместр, обсчет результатов проводили на фотометре TECANSUNRISE (Австрия): эндотелин-1 (ммоль/мл) наборами фирмы BIOMEDICA GRUPPE (Германия), кортизол (мкг/дл) наборами фирмы «DBC» (Канада), ангиотензин II (пг/мл) наборами фирмы RayBio (Европа), адреналин и норадреналин (нг/мл) наборами фирмы IBL (Германия).
Забор венозной крови у беременных с акушерской патологией (ЗРП и ПЭ) проводился до начала терапии.
Все исследования осуществлялись после получения информированного согласия пациентки на проведение дополнительных методов исследования и лечения, а также заключения «Этического комитета».
Для анализа данных использовались процедуры описательной статистики, с помощью которых находились и оценивались значения медианы и интерквартильного размаха (25%, 75%). Статистическая значимость полученных результатов рассчитывалась при доверительной вероятности 95%. Для сравнения межгрупповых различий использовался непараметрический критерий Вилкоксона для независимых групп. Уровень значимости устанавливался равным 0,05 и менее.
Результаты исследования и их обсуждение
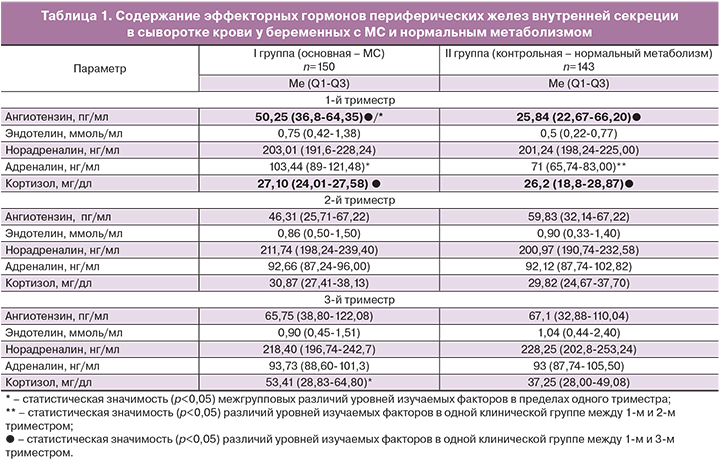
На первом этапе исследования проведена оценка содержания в венозной крови изучаемых вазоактивных молекул (эндотелин-1, кортизол, ангиотензин-II, адреналин и норадреналин) у пациенток групп сравнения в зависимости от особенностей метаболизма.
По результатам проведенного анализа установлено, что в группе беременных с МС содержание ангиотензина-II и кортизола в 3-м триместре значимо выше на 24% (р=0,0178) и 49% (0,0033) соответственно по отношению к их уровням в 1-м триместре.
У беременных с нормальным метаболизмом при анализе изучаемых гормонов во 2-м триместре было получено значимое увеличение на 23% (р=0,0421) концентрации адреналина, а в 3-м триместре – кортизола на 30% (0,0019) и на 62% – ангиотензина-II, в сравнении с их концентрациями в 1-м триместре.
При межгрупповой оценке исследуемых гормонов у беременных с МС имелось статистическое повышение в 1-м триместре уровня ангиотензина-II на 49% (р=0,0317) и адреналина на 31% (р=0,0046), а в 3-м триместре – кортизола на 30% (0,0002), в сравнении с их значениями у обследуемых группы контроля (табл. 1).
Еще в 1961 году Assali и Westersten показали, что при нормально протекающей беременности к родам отмечается двукратное увеличение ангиотензина-II, но при этом имеется толерантность к его вазопрессорным эффектам. По их мнению, этот эффект объясняется наличием высоких концентраций прогестерона и простациклинов, которые поддерживают сосудистый нормотонус, а также тем, что рецепторы к ангиотензину-II находятся в мономерном состоянии и инактивируются активными формами кислорода, в отличие от беременности осложненной ПЭ, когда они имеют димерное состояние [2].
Проведенное исследование подтвердило статистически значимое нарастание концентраций ангиотензина-II у беременных с нормальным метаболизмом, но при этом в группе с МС, начиная уже с 1-го триместра, были выявлены статистически значимо более высокие значения изучаемого гормона, превышающие в 1,9 раза его уровень в группе контроля.
Таким образом, были выявлены более высокие уровни адреналина и ангиотензина-II в 1-м триместре и кортизола в 3-м триместре у беременных с МС, что свидетельствует об усилении регулирующего влияния симпато-адреналовой системы, а также о большей стрессированности материнского организма в условиях метаболических нарушений по мере приближения срока родов.
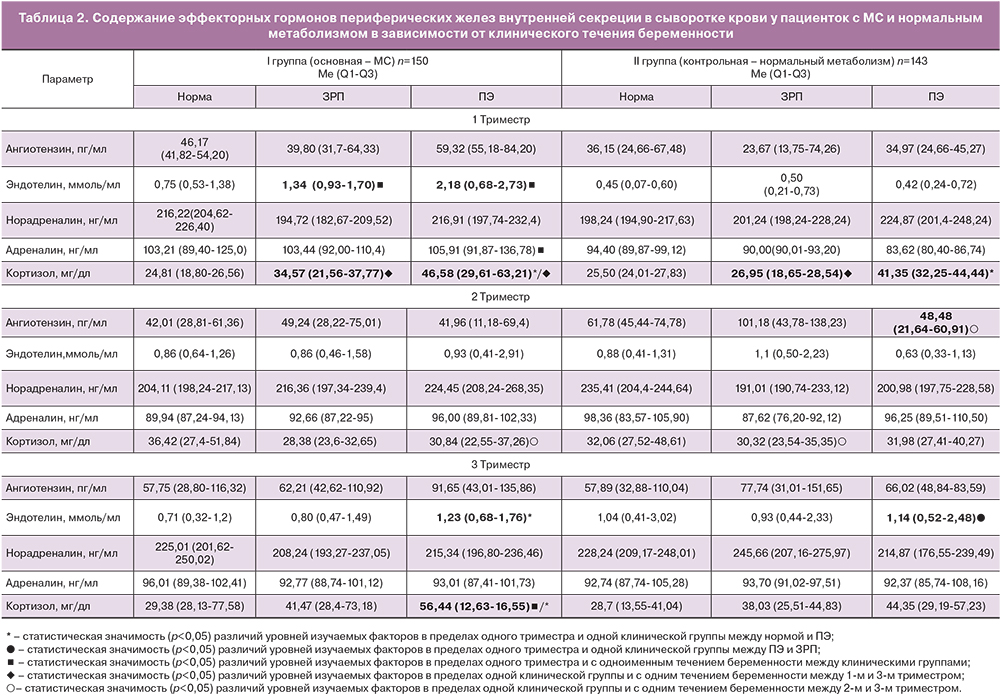
На втором этапе исследования было решено оценить содержание вазоактивных молекул у беременных в зависимости от характера акушерской патологии. При внутригрупповом сравнении изучаемых эффекторных гормонов у беременных с МС в случае ЗРП и ПЭ было установлено статистически значимое повышение к 3-му триместру уровня кортизола на 32% (р=0,0148) и 45% (р=0,0232) соответственно, а также его значимое повышение в группе с ЗРП у пациенток с нормальным метаболизмом в 1,4 раза (р=0,0456). Также обнаружено статистически значимое увеличение уровня кортизола у женщин с ПЭ в 1-м триместре – в 1,9 раза (р=0,0327) и в 3-м триместре – в 1,6 раза (р=0,0217), по сравнению с женщинами без акушерских осложнений.
При анализе экспрессии сосудистых факторов роста в основной группе было установлено статистически значимое увеличение эндотелина-1 в 1,6 раза (р=0,0211) в 3-м триместре у беременных с ПЭ по сравнению с пациентками с физиологической беременностью.
В группе контроля только в 1-м триместре отмечалось значимое увеличение в 1,6 раза (р=0,0414) уровня кортизола у пациенток с ПЭ по сравнению с неосложненным течением беременности. При этом в 3-м триместре выявлено значимое повышение энотелина-1 в 1,2 раза (р=0,0138) у беременных с ПЭ по сравнению с группой с ЗРП (табл. 2).
Межгрупповой анализ изучаемых вазопрессорных молекул показал, что у беременных основной группы имелись значимо более высокие уровни в 1-м триместре эндотелина-1 при беременности, осложненной ЗРП и ПЭ на 62% (р=0,0036) и 80% (р=0,0285) соответственно и адреналина на 21% (р=0,0117) в группе с ПЭ, а также в 3-м триместре у беременных с ПЭ – кортизола на 21% (р=0,0412) в отличие от пациенток с нормальным метаболизмом.
По данным ряда авторов основным источником эндотелина-1 во время беременности является эндотелий сосудов фетоплацентарного комплекса, который прогрессивно увеличивается с ранних сроков и имеет два пика концентрации в 16 и 28 недель и зависит от стадий старения плаценты [2, 26], что согласуется с нашими данными. Однако также как и с адреналином, уже с 1-го триместра отмечается его значимое повышение у беременных с МС в 5,1 раза (р=0,0247) в группе с ПЭ и в 2,6 раза (р=0,0034) в группе с ЗРП относительно его значений у беременных с нормальным метаболизмом и аналогичными осложнениями. Поэтому сама по себе беременность является фоном для активного синтеза данного гормона, а присутствие у беременных метаболических нарушений (углеводных нарушений) способствует более интенсивному его образованию и соответственно более частому формированию осложненного течения беременности. При этом с введением градации «клиническое течение беременности» и разделением групп в зависимости от выявленного осложнения беременности не было получено статистически значимых различий в содержании ангиотензина-II и норадреналина.
Таким образом, в результате проведенного исследования выявлено статистически значимое увеличение уровня эндотелина-1, адреналина и кортизола у беременных с МС, более выраженное у женщин с ПЭ. Полученные данные свидетельствуют о том, что при метаболических нарушениях повышение уровня вазопрессорных и стресс-либерирующих гормонов и медиаторов способствуют формированию вазоспастических процессов в женском организме, нарушению кровотока в маточно-плацентарно-плодовом комплексе и потенцируют развитие ПЭ и ЗРП.
Заключение
По результатам проведенного исследования установлено, что эндотелиальная дисфункция и избыточная активация некоторых медиаторов и гормонов симпатоадреналовой системы при МС наиболее характерны для женщин с ПЭ по сравнению с ЗРП, что, по-видимому, обусловлено более выраженным нарушением механизмов гормонального и рецепторного регулирования, преобладанием вазоспастических процессов на фоне центро-периферической дезинтеграции у данного контингента женщин.



