Преждевременная недостаточность яичников (ПНЯ) – клинико-биохимический симптомокомплекс, для которого характерны четкие возрастные и гормональные параметры: возраст до 40 лет, наличие олигоменореи или вторичной аменореи в течение 4 и более месяцев, уровень фолликулостимулирующего гормона (ФСГ) ≥25 МЕ/л при 2 определениях с интервалом не менее 1 месяца [1]. Частота ПНЯ составляет 1 на 250 случаев среди женщин в возрасте 35 лет и 1 на 100 – в возрасте 40 лет [2].
Согласно Фремингемской модели, менопауза является независимым фактором риска развития сердечно-сосудистых заболеваний (ССЗ) [3]. В настоящее время дискутируется вопрос о том, что лежит в основе метаболических изменений, приводящих к повышению риска кардиоваскулярных заболеваний – дефицит половых гормонов или хронологическое старение организма в целом [4]. Согласно данным большинства эпидемиологических исследований считалось, что высокие уровни общего холестерина (ХС), липопротеинов низкой плотности (ЛПНП) и триглицеридов (ТГ) связаны с возрастным старением. Однако результаты исследования SWAN (The Study of Women’s Health Across the Nation) в 2009 году показали, что дислипидемия, включая повышение уровня аполипопротеина В (апо В), не зависела от возраста или этнической принадлежности обследуемой популяции и была обусловлена эстрогенным дефицитом, в то время как повышение артериального давления (АД) и веса прямо пропорционально зависело от хронологического старения [5, 6]. В ранее проведенных исследованиях показано, что у женщин с отсроченным возрастом наступления менопаузы менее выражены признаки атеросклероза, что подтверждается более редким кальцинированием аорты [7, 8].
По данным Британского фонда по изучению проблем сердца ишемическая болезнь (ИБС) является наиболее распространенной причиной смерти среди женщин в возрасте старше 60 лет и крайне редко встречается до этого возраста [9]. Известно, что смертность от ИБС снижается на 2% на каждый год повышения возраста выключения функции яичников по отношению к среднему возрасту наступления физиологической менопаузы. Таким образом, у женщин с дефицитом половых гормонов в возрасте до 40 лет риск смертности от ИБС повышается на 20% [10]. Согласно научным исследованиям, проведенным в США, женщины с ПНЯ и синдромом Шерешевского–Тернера, не получающие заместительную гормональную терапию (ЗГТ), также составляют группу риска по развитию ИБС [11–13].
«Золотым стандартом» оценки риска развития ССЗ являются крупномасштабные эпидемиологические исследования, однако они крайне дорогостоящи и продолжительны. В связи с этим широкое распространение в клинической медицине получил метод анализа промежуточных или суррогатных маркеров риска развития ССЗ. Термин «суррогатные маркеры» означает важные биохимические или функциональные параметры, которые свидетельствуют о неблагоприятной ситуации в организме (например, повышенный уровень липидов, глюкозы, толщины интима-медиа сонной артерии и др.). Они не позволяют судить об исходе данного заболевания в целом, однако их рост является основанием для проведения лечебно-профилактических мероприятий.
Цель исследования: изучить наличие связи между гормональными показателями, характерными для ПНЯ, и предикторами развития ССЗ (биохимическими и функциональными маркерами эндотелиальной дисфункции).
Материал и методы исследования
В основную группу исследования включены 85 женщин с ПНЯ в возрасте от 18 до 40 лет (средний возраст 33,1±5,2 года), индексом массы тела (ИМТ) 23,2±4,0 кг/м2. Критерием включения было наличие ПНЯ, подтвержденной на основании клинико-лабораторных результатов (согласно Европейским рекомендациям по ведению женщин с ПНЯ [1]) в возрасте от 18 до 40 лет (средний возраст 33,1±0,6 года), индекс массы тела (ИМТ) 23,2±0,5 кг/м2. В группу контроля включены 85 здоровых женщин с регулярным менструальным циклом, уровнем ФСГ <12МЕ/мл, сопоставимых с группой ПНЯ по возрасту и ИМТ (средний возраст 31,9±4,6 года, ИМТ 22,7±2,9 кг/м2).
Критериями исключения для участия в исследовании явились: первичная гипергонадотропная аменорея, ятрогенные причины гипергонадотропной аменореи (операции на яичниках, химио-, лучевая терапия в анамнезе), тяжелые наследственные заболевания (галактоземия, блефарофимоз), наличие онкологических заболеваний, тромбозов в анамнезе, нарушение функции печени и почек, сахарный диабет, метаболический синдром.
Артериальная гипертензия определялась как повышение систолического АД более 140 мм рт. ст. и диастолического – более 90 мм рт. ст. или выявление лиц, принимавших на момент исследования гипотензивную терапию. Всем женщинам с ПНЯ после первичного обследования, при отсутствии противопоказаний, было рекомендовано проведение ЗГТ в циклическом режиме (первые 14 дней 2 мг эстрадиола, затем 14 дней 2 мг эстрадиола в сочетании с 10 мг дидрогестерона) в течение 12 месяцев с последующим определением гормонального статуса, уровней биохимических и функциональных маркеров эндотелиальной дисфункции.
Исследование было одобрено Этическим комитетом ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России.
Определение уровня фолликулостимулирующего гормона (ФСГ), эстрадиола (E2) проводилось электрохемилюминесцентным методом на автоматических анализаторах Immulite 2000, Immulite 1000 (Siemens, США) с использованием реагентов тех же фирм. Полученные результаты уровней гормонов интерпретировали согласно нормативным показателям лаборатории.
Липидный профиль крови оценивали по основным показателям, характеризующим обмен и транспорт липидов: общий холестерин (ХС), триглицериды (ТГ), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП), коэффициент атерогенности (КА), аполипопротеины А1 и В (апоА1 и АпоВ). Всем участницам исследования также определяли уровень мочевой кислоты, глюкозы и высокочувствительного С-реактивного белка (вчСРБ). Забор крови для исследования выполняли из локтевой вены натощак (спустя 12 ч после приема пищи) во время ранней пролиферативной фазы менструального цикла. Исследование проводили с помощью спектрофотометрического и турбидиметрического методов на автоматических анализаторах BA-400, A-25, с использованием реагентов производства Biosystems (Испания). Интерпретацию полученных результатов исследования биохимических маркеров проводили на основании Российских рекомендаций по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза от 2012 года [14].
Уровень эндотелина-1 (ЭТ-1) и big-эндотелина определяли в крови у всех участниц исследования натощак с помощью иммуноферментного анализа с применением реагентов Biomedica (Австрия).
Оценку функционального состояния эндотелия сосудов проводили с помощью эндотелий-зависимой вазодилатации (ЭЗВД) на фоне пробы с реактивной гиперемией (увеличение интенсивности кровоснабжения органа после временного прекращения кровотока в нем) и измерения толщины комплекса интима медиа (ТИМ) общих сонных артерий справа и слева. Исследование выполнялось с использованием метода триплексного ультразвукового сканирования линейным датчиком с фазированной решеткой с частотой 5–13 МГц системы VIVID 7 GE. Величину ЭЗВД определяли путем измерения диаметра плечевой артерии справа до и после (через 60 секунд) 5-минутной компрессии сосуда манжетой сфигмоманометра с давлением, превышающим систолическое АД на 20–30 мм рт. ст. ЭЗВД рассчитывали как процент прироста диаметра плечевой артерии после декомпрессии по отношению к исходному. ТИМ измерялась при ультразвуковом сканировании на расстоянии 10 мм до бифуркации общей сонной артерии справа и слева.
Статистическую обработку полученных результатов проводили с помощью программы IBM SPSS Statistics 21.0.
Результаты исследования
Общая характеристика
Исследуемые группы были сопоставимы по возрасту (р=0,098) и ИМТ (р=0,922) (табл. 1). Избыточная масса тела отмечена у 17 (20%) больных с ПНЯ и у 9 (10,6%) здоровых женщин (p>0,05), ожирение I степени у 4 (4,7%) и 3 (2,4%) (p>0,05) соответственно. Участниц с ожирением II степени выявлено не было. Ожирение III степени наблюдалось лишь у 1 (1,2%) женщины из группы ПНЯ (p>0,05). Однако достоверных различий по ИМТ между исследуемыми группами выявлено не было (p>0,05).
 Все обследованные женщины с ПНЯ предъявляли жалобы на нарушение менструаций по типу вторичной аменореи (100%). Вегето-сосудистые нарушения встречались у 42 больных (49,4%), психоэмоциональные – 13 (15,3%), обменно-эндокринные – 5 (5,9%). Сексуальная дисфункция выявлена у 9 женщин (10,6%), бесплодие первичное – у 33 (38,8%), бесплодие вторичное – у 31 (36,5%). В группе контроля у всех пациенток был регулярный ритм менструаций, нарушений со стороны репродуктивной системы выявлено не было.
Все обследованные женщины с ПНЯ предъявляли жалобы на нарушение менструаций по типу вторичной аменореи (100%). Вегето-сосудистые нарушения встречались у 42 больных (49,4%), психоэмоциональные – 13 (15,3%), обменно-эндокринные – 5 (5,9%). Сексуальная дисфункция выявлена у 9 женщин (10,6%), бесплодие первичное – у 33 (38,8%), бесплодие вторичное – у 31 (36,5%). В группе контроля у всех пациенток был регулярный ритм менструаций, нарушений со стороны репродуктивной системы выявлено не было.
При первичном обследовании у 3 пациентов из основной группы АД было выше нормы, с максимальным значением 140/90 мм рт.ст. В дальнейшем эти пациентки были направлены на консультацию к кардиологу. В группе контроля у всех пациенток АД было в пределах возрастной нормы.
Гормональный профиль
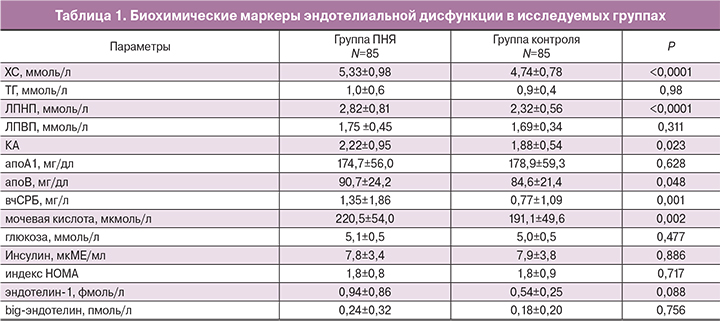
Уровень ФСГ у больных с ПНЯ был значимо выше, чем в группе здоровых женщин и составил 74,7±35,7 МЕ/л и 6,0±0,7 МЕ/л (p<0,001), соответственно. Концентрация Е2 у женщин из основной группы была достоверно ниже, чем у женщин группы контроля и составила 58,4±26,7 пмоль/л и 180,9±8,4 пмоль/л (p<0,001), соответственно.
Липидный профиль
У женщин с ПНЯ было отмечено достоверное повышение уровней ХС, ЛПНП, апо В, КА, вчСРБ и мочевой кислоты в сравнении с женщинами с регулярным ритмом менструаций (p<0,05) (табл. 1), не было выявлено различий по уровню ТГ, ЛПВП, апо А1, глюкозы, инсулина, эндотелина-1 и big-эндотелина. При этом в основной группе в 2,4 раза чаще встречались изолированные гиперхолестеринемия (p<0,05), в 2,2 раза – триглицеридемия (p>0,05) и в 3,6 раза – повышение ЛПНП (p<0,05). Сочетанная дислипидемия (повышение ХС и ТГ) встречалась в 6,8 раза чаще у больных с ПНЯ в сравнении со здоровыми женщинами (p<0,05).
Функциональное состояние эндотелия
В связи с тем, что эндотелиальная дисфункция является важным звеном в патогенезе развития атеросклероза, было оценено морфо-функциональное состояние эндотелия сосудов путем исследования ЭЗВД плечевой артерии справа и определения ТИМ общих сонных артерий справа и слева. Нормальной реакцией плечевой артерии принято считать ее расширение на фоне пробы с реактивной гиперемии на 10% и более от исходного ее диаметра [15].
На фоне пробы с реактивной гиперемией величина прироста диаметра плечевой артерии справа у больных с ПНЯ до начала проведения ЗГТ была достоверно ниже аналогичного показателя в группе женщин с регулярным ритмом менструаций (р<0,001) (табл. 2). Согласно полученным данным, средний уровень ЭЗВД в основной группе оказался на 21,7 % ниже данного показателя в группе контроля (р<0,001). Снижение ЭЗВД ниже порогового уровня (≤10%) было выявлено у 20 (23,5%) больных с ПНЯ и лишь у 1 (1,2%) женщины с регулярным ритмом менструации (р<0,05). Также выявлено, что величина ТИМ с обеих сторон у больных с ПНЯ была значимо выше, чем у здоровых женщин (p<0,001) (табл. 2). При этом утолщение стенки более 0,7 мм было отмечено у 11 женщин с ПНЯ, у 5 из них наблюдалось двустороннее утолщение ТИМ, в то время как в контрольной группе увеличение ТИМ сонных артерий отмечено у 4 женщин, и лишь у 1 из них с обеих сторон, однако достоверной разницы не было выявлено (р>0,05), что возможно связано с малой выборкой. В ходе исследования у 3 больных с ПНЯ в области бифуркации общей сонной артерии обнаружены локальные утолщения сосудистых стенок, характерные для начальных стадий образования атеросклеротических бляшек. Во всех случаях атеросклеротические очаги характеризовались как однородные гипоэхогенные структуры, не вызывающие гемодинамически значимых стенозов. В группе контроля подобной ультразвуковой картины поражения сосудов выявлено не было.
При внесении поправок на наличие традиционных факторов риска ССЗ (курение, ожирение, артериальная гипертензия, отягощенный семейный анамнез по ССЗ) также сохранились различия между группами больных с ПНЯ и женщин с регулярным ритмом менструаций по уровню ХС, ЛПНП, ЭЗВД и ТИМ с обеих сторон (p<0,05), что позволяет считать ПНЯ независимым фактором риска развития ССЗ.
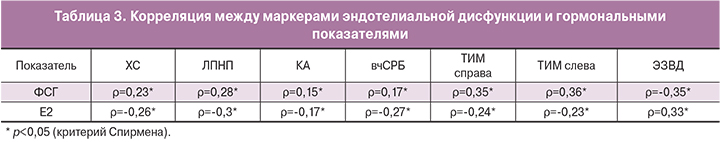
Корреляционный анализ позволил выявить прямую связь между уровнем ФСГ и уровнем ХС, ЛПНП, КА, вчСРБ, ТИМ справа, ТИМ слева, а также обратную связь между данными маркерами эндотелиальной дисфункции и уровнем Е2. Была обнаружена отрицательная корреляция между уровнем ЭЗВД и ФСГ и положительная – между ЭЗВД и Е2 (табл. 3).
На этапе включения в исследование всем пациенткам с ПНЯ было рекомендовано проведение ЗГТ в циклическом режиме на протяжении 12 месяцев. Однако из 85 женщин лишь 52 (61,2%) достигли конечной точки лечения, остальные по собственному желанию прерывали лечение после 3–6 месяцев приема препарата. На фоне проводимой терапии у больных с ПНЯ было отмечено достоверное снижение ФСГ на 32,9 МЕ/л (39,9%), повышение уровня эстрадиола на 76,8 пмоль/л (118%) с одновременным снижением уровней ХС на 0,44 ммоль/л (8,3%), ЛПНП на 0,3 ммоль/л (10,8%) и апоВ на 11,9 ммоль/л (12,8%), а также улучшением эндотелий-зависимой вазодилатации на 17,3% от исходного уровня (p<0,05) (рисунок). Не наблюдалось достоверно значимого снижения уровня ФСГ, а также изменения ТИМ на фоне проводимой терапии. У 1 пациентки с ПНЯ, несмотря на исходно нормальные показатели липидного профиля и проведение ЗГТ, при контрольном УЗИ сонных артерий отмечалось прогрессирование атеросклеротического процесса и формирование атеросклеротической бляшки в области бифуркации правой общей сонной артерии, которой не было на этапе первичного обследования.
Обсуждение
К настоящему времени накоплены экспериментальные и клинические данные, свидетельствующие о наличии эстрогеновых рецепторов в большинстве тканей, включая эндотелий сосудов, гладкую мускулатуру, слизистую кишечника, эндометрий, клетки молочной железы, строму яичников и головной мозг. В связи с этим считается, что эти ткани восприимчивы к эстрогенному дефициту, а возраст выключения яичников может стать маркером не только репродуктивного старения, но и соматического здоровья организма в целом. Несмотря на многочисленные исследования по долговременным неблагоприятным последствиям дефицита эстрогенов у женщин, большинство научных работ посвящено женщинам с ранней и естественной менопаузой и крайне мало данных касаются ССЗ у женщин с ПНЯ, частота которых неуклонно растет. Фремингемское исследование, начатое в 1948 году, инициировало гипотезу о протективном действии эстрогенов на сердечно-сосудистую систему. В мета-анализе 2006 года F. Atsma и соавт. показали, что ранняя менопауза наравне с постменопаузой является независимым фактором риска кардиоваскулярных заболеваний [11]. Наблюдение Multi-Ethnic Study of Atherosclerosis (MESA), как вариант многоцентрового крупномасштабного когортного исследования с анализом не только факторов риска, но и свершившихся кардиоваскулярных событий доказало, что относительный риск инфарктов и инсультов при ПНЯ составляет 2,08 и 2,19 соответственно (p<0,05) [16]. При этом, согласно мнению S. Parashar с соавт., у больных с преждевременно возникшим дефицитом половых гормонов после перенесенного инфаркта миокарда в 2 раза чаще возникают тяжелые формы стенокардии в сравнении с женщинами со своевременной менопаузой. Риск сердечной недостаточности по данным различных авторов увеличивается на 36–66% у женщин при выключении функции яичников в возрасте 40–45 лет в сравнении с физиологической менопаузой, при этом риск снижается на 2–4% с каждым увеличением возраста менопаузы на 1 год [14, 15].
Представленные выше данные указывают на необходимость своевременного выявления группы риска по развитию ССЗ среди женщин с ПНЯ, которая должна быть обследована с помощью общепризнанных суррогатных маркеров оценки эндотелиальной дисфункции, на основе которых можно на раннем этапе предвидеть и предупредить серьезные кардиоваскулярные события, не свойственные женщинам репродуктивного возраста.
Исследования последних лет показали, что ведущую роль в формировании и прогрессировании ССЗ играет эндотелиальная дисфункция – дисбаланс между продукцией эндотелием сосудов вазодилатирующих, атромбогенных, антипролиферативных факторов, с одной стороны, и вазоконстрикторных, протромботических и пролиферативных веществ – с другой. Основными причинами развития эндотелиальной дисфункции являются: дислипидемия, гипергомоцистеинемия, гипергликемия, свободно-радикальные повреждения, гипертензия, экзогенная (курение) и эндогенная (заболевания почек, печени) интоксикации. Следует отметить, что эндотелиальная дисфункция предшествует морфологическим изменениям в сосудистой стенке и является обратимым процессом, что наряду с другими суррогатными маркерами делает ее значимым показателем для оценки и коррекции риска развития кардиоваскулярной патологии на ранних стадиях. Доступные на сегодняшний день методы определения функционального состояния эндотелия включают изучение уровня биологически активных веществ в сыворотке крови (однако ввиду быстрого периода их полураспада работа с ними трудоемка) и оценку эндотелий-зависимой вазодилатации сосудов путем проведения функциональной пробы.
В результате проведенного анализа расширенного спектра биохимических маркеров сердечно-сосудистого риска помимо дислипидемии (повышение уровня общего холестерина, ЛПНП, КА и апо В), нами также было выявлено достоверное повышение уровня мочевой кислоты и вчСРБ у больных с ПНЯ в сравнении с женщинами с регулярным ритмом менструаций. Подобные результаты в отношении уровня ЛПНП были получены Е. Knauff с соавт. у 90 больных с ПНЯ в сравнении с 198 женщинами контрольной группы [17]. Также изучение функционального состояния эндотелия показало достоверную разницу между исследуемыми группами по значениям ТИМ и ЭЗВД, что подтвердило наличие эндотелиальной дисфункции у женщин с ПНЯ. Подобные данные были получены в ходе работы группы ученых под руководством S. Kalantaridou, однако на более ограниченной когорте больных с ПНЯ (18 женщин с ПНЯ и 20 – с регулярным ритмом менструаций) [18].
В процессе обследования помимо положительной корреляции уровня ХС, ЛПНП, КА, вч СРБ, ТИМ с уровнем ФСГ нами найдена отрицательная корреляция данных маркеров эндотелиальной дисфункции с уровнем эстрадиола. Ранее в исследовании I. Gulhan с соавт. также была обнаружена обратная связь между уровнем эстрадиола и ХС [19].
Полученные нами данные о развитии эндотелиальной дисфункции у женщин с ПНЯ являются основой, на которой в дальнейшем формируется повышенный риск развития ССЗ у этой категории больных. Об этом свидетельствует мета-анализ 2014 года, в котором J. Roeters c соавт. показали, что относительный риск развития не фатальных и фатальных случаев ИБС у женщин с ПНЯ составил 1,69 (95% ДИ 1,29–2,21, р<0,0001), при этом отмечено, что у западной популяции связь между ПНЯ и ИБС была достоверно значимой, в то время как у азиатской – таковой выявлено не было. Объединенный анализ азиатской и западной популяций не выявил повышенного риска инсульта. При этом относительный риск смертности от ССЗ в целом у больных с ПНЯ составил 1,61 (95% ДИ 1,22–2,12, р=0,0007) [20].
ПНЯ оказывает относительно незначительное влияние на риск развития ССЗ в сравнении с традиционными факторами риска, такими как артериальная гипертензия (ОР 2,95 95% ДИ 2,57–3,39), курение (ОР 2,86 95% ДИ 2,36–3,48) и сахарный диабет (ОР 4,26 95% ДИ 3,51–5,18) [21]. После проведенной поправки на традиционные факторы риска, включая курение, ожирение, артериальную гипертензию, отягощенный семейный анамнез по ССЗ, в нашем исследовании у больных с ПНЯ сохранялась разница по уровню ХС, ЛПНП, ЭЗВД и ТИМ с обеих сторон в сравнении с женщинами с регулярным ритмом менструаций (p<0,05). В связи с этим больным с ПНЯ необходимо настоятельно рекомендовать отказ от курения и поддержание нормальной массы тела.
До недавнего времени в литературе не было представлено долговременных крупномасштабных исследований с участием женщин с естественной преждевременной менопаузой, в которых в качестве конфаундеров учитывались бы проводимая гормонотерапия и курение. В мета-анализе 2015 года X-Y. Tao с соавт. отдельно проанализировали результаты исследований и показали, что у некурящих женщин, применявших гормонотерапию, относительный риск смерти от ИБС составляет 1,48 (95% ДИ 1,02–2,16), а после исключения исследования, в котором приняли участие женщины с избыточной массой тела, ОР стал незначительным (1,01, 95% ДИ 0,73–1,41) в сравнении с ранее представленными данными без учета гормонотерапии и курения. Также не было выявлено существенного влияния ПНЯ на риск развития инсульта. Учеными был сделан вывод о том, что ПНЯ повышает риск смертности от ИБС на 48% и на 24% от ССЗ в целом [22].
Для подтверждения точки зрения о положительном влиянии гормональной терапии на состояние эндотелия нами проанализированы результаты обследования 52 женщин, которые получали ЗГТ в циклическом режиме (первые 14 дней 2 мг эстрадиола, затем 14 дней 2 мг эстрадиола в сочетании с 10 мг дидрогестерона) на протяжении 12 месяцев. Полученные данные свидетельствуют о достоверном снижении уровня ФСГ на 39,9%, повышении концентрации эстрадиола на 118% с одновременным достоверным снижением уровней ХС на 8,3%, ЛПНП на 10,8% и апоВ на 12,8%, а также улучшением эндотелий-зависимой вазодилатации на 17% от исходного уровня (p<0,05).
Заключение
Таким образом, в результате проведенной работы можно сделать вывод о том, что у больных с ПНЯ в сравнении со здоровыми женщинами выявлено достоверное повышение уровня биохимических и функциональных маркеров эндотелиальной дисфункции. Заместительная гормональная терапия улучшает показатели суррогатных маркеров, что оправдывает ее назначение в качестве терапии первой линии у женщин с ПНЯ не только с целью восполнения эстрогенного дефицита, но и для нормализации функционального состояния эндотелия. Экзогенное введение половых гормонов необходимо для первичной профилактики развития ССЗ. Лечение необходимо проводить длительно – до среднего возраста своевременного выключения функции яичников.



