Расстройства мочеиспускания у женщин, страдающих рецидивирующими инфекциями мочевыводящих путей (ИМВП), являются серьезной проблемой, решения которой, несмотря на большое количество работ, посвященных этой теме, до сих пор не найдено. Пиелонефрит осложняет до 10% беременностей. Острый пиелонефрит беременных чаще встречается во втором и третьем триместрах беременности [1]. У всех пациенток, перенесших в период беременности гестационный пиелонефрит или обострение хронического пиелонефрита, в послеродовом периоде сохраняется высокий риск возникновения рецидива заболевания. Обычно рецидив пиелонефрита развивается на 3–4 или 12–14-е сутки после родов. Факторы риска развития пиелонефрита во время беременности [2]: бессимптомная бактериурия; перенесенные ранее урологические заболевания; латентно протекающие заболевания почек; интеркуррентные воспалительные заболевания; местные факторы, усугубляющие нарушение уродинамики (крупный плод, узкий таз, многоводие, многоплодие); физические факторы (охлаждение, травма); нарушение почечного кровотока – венозного оттока, вызванного расстройством уродинамики.
В подавляющем большинстве случаев основными уропатогенами ИМВП являются E. coli, другие грамотрицательные энтеробактерии, а также коагулазонегативные стафилококки [1]. Особое место занимает бессимптомная бактериурия. Бессимптомная бактериурия представляет собой состояние, при котором в моче пациента обнаруживают бактерии при одновременном отсутствии какой-либо клинической симптоматики инфекции со стороны мочевыводящих путей. Бессимптомная бактериурия у беременных является важной проблемой и выявляется в 6% (2–11%) наблюдений. У большинства женщин бессимптомная бактериурия выявляется еще до беременности. У 20–40% женщин с бессимптомной бактериурией во время беременности могут появиться клинические проявления ИМВП [1]. Лечение бессимптомной бактериурии на ранних сроках беременности позволяет снизить риск развития острого пиелонефрита на поздних сроках с 28% до уровня менее 3% [3]. Повышенный риск контаминации приводит к увеличению вероятности ложноположительных результатов в отношении лейкоцитурии при общем анализе и бактериурии при посеве мочи [5]. В связи с этим, диагноз бессимптомной бактериурии у беременных при исследовании средней порции мочи устанавливают только при выявлении одного и того же вида микроорганизма в двух последовательных посевах мочи, взятой из средней порции. Интервал между исследованиями должен составлять не менее 24 ч. У беременных бессимптомная бактериурия считается клинически значимой при титре более 105 КОЕ/мл в обоих образцах средней порции мочи при самостоятельном мочеиспускании или в одном образце мочи, полученном с помощью катетера, количество уропатогена более 105 КОЕ/мл (УД: 2а, СР: А). У беременных с симптомами ИМВП бактериурия считается клинически значимой при выявлении возбудителя в моче, собранной при самостоятельном мочеиспускании или с помощью катетера, более 103 КОЕ/мл (УД: 4, СР: В) [3]. Это состояние не рассматривается как патологическое и не требует антибактериальной терапии, кроме беременных. Именно беременные являются той категорией пациентов, у которых бессимптомная бактериурия может явиться причиной серьезных осложнений. Во время первого триместра беременности необходимо проводить скрининг на бактериурию [4]. Рекомендации по диагностике бессимптомной бактериурии у беременных [1] предполагают следующее. Скрининг на бактериурию выполняется как минимум один раз на ранних сроках беременности (12–16 недель) и, в случае положительного результата, проводится повторный посев мочи на флору. При наличии одного и того же возбудителя в титрах 105 КОЕ/мл и более, назначается лечение (уровень доказательности 1А (сильная), степень рекомендации А (высокая)). Через 7 дней после проведенного лечения необходимо повторить посев мочи на флору и чувствительность к антибактериальным препаратам (уровень доказательности 4 (слабый), степень рекомендации А (высокая)). Нет каких-либо данных за или против проведения повторного скрининга на поздних сроках беременности у женщин с отрицательным результатом на бессимптомную бактериурию в ранние сроки гестации. Беременных, перенесших острый цистит, осложненный цистит или его рецидив, а также пролеченных от бессимптомной бактериурии, необходимо динамически наблюдать вплоть до родов, исследуя мочу для доказательства эффективности антибактериальной терапии, в связи с угрозой для течения беременности [1].
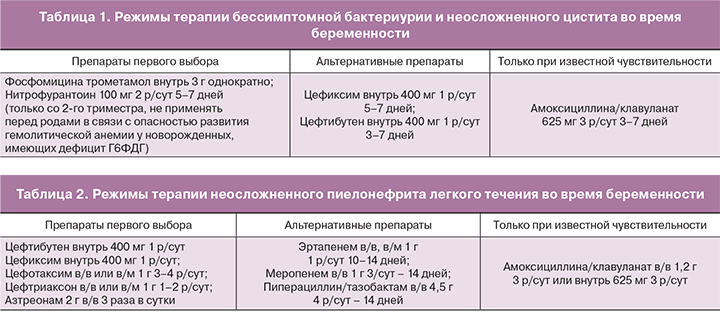
Рабочая группа Европейской ассоциации урологов хотела бы подчеркнуть, что большинство опубликованных исследований имеют низкое методологическое качество и проводились в 1960–80-х гг. С того времени значительно изменились протоколы диагностики и лечения и доступность медицинской службы, поэтому в основе этой рекомендации лежат данные низкого качества. В более новых исследованиях с хорошим методологическим качеством преимущество антибактериальной терапии не так очевидно [3, 5]. По этой причине рекомендуется обращаться к национальным рекомендациям по лечению бессимптомной бактериурии у беременных женщин. С практической точки зрения режимы антибактериальной терапии разделены согласно ранее опубликованному обзору базы данных Кохрана, проведенному Widmer и соавт., с некоторыми модификациями [6]. Рациональное и эффективное применение антимикробных препаратов во время беременности предполагает выполнение следующих условий: необходимо использовать лекарственные средства (ЛС) только с установленной безопасностью при беременности, с известными путями метаболизма (критерии FDA); при назначении препаратов следует учитывать срок беременности: ранний или поздний. Поскольку срок окончательного завершения эмбриогенеза установить невозможно, то необходимо особенно тщательно подходить к назначению антимикробного препарата до 5 мес. беременности; в процессе лечения необходим тщательный контроль за состоянием матери и плода [7]. Согласно клиническим рекомендациям Российского общества урологов (РОУ) для лечения бессимптомной бактериурии и цистита у беременных является использование следующих антибактериальных препаратов [1] (табл. 1).
Антимикробная терапия острого пиелонефрита у беременных
При лечении острого пиелонефрита беременных при наличии расширения верхних мочевыводящих путей рекомендуется установка мочеточникового катетера-стента. При стабильном состоянии возможно проведение пероральной терапии. При начале стартовой терапии с парентерального введения антибиотика после стабилизации состояния возможен переход на пероральный прием того же препарата (или другого препарата той же группы). Общая рекомендуемая длительность терапии – 14 дней [1] (табл. 2).
Цефиксим, как цефалоспорин III поколения, является препаратом выбора, имеющим высокую активность в отношении внебольничных штаммов E. сoli, создающий высокие концентрации в моче и почечной паренхиме, является безопасным в применении во время беременности с минимальной кратностью, удобством и многообразием способов приема. С учетом важности проблемы бессимптомной бактериурии у беременных, использование данного препарата весьма перспективно. Цефиксим показал высокую бактериологическую и клиническую эффективность (до 98%) в отношении основных уропатогенов, в некоторых исследованиях превосходя фосфомицин по чувствительности основных бактериальных возбудителей. Чувствительность E. coli, P. mirabilis, K. pneumoniae и K. oxytoca (основных возбудителей цистита) к цефиксиму составляет 90,9–100% (исследование в Германии, Бельгии и Испании) [8]. Цефиксим обладает бактерицидным эффектом в отношении основных уропатогенов, способностью накапливаться и сохраняться в высоких концентрациях в плазме крови и почках даже через 12 ч после его приема. Цефиксим создает высокие концентрации во многих органах и тканях. В моче концентрации во много раз превышают минимально подавляющие концентрации (МПК) большинства микроорганизмов, вызывающих ИМВП [9]. По данным экспериментального исследования, концентрация препарата в тканях плода составила менее 1% от концентрации в биологических средах матери. Концентрация препарата в плазме крови плода была в 70 раз ниже, чем в плазме крови матери [10]. Федеральное агентство по контролю за медикаментами, косметическими средствами и пищевыми продуктами США (FDA) включило цефиксим в категорию «B», поэтому при необходимости возможно применение препарата во время беременности после оценки врачебной оценки риск-польза. При более тяжелом течении пиелонефрита, как правило, требуется госпитализация с поддерживающей терапией. При выявлении данных за наличие обструктивного пиелонефрита первый этап предполагает восстановление нормального пассажа мочи по мочевыводящим путям. После улучшения состояния можно переводить пациентов с парентеральной на пероральную терапию до общей длительности 7–10 дней. Эффективность цефиксима для лечения бессимптомной бактериурии у беременных составила 96,6% (на 10±1 сут). Препарат имеет благоприятный профиль безопасности: переносимость цефиксима значимо лучше, чем амоксициллина/клавуланата, риск развития нежелательных явлений в группе цефиксима в 10 раз ниже, чем в группе амоксициллина/клавуланата (1,7% vs 17% случаев, p<0,01): тошнота, рвота, диарея [11].
Урогенитальные инфекции у беременных
Урогенитальные инфекции могут быть вызваны самыми разнообразными возбудителями, включая те, что составляют группу инфекций, передаваемых половым путем (ИППП), к которым в Российской Федерации относят сифилис, гонорею, хламидийную инфекцию, трихомониаз, аногенитальные бородавки и генитальный герпес.
Если во время беременности диагностируются эти инфекции, то существует четко прописанный протокол, согласно которому осуществляются все действия, направленные на устранение неблагоприятного их воздействия на организм матери с учетом минимизации неблагоприятного воздействия и возбудителей и лекарственных препаратов также и на плод.
Но есть и такие микроорганизмы, как правило, условно-патогенные, которые, не относясь к ИППП, могут вызывать воспалительные и другие требующие лечения процессы в урогенитальной области у беременных.
Тактика ведения таких пациентов не столь четко регламентирована как при ИППП, и в практике часто встречаются трудности с принятием решения по назначению терапии во время беременности, так и с ее выбором, с учетом тех ограничений в отношении возможного вреда для плода, которые необходимо соблюдать.
Особую сложность в этом плане представляют микоплазменные инфекции, которые весьма разнообразны и очень широко распространены. За исключением единственного представителя этой группы – Mycoplasma genitalium – все остальные микоплазмы, которые можно обнаружить в урогенитальной области, относят к условно-патогенным, то есть их можно обнаружить как при наличии патологии, так и в норме, а это, безусловно, создает серьезные трудности для принятия решения о необходимости назначения лечения, особенно, когда речь идет о беременных.
Так, несмотря на то что вагинальная колонизация Ureaplasma urealyticum и Mycoplasma hominis может являться составной частью нормальной микрофлоры у женщин, достаточно часто обнаруживают эти микроорганизмы у женщин с неблагоприятным исходом беременности, включая преждевременные роды, спонтанный аборт, преждевременный разрыв околоплодных оболочек, а также респираторные и неврологические осложнения у новорожденного, и даже перинатальную смерть [12].
Бактериальная нагрузка микоплзам, в большей степени M. hominis, а в меньшей U. parvum значительно возрастает при дисбиозе, который имеет место при бактериальном вагинозе [13, 14]. Между тем, известно, что бактериальный вагиноз может быть одним из факторов, приводящих к бесплодию [15].
Оказалось, что M. hominis может действовать симбиотически с другими ассоциированными с бактериальным вагинозом возбудителями или в качестве единственного патогена, что основано на наблюдении, что данную микоплазму можно найти в большом количестве во влагалище большинства женщин с бактериальным вагинозом, но реже и у здоровых женщин [16]. Относительно недавно был обнаружен ген M. hominis, ответственный за повышение риска преждевременных родов и хориоамнионита [17]. В недавно опубликованном исследовании D. Taylor-Robinson и соавторы указывали, что есть ситуации, когда при воспалительных заболеваниях органов малого таза единственным микроорганизмом, который удавалось обнаружить в верхних отделах мочеполовых путей у женщин оказывалась именно M. hominis [18].
Таким образом, несмотря на то, что U. urealyticum и M. hominis являются условно-патогенными микроорганизмами, в случае их выявлении у беременных женщин при наличии клинических и лабораторных признаков воспалительного процесса органов мочеполовой системы, либо при отягощённом акушерско-гинекологическом анамнезе (бесплодие, невынашивание) и осложнённом течении настоящей беременности, что предполагает возможное инфицирование плода, от этих микроорганизмов следует избавляться. Лечение, направленное на элиминацию микоплазм, если это не Mycoplasma genitalium, следует назначать только в тех случаях, когда было проведено соответствующее исследование и не были обнаружены возможные патогенные возбудители, в частности Neisseria gonorrhoeae и Chlamydia trachomatis, когда лечение следует назначать независимо от наличия или отсутствия симптоматики. Такая же тактика должна быть и при выявлении M. genitalium.
Во время беременности список антибиотиков, которые не противопоказаны беременным, но при этом эффективны в отношении урогенитальных микоплазм, значительно ограничен. А те, что разрешены к применению у беременных, в частности, макролиды, в большинстве случаев демонстрируют низкую эффективность в отношении как U. urealyticum, так и M. hominis. Пожалуй, единственный макролидный антибиотик, который показал достаточно высокую активность в отношении этих микоплазм, оказался джозамицин [19–21].
Дополнительным преимуществом джозамицина является то, что особенности конфигурации его молекулы делают этот антибиотик устойчивым к эффлюкс-эффекту, благодаря которому бактериальная клетка способна избавляться от проникшего в нее антибактериального препарата путем выброса из своей цитоплазмы. Проблема устойчивости микоплазм к антибиотикам является очень актуальной. В недавнем исследовании Maraki и соавторов, которые на протяжении 5 лет изучали распространенность и влияние на беременность U. urealyticum и M. hominis среди женского населения острова Крит, а также оценивали эффективность терапии различными антибиотиками, установили, что наиболее эффективными оказались джозамицин и доксициклин [22]. Понятно, что доксициклин, как и все тетрациклины, при беременности противопоказан. При лечении микоплазменной инфекции джозамицин применяют в дозе 500 мг 3 раза в сутки в течение 7–10 дней. Полная эрадикация возбудителя не является главным требованием к результатам лечения, поскольку речь идет об условно-патогенных микроорганизмах, а не об абсолютных патогенах. Основным критерием успешной терапии является отсутствие клинико-лабораторных признаков воспалительного процесса.
Если же речь идет о M. genitalium, то следует непременно добиваться полного устранения этого патогенного микроорганизма. К сожалению, M. genitalium демонстрирует очень быстрое развитие резистентности ко всем группам антибиотиков: макролидам, тетрациклинам и фторхинолонам [23].
Поскольку из эффективных против M. genitalium антибиотиков беременным можно назначать только макролиды, то в случае развития к ним устойчивости, лечение беременных с этой инфекцией представляет серьезные проблемы. К сожалению, резистентность M. genitalium к макролидам во всем мире постоянно растет [24].
Важным фактором распространения резистентности к макрол идам оказалось использование азитромицина в дозе 1,0 г однократно [25].
При развитии резистентности к азитромицину у M. genitalium формируется устойчивость ко всем макролидам. Как результат использования этого антибиотика в мире появились регионы со 100% устойчивостью M. genitalum ко всем макролидам [26].
Для джозамицина тоже описано развитие устойчивости у M. genitalum, но этот тип мутации микроорганизма определяет устойчивость только к 16-членным макролидам и отличен от того, что развивается в ответ на использование азитромцина, после которого развивается устойчивость универсального характера для всех макролидов [27].
До недавнего времени существовали серьезные проблемы в плане диагностики микоплазменной инфекции, поскольку наиболее чувствительные и специфичные методы диагностики этих инфекций, а именно, молекулярно-биологические, не были регламентированы должным образом в Российской Федерации. И если для диагностики U. urealyticum и M. hominis, по крайней мере, существовали возможности культуральной диагностики, то для выяления M. genitalium просто нет других методов, кроме молекулярно-биологических. В конце прошлого года появился Приказ Минздрава России, в котором уже четко прописана соответствующая номенклатура медицинских услуг, которая, фактически узаконивает использование молекулярно-биологических методов (коды услуг А 26.20. 020–А 26.20.036) для диагностики всех инфекций, передаваемых половым путем, включая не только абсолютные патогены, но и некоторые условно-патогенные микроорганизмы, в частности генитальные микоплазмы [28]. Этот приказ вступил в действие с января 2018. Использование современных методов диагностики позволит серьезно улучшить выявление этих инфекций и контролировать эффективность их лечения.
Заключение
Таким образом, необходимо подчеркнуть значимость профилактики, своевременного выявления признаков ИМВП у беременных женщин и правильного выбора антибактериальной терапии при развившейся ИМВП.



