В структуре онкологической заболеваемости женщин России злокачественные опухоли репродуктивной системы имеют наибольший удельный вес – 39,2% и составляют 18,2% всех злокачественных новообразований.
Рак тела матки выявляется у 7,8% женщин, рак шейки матки (РШМ) – у 5,3%, рак яичника (РЯ) – у 4,3%, доминируя в возрастной группе женщин на пике репродуктивной и социальной активности – 30–59 лет, уступая лишь раку молочной железы (РМЖ). В возрастной группе 30–34 лет заболеваемость РШМ и смертность от данной патологии являются максимальными (23,76% и 23,6% соответственно), доминируя по сравнению с другими возрастными группами. На ранних (I–II) стадиях заболевание выявляется у 65,6% пациенток.
В структуре смертности женщин опухоли репродуктивной системы занимают 2-е место и составляют 15,4%, при этом лидирует смертность от РЯ (5,7%). Выявляемость РЯ на ранних стадиях составляет всего лишь 24,9%, РШМ – 31,8%, а тела матки – в 62% [1].
Своевременная диагностика и лечение предраковых заболеваний и ранних стадий злокачественных опухолей репродуктивной системы являются важнейшей медицинской и социальной проблемой.
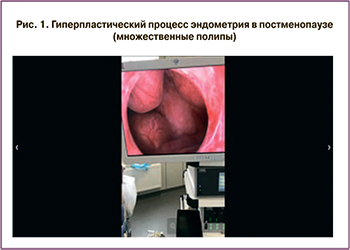 Гиперпластические процессы эндометрия (ГПЭ) относятся к числу наиболее распространенных гинекологических заболеваний, встречающихся с частотой от 30 до 55% и рассматриваются в онкологическом аспекте, являясь пролиферативным состоянием (рис. 1). С 2014 г. экспертами ВОЗ была утверждена новая классификация опухолей женской репродуктивной системы, в рамках которой выделяют доброкачественную гиперплазию эндометрия и эндометриоидную интраэпителиальную неоплазию (атипическую гиперплазию (АГП)) [2]. Риск прогрессии гиперплазии эндометрия без атипии составляет менее 5% в течение 20 лет, и в большинстве случаев наблюдается спонтанная регрессия [3]. Однако, по данным ряда авторов, в 70% случаев ГПЭ предшествуют раку тела матки, а в 20–79% АГЭ в течение 1–3 лет озлокачествляется в рак (рис. 1) [4, 5].
Гиперпластические процессы эндометрия (ГПЭ) относятся к числу наиболее распространенных гинекологических заболеваний, встречающихся с частотой от 30 до 55% и рассматриваются в онкологическом аспекте, являясь пролиферативным состоянием (рис. 1). С 2014 г. экспертами ВОЗ была утверждена новая классификация опухолей женской репродуктивной системы, в рамках которой выделяют доброкачественную гиперплазию эндометрия и эндометриоидную интраэпителиальную неоплазию (атипическую гиперплазию (АГП)) [2]. Риск прогрессии гиперплазии эндометрия без атипии составляет менее 5% в течение 20 лет, и в большинстве случаев наблюдается спонтанная регрессия [3]. Однако, по данным ряда авторов, в 70% случаев ГПЭ предшествуют раку тела матки, а в 20–79% АГЭ в течение 1–3 лет озлокачествляется в рак (рис. 1) [4, 5].
Наиболее клинически и статистически значимыми факторами риска прогрессирования патологического процесса эндометрия являются: рецидивирующие ГПЭ, морбидное ожирение – индекс массы тела (ИМТ) более 35, сахарный диабет второго типа (СД 2 типа), синдром поликистозных яичников, ановуляция, наличие патологических образований яичников, например гранулезоклеточные опухоли, бесплодие (первичное или вторичное), сочетанная патология матки (миома и/или аденомиоз), отягощенный онкологический анамнез, возраст 50 лет и старше, прием тамоксифена и эстрогенов [6].
Около 5% случаев рака тела матки ассоциированы с наследственным синдромом Линча, признаком которого является развитие вследствие мутаций генов опухолей толстой кишки (до 85%), рака эндометрия (до 71%), РЯ (до 10%) [7, 8].
Хотя рак эндометрия, как правило, диагностируется у женщин в пре- и постменопаузе, средний возраст пациенток составляет 62,6 (75%) года, от 5 до 29% случаев рака эндометрия выявляется у женщин в возрасте ≤40 лет. Более чем у 80% больных данная патология диагностируется на ранних (I–II) стадиях заболевания. Летальность на первом году с момента установления диагноза составляет 8,6% [1].
АПГ и начальный рак эндометрия (карцинома in situ, Ia стадии) отличаются благоприятным клиническим течением, а при своевременном лечении5-летняя выживаемость достигает 98,7% [9].
Достаточным и адекватным объемом лечения пациенток с данной патологией является простая экстирпация матки с придатками.
Самым простым, доступным и обладающим высокой ценностью методом первичной диагностики патологии матки является ультразвуковое исследование (УЗИ). Не вызывает сомнений, что ценность УЗИ как дополнительного метода исследования, который позволяет сформировать показания для углубленного обследования, зачастую определяет возможность диагностировать патологический процесс до появления его клинической симптоматики (рис. 2). Чувствительность сонографии как диагностического метода в определении внутриматочной патологии составляет 99,1%, а специфичность – 97,3% [10].
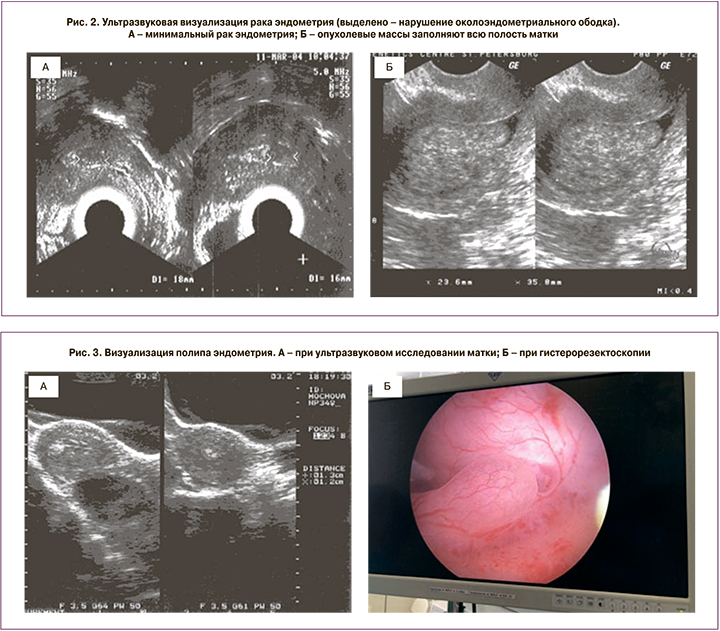
Однако УЗ-эхография не может дать информации о морфологической картине гиперпластического процесса. Одним из самых доступных методов морфологической диагностики гиперплазии эндометрия, предрака и рака эндометрия является аспирационная биопсия (например, Pipelle), но проблемы доступа к полости матки и погрешности в заборе материала ограничивают клиническую значимость отрицательного результата. В случае локальных поражений цитологическое исследование аспирата из полости матки или «слепое» раздельное диагностическое выскабливание матки может быть малоинформативным [3].
В онкогинекологии при выявлении гиперпластического процесса полости матки и подозрении на рак слизистой тела матки выполняется целый ряд клинико-инструментальных методов обследования, но основой определения тактики лечения является морфологическая верификация диагноза. Чтобы диагностировать начальный онкологический процесс эндометрия и тем самым обеспечить ранний старт и лучший результат лечения, возможность гистероскопической визуализации всего эндометрия дает большее преимущество, особенно у пациенток с локальными поражениями, например атипией в полипе эндометрия (рис. 3).
Гистероскопия обладает высокой чувствительностью и специфичностью (0,84–0,97% и 0,88–0,93% соответственно) как диагностический метод, являясь золотым стандартом не только диагностики, но и лечения внутриматочной патологии [11–13].
Внедрение гистерорезектоскопических методик в онкогинекологической практике позволило применить данный метод в диагностике АПГ, начального рака эндометрия и, что особенно актуально, в лечении пациенток репродуктивного возраста при желании сохранить репродуктивную функцию [14, 15].
В случаях бессимптомных патологических образований эндометрия в постменопаузе, выявленных при вагинальном УЗИ, на долю которых приходится 6% всех случаев, выполнение гистерорезектоскопии является обязательным [16].
В 2018 г. итальянскими учеными было проведено ретроспективное исследование с участием 295 бессимптомных женщин, у которых в постменопаузе методом ультразвуковой диагностики (УЗД) была диагностирована гиперплазия эндометрия более 5 мм. Пациенткам выполняли гистероскопию с биопсией эндометрия в период между 2009 и 2015 гг., с последующей гистологической оценкой состояния эндометрия. Чувствительность, специфичность, положительная и отрицательная прогностическая ценность результатов представлены в таблице [17].
Таким образом, каждой пациентке в постменопаузе, с толщиной эндометрия более 5 мм (по данным УЗИ), должно быть проведено дополнительное обследование в объеме гистероскопии, которая рассматривается как обязательный метод исследования, позволяющий визуализировать все стенки матки и выполнить прицельную биопсию всех зон пораженного эндометрия.
Применение УЗД в комплексе с гистероскопией и прицельной биопсией позволяет достичь 98,2% специфичности и чувствительности в диагностике патологических изменений эндометрия [10]. И даже при гистероскопически визуализированном атрофическом эндометрии без видимых патологических изменений биопсия должна быть выполнена (рис. 4).
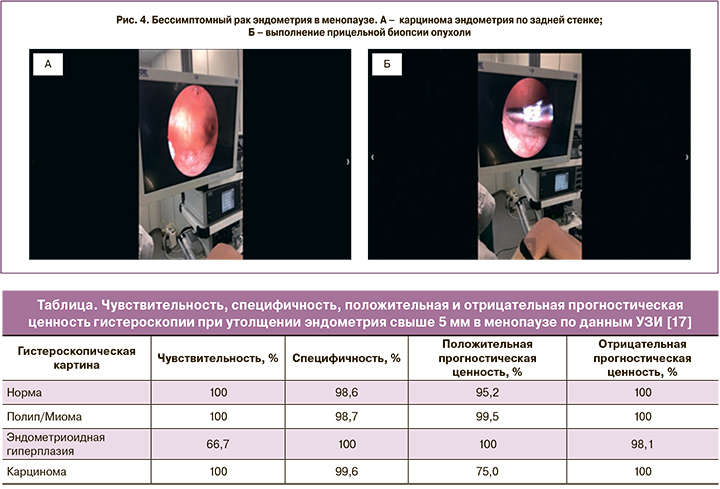
Актуален вопрос диссеминации раковых клеток в брюшную полость при уже имеющемся онкологическом процессе в эндометрии при выполнении гистерорезектоскопии, который обусловлен транстубарным рефлюксом раковых клеток эндометрия в брюшную полость [18].
В ретроспективном исследовании 2011 г. было доказано, что продолжительность гистероскопии и положительная перитонеальная цитология никак не влияют на показатели общей и безрецидивной 5-летней выживаемости больных раком эндометрия [19]. Поэтому нет оснований избегать диагностической гистероскопии у пациенток с предполагаемым раком эндометрия, особенно на ранних стадиях. По данным международной классификации TNM, положительная перитонеальная цитология указывается отдельно без изменения стадии [20].
Тем не менее, чтобы минимизировать риск распространения опухоли, гистероскопию следует проводить при внутриматочном давлении не более 80 мм рт.cт., а продолжительность процедуры должна быть как можно меньше. По данным некоторых исследований установлено, что риск протекания транстубарной жидкости во время выполнения гистероскопии отсутствует, если манипуляция выполняется с внутриматочным давлением менее 40 мм рт.ст., невысокий – при давлении ниже 70 мм рт.ст., тогда как заметно увеличивается при давлении 100 мм рт.ст. [21].
Использование гистероскопии и биопсии патологии эндометрия приводит к почти 100% точности диагностики рака эндометрия и выявлению фоновых и предраковых изменений. Она представляет собой идеальный метод обследования женщин старше 45 лет с аномальными маточными кровотечениями, позволяет сформировать группы повышенного риска развития рака эндометрия [22].
Все существующие диагностические методики обследования шейки матки (ШМ) разрабатывались для ранней диагностики рака шейки матки (РШМ) и его облигатного предрака – цервикальных интраэпителиальных неоплазий (СIN/SIL).
Несмотря на то что РШМ отвечает всем требованиям популяционного скрининга, в возрастной группе 30–39 лет (период наибольшей репродуктивной активности) он является основной причиной смертности (24,4%), а в возрасте 40–49 лет составляет 14,8%, уступая лишь новообразованиям молочной железы (22,6%), что делает его одной из глобальных проблем здравоохранения [1].
Скрининг РШМ позволяет выявить неопластические изменения эпителия на начальном этапе трансформации клеток, которые индуцируются персистирующей инфекцией, вызванной вирусом папилломы человека (ВПЧ) [23].
В цитологическом скрининге наиболее важной составляющей является широта охвата населения, а не частота его проведения.
Самостоятельная регрессия предопухолевых изменений является одним из ограничений скрининга. В этом случае оправданы удлиненные интервалы между обследованиями – 3–5 лет. Изучено несколько методов скрининга, а также их комбинации: могут применяться как стандартная, так и жидкостная цитология и полуколичественный ВПЧ Digene-тест, сочетание которых имеет высокую прогностическую ценность негативного результата, близкую к 100% [24, 25]. Зачастую значительным препятствием для реализации программ профилактики PШМ является нежелание женщин посещать гинеколога из-за неприятных ощущений при заборе мазка, поэтому в последние годы в клиническую практику внедрены также различные методы самoзабора вагинального отделяемого для выполнения ВПЧ-тестирования [26].
На сегодняшний день большой интерес представляют тесты на основе метода полимеразной цепной реакции (ПЦР), способные обнаруживать ВПЧ. В рамках скрининга они на 40% более чувствительны, чем цитологический мазок [27]. Но несмотря на более высокую чувствительность, диагностика с помощью ПЦР не позволяет отличить клинически значимую папилломавирусную инфекцию (ПВИ) от клинически не значимой. В таком случае активно используют полуколичественный ВПЧ-тест гибридного захвата НС2 (Hybrid Capture 2 Digene test), он позволяет выявлять широкий спектр ВПЧ (высокого и низкого онкогенного риска), определяет клинически значимую концентрацию вируса, которая характеризует угрожающий уровень инфекции, приводящий к развитию неоплазии шейки матки, в то время как ПЦР-исследование определяет только наличие вируса вне зависимости от его клинического проявления. В группе женщин от 35 лет и старше чувствительность и специфичность метода составляют в среднем 89 и 90% соответственно, а в сочетании с цитологическим мазком предсказательная ценность отрицательного результата достигает 100% [25].
Визуальные методы играют важную роль в профилактике РШМ, особенно в странах с низким доходом. Скрининг может быть проведен с помощью одной из двух проб:
- проба с 3–5% раствором уксусной кислоты – VIA;
- проба с раствором Люголя — VILI (Шиллер-тест).
Метод предельно прост – тест с уксусной кислотой выполняют без увеличения (кольпоскопа), при этом оценивают только наличие ацетобелого эпителия (побеление есть – позитивный, побеления нет – негативный). В тесте VILI регистрируется наличие или отсутствие йоднегативной зоны. Однако при высокой чувствительности этот метод обладает низкой специфичностью [28, 29].
Преимущества визуального скрининга – доступность и малозатратность, недостатки – низкие специфичность и информативность у женщин в постменопаузе, когда переходная зона часто локализуется в цервикальном канале и не видна при осмотре.
Эксперты ВОЗ для стран с низкими ресурсами рекомендуют стратегию под названием «скрининг–лечение» (screen and treat), то есть в случае позитивного результата сразу проводится лечение, без дополнительной диагностики [30]. Эта рекомендация объясняется тем, что снижение заболеваемости РШМ сопоставимо с традиционной стратегией, но данный подход, несмотря на гипердиагностику и чрезмерное лечение, экономически выгоднее.
Попытки использовать кольпоскопический метод диагностики в качестве скрининга до настоящего момента не увенчались успехом. Кольпоскопия занимает много времени, требует высококвалифицированного специалиста и оборудования. Обладает высокой чувствительностью – до 91%, но низкой специфичностью – около 25%, так как ацетобелый эпителий возникает не только при HSIL, но и при LSIL, незрелой метаплазии, репаративных изменениях [31]. Именно из-за гипердиагностики кольпоскопия считается неприемлемой для скрининга, и нигде в мире, кроме России, не используется в качестве скринингового метода. Однако применение ВПЧ-тестирования или цитологического исследования для первичного скрининга с последующей кольпоскопией и прицельной биопсией увеличивает ее роль [32].
Биопсия ШМ выполняется с целью уточнения диагноза при подозрении на опухолевый процесс, она должна быть выполнена радио/электрохирургическим методом или скальпелем, мультифокально, с захватом неизмененного эпителия, под контролем кольпоскопического исследования, желательно с кюретажем эндоцервикса, с толщиной биоптата 3–5 мм [9].
С 2012 г. используется гистопатологическая классификация Bethesda, разделяя интраэпителиальное поражение шейки матки на LSIL и HSIL [33]. LSIL является обратимым процессом практически в 91% случаях, и рекомендуется консервативная и выжидательная тактика в течение года, а при трижды отрицательных результатах далее проводится стандартный скрининг РШМ [34–36]. В существующей классификации CIN II и III объединены в HSIL и требуют одинакового подхода к лечению, что зачастую обязует врачей использовать хирургический подход даже у молодых нерожавших пациенток, исключая попытки консервативной тактики. В данном случае выполняется конизация шейки матки (циркулярное иссечение тканей шейки матки с захватом не менее ⅓ цервикального канала скальпелем, наконечником Геймса–Роговенко, ультразвуковым скальпелем или радиоволновым ножом), которая является лечебно-диагностической операцией, позволяющей добиться полного удаления диспластических изменений ШМ в 94% случаев. Хирургическое иссечение является единственным полноценным лечебно-диагностическим методом при плоскоклеточном поражении ШМ в диапазоне HSIL (Cancer in situ ) – Ia1 стадии, обеспечивая радикальное удаление патологически измененных тканей в пределах здоровых тканей, что соответствует онкологическим принципам, дает возможность тщательного гистологического исследования и шанс на сохранение физиологических функций, включая репродуктивную.
 Важно, чтобы патоморфологический отчет основывался на серийных срезах удаленной части шейки матки и содержал описание ширины и глубины патологической ткани, оценку состояния резецированных краев с указанием наличия или отсутствия интраэпителиального и/или инвазивного поражения (рис. 5). Гистологическая диагностика резецированной части ШМ – это исследование не менее 12 фрагментов ШМ, независимо от размеров удаленного конуса, не менее 3 срезов каждого фрагмента.
Важно, чтобы патоморфологический отчет основывался на серийных срезах удаленной части шейки матки и содержал описание ширины и глубины патологической ткани, оценку состояния резецированных краев с указанием наличия или отсутствия интраэпителиального и/или инвазивного поражения (рис. 5). Гистологическая диагностика резецированной части ШМ – это исследование не менее 12 фрагментов ШМ, независимо от размеров удаленного конуса, не менее 3 срезов каждого фрагмента.
Рецидив или неполная излеченность после хирургического лечения возникает в 3–14%. Следует отметить наиболее значимые предиктивные факторы рецидива тяжелой дисплазии и преинвазивного рака при выполнении хирургического иссечения пораженной ткани ШМ: положительные края резекции, гистологический тип опухоли, позитивная гистологическая оценка соскоба из цервикального канала, вовлеченность эндоцервикальных желез, пациентки среднего и старшего возраста (по некоторым данным – старше 35 лет), большая площадь патологического поражения (равная или более 4 см), персистенция ПВИ. Наличие тяжелой плоскоклеточной дисплазии в краях резекции свидетельствует о высоком риске рецидива, но не является поводом для рутинной повторной эксцизии, если зона трансформации полностью визуализируется [37]. Адекватного наблюдения (цитологический мониторинг, кольпоскопия) за интраэпителиальной патологией достаточно в данной ситуации, что особенно актуально у молодых нерожавших пациенток.
Альтернативным методом лечения рецидива (в диапазоне CIN III – Cancer in situ – Cancer colli uteri Ia1) для пациенток репродуктивного периода является повторная эксцизия. Данный метод лечебно-диагностического пособия вполне адекватен, приводит к стойкой ремиссии (90,9%), с сохранением возможности деторождения, зачастую являясь, наравне с диагностическим, и лечебным [38].
Для пациенток постменопаузального возраста консервативный подход лечения преинвазивных форм РШМ лишен смысла. У женщин данной группы из-за неудовлетворительной кольпоскопической картины (стык плоского и цилиндрического эпителиев не визуализируется), атрофических изменений ШМ, невозможности выполнения полноценной биопсии исключена возможность получения полноценного конуса (длина удаленного конуса короче) [39, 40]. Существуют данные научных исследований, что частота рецидивов тяжелой дисплазии ШМ в старшей возрастной группе пациенток в два раза выше, чем у пациенток молодого возраста (20,8 и 10,9% соответственно) [41]. Диагноз микро- и инвазивного РШМ устанавливается только на основании гистологического исследования, поэтому конизация ШМ в данной возрастной группе пациенток рассматривается чаще как диагностический метод, который может служить руководством для планирования дальнейшего метода лечения. Кроме того, частота рецидивов тяжелой дисплазии ШМ в старшей возрастной группе пациенток в два раза выше, конизация ШМ в постменопаузальном возрасте остается дискуссионной, для данной категории больных предпочтительнее выполнение экстирпации матки с придатками.
Преинвазивные аденокарциномы ШМ являются редкой (0,4%) патологией, в 67% они имеют скрытое течение и сложны в диагностике [42]. Обнаружение преинвазивной железистой карциномы ШМ, характеризующейся более агрессивным течением с частотой рецидива преинвазивных форм до 20%, не опровергает консервативную тактику лечения в репродуктивном возрасте, но требует обязательной повторной конизации ШМ при выявлении положительных гистологических результатов в краях резекции и более тщательного последующего динамического наблюдения с ПЦР- тестированием [43]. В ретроспективном американском исследовании были проанализированы результаты конизации 78 женщин с первичным диагнозом преинвазивного железистого РШМ (ACIS). При подтверждении диагноза выполнялась повторная конизация или экстирпация матки. В результате исследования выявлено, что инвазивная форма рака выявляется у 12–17% пациенток, а женщины с отрицательными краями первичной резекции и соскоба из цервикального канала имеют 14% риска остаточной железистой дисплазии. Поэтому отрицательные гистологические данные краев выполненного конуса и кюретажа ШМ не могут в достаточной степени гарантировать излеченность от заболевания. В то же время динамическое наблюдение за пролеченными пациентками с железистым типом дисплазии шейки матки и преинвазивным раком является сложным и дискутабельным, так как типичное цитологическое исследование является малоинформативным. Авторами предлагается в качестве прогностического фактора ПЦР-диагностика ВПЧ высокого канцерогенного риска (ВКР) как один из самых информативных прогностических факторов развития рецидива железистой дисплазии шейки матки [44].
Для женщин с реализованной репродуктивной функцией консервативное ведение железистых форм интраэпителиальных поражений недопустимо и требует радикального хирургического лечения [45].
Одним из новых направлений прогнозирования течения диспластических изменений является метод молекулярно-биологической оценки микроРНК, который способен отображать степень пролиферации патологического эпителия и может быть использован как биомаркер прогноза развития опухоли [46]. В настоящее время ведутся научные работы по оценке степени экспрессии микроРНК, при этом 7 из 16 микроРНК, специфичных для инвазивного роста, уже показали свою значимость в прогнозе развития тяжелой дисплазии до инвазивного РШМ. Например, экспрессия miR-127 прогрессивно повышается от дисплазии до инвазивного РШМ и может выступать маркером метастазирования в лимфатические узлы [47]. В то время как экспрессия miR-375 в тканях РШМ прогрессивно снижается по сравнению с нормальной тканью ШМ в 4,45 раза. Данные могут свидетельствовать о том, что подавление miR-375 способствует клеточному злокачественному прогрессированию и, следовательно, может способствовать прогрессированию РШМ. Исследование микроРНК в качестве предиктора злокачественной прогрессии имеет большие перспективы, учитывая, что изменения в показателях значений возникают раньше, чем морфологические изменения в пораженных тканях, что может определять тактику лечения [48].
Внедрение популяционных программ скрининга должно стать приоритетом в большинстве стран, а выбор инструмента скрининга зависит от диагностических возможностей и ресурсов для контроля качества.
Несмотря на научные поиски предикторов малигнизации кистозных образований яичников, заболеваемость и смертность от РЯ остаются на высоком уровне. Несомненно, высокая смертность от опухолей яичников связана с тем, что большинство пациенток с данной патологией диагностируются на поздних стадиях, то есть тогда, когда традиционные методы лечения оказываются менее эффективными (выявляемость первой стадии заболевания не превышает 24,9%) [1]. Во всем мире ежегодно диагностируется около 200 000 случаев РЯ [49].
С применением современных методов комбинированного лечения для женщин с ранней стадией заболевания общая 5-летняя выживаемость колеблется от 80 до 95%, однако для женщин с распространенным процессом (III и IV стадий) выживаемость не превышает 30–40% [20].
Диагностика РЯ является сложной проблемой, принимая во внимание вариабельность гистологических форм и отсутствие патогномоничных симптомов течения ранних стадий заболевания. У 22,6% пациенток РЯ обнаруживается случайно при отсутствии каких-либо жалоб, а у 7% пациенток РЯ выявляется при микроскопическом исследовании удаленного препарата кисты яичника [49]
На сегодняшний день для диагностики РЯ как стратегия скрининга применимы УЗИ и иммунологическое исследование крови – определение опухолевых маркеров в сыворотке крови, самым распространенным из которых является CA-125 (Cancer Antigen 125). CA-125 является маркером сыворотки крови, которому уделяется наибольшее внимание при определении методов раннего выявления эпителиального РЯ [50]. Однако CA-125 недостаточно специфичен для скрининга общей популяции, концентрация его может меняться и на фоне доброкачественных заболеваний (эндометриоз, аденомиоз, кисты яичника, миома матки, дисфункция почек, заболевания печени, поджелудочной железы). Даже у женщин в постменопаузе диагностическое значение CA-125 (норма 35 Ед/мл) может достичь специфичности 94–99%, что может быть объяснено значительной долей выявляемых III–IV стадий РЯ, но не соответствует требованию скрининга, когда специфичность должна составлять 99,7% [51].
Также широко распространено для диагностики эпителиального РЯ определение онкомаркера НЕ4 (Human Epididymis Protein 4), чувствительность которого на ранних стадиях РЯ (I–II стадии) достоверно превышает таковую СА-125 и составляет 73,7% [52].
В дифференциальной диагностике с доброкачественными образованиями яичников уровень специфичности НЕ4 также значимо превышает уровень СА-125 и составляет 60,1% и 95,6% соответственно. Анализ же комплексной оценки этих маркеров (индекс ROMA) повышает информативную ценность метода, когда чувствительность составляет 96%, а специфичность – 76% [53].
Злокачественные эпителиальные опухоли яичников на начальных этапах заболевания не имеют характерных клинических симптомов. Клиническая картина заболевания имеет «стертый» характер, выражающийся в «дискомфорте» со стороны желудочно-кишечного тракта, увеличении объема живота за счет асцита, боли возникают уже при довольно значительных размерах опухолей, зачастую уже при наличии диссеминации опухолевых клеток в брюшной полости.
Обратная ситуация обстоит с неэпителиальными опухолями (стромальноклеточными, герминогенными), диагностика которых возможна в 70% случаев на I стадии заболевания. В отличие от эпителиальных опухолей яичников, герминогенные опухоли имеют солидное строение, поэтому болевые ощущения возникают на начальных этапах развития опухоли из-за натяжения подвешивающей связки или ее перекрута. В таких случаях информативно определение в крови альфафетопротеина (АФП), лактатдегидрогеназы (ЛДГ) и β-субъединицы хорионического гонадотропина человека (β-ХГЧ) для исключения герминогенных опухолей, а также ингибина В – для исключения стромальных опухолей. Опухоли, развивающиеся из стромы полового тяжа, являются гормонпродуцирующими, и симптомы заболевания могут быть проявлением гиперпродукции эстрогенов или андрогенов.
УЗИ является ведущим методом диагностики новообразований в малом тазу, доступным, информативным, как этап первичной диагностики, позволяющим сформировать показания к объему дополнительного обследования. Общая диагностическая точность УЗИ в отношении опухоли яичника составляет около 80%. Этот метод обладает высокой разрешающей способностью и информативностью [54].
В настоящее время активно внедряются в практику методики, повышающие диагностическую ценность УЗИ: исследование в В-режиме (трансабдоминальный и трансвагинальный методы), цветное допплеровское картирование (ЦДК), соноэластография. Для повышения чувствительности и специфичности эхографической методики в диагностике злокачественных и доброкачественных опухолей яичников оцениваются визуализация сосудов и состояние кровотока. Спектральный анализ допплеровской волны, излучаемой цветным допплерографическим анализатором, широко используется для определения состояния кровотока в опухолях [55].
Одним из самых перспективных и новаторских методов в диагностике онкологической патологии репродуктивных органов является контрастно-усиленная эхография (CEUS – contrast-enhanced ultrasonography), характеризующаяся быстротой и легкостью исполнения, приемлемой стоимостью и практически отсутствием противопоказаний. Применение CEUS (препарат Соновью 2,5 мл) в гинекологии особенно актуально в диагностике патологии яичников, показанием к которому является любой солидный компонент в кистозных образованиях яичников. Данный метод позволяет детально оценить сосудистое русло, выявить признаки неоангиогенеза, а используемая качественная оценка (по сравнению с двухмерными индексами) позволяет в целом оценить характер кровотока в опухоли [54, 56].
При этом методе внутривенно вводятся эхоконтрастные агенты, которые состоят из микропузырьков, стабилизированных мембраной, позволяющей им сохраняться в кровотоке не менее 4–5 минут. Они усиливают ультразвуковой сигнал, поступающий от крови, что дает возможность в реальном времени отображать динамику васкуляризации поражений, паренхимы и кровеносных сосудов. Метод основан на том, что из-за выраженного неоангиогенеза опухолевая ткань интенсивно накапливает контрастный препарат и быстро его выводит, с обратным эффектом в доброкачественной ткани [57].
Эхографические признаки доброкачественных образований яичников: жидкостное гладкостенное образование в проекции яичника, внутренняя структура – анэхогенная (серозные кисты) или гипоэхогенная (эндометриоидные, муцинозные), округлая или овоидная форма, ровные, гладкие контуры (папиллярные кисты с мелкими единичными пристеночными гиперэхогенными включениями), одностороннее поражение, вариабельность размеров (муцинозные – чаще крупные размеры), кровоток по капсуле образования отсутствует, самопроизвольный регресс на протяжении нескольких менструальных циклов или при назначении оральных контрацептивов в течение 2–3 месяцев (рис. 6).

О патологическом характере кист яичников на основании УЗД говорят структура стенки кисты, ее толщина и сложность септ, наличие внутренних сосочков или твердых структур, разрастаний по капсуле яичника, наличие патологического кровотока [58] (рис. 7).
CEUS особенно актуальна у больных РЯ, так как легко выполнима, практически не имеет противопоказаний, позволяет сформировать показания к дополнительному обследованию, включая селективное назначение опухолевых маркеров.

В США была выполнена всесторонняя оценка диагностической ценности традиционного УЗИ, УЗИ в режиме допплеровского картирования и УЗИ с контрастным усилением (CEUS) для дифференциации доброкачественных и злокачественных образований яичников. Чувствительность и специфичность обычного УЗИ составляли 0,92 и 0,86% соответственно, УЗИ в режиме допплеровского картирования – 0,93% и 0,85% соответственно. Для CEUS чувствительность составила 0,97%, а специфичность – 0,92%. Все три метода визуализации имеют относительно высокую диагностическую ценность для дифференциальной диагностики злокачественных опухолей яичников от доброкачественных, дополняя друг друга и предоставляя новые возможности в оценке патологического процесса [59] (рис. 8).
В постменопаузальном периоде при УЗИ размеры яичников не должны превышать 2 см, должны иметь однородную гипоэхогенную структуру, не иметь кистозных образований, допустимо наличие кист не более 2–3 см в диаметре, гладкостенных, однокамерных, без включений и признаков васкуляризации. Наблюдение кисты возможно не более 6 месяцев под динамическим УЗ-контролем не реже 1 раза в 3 месяца при нормальных показателях сывороточного онкомаркера СА-125 и НЕ4. При наличии образования яичника более 6 месяцев, жидкости в малом тазу, при повышении показателей СА-125 и других маркеров опухолевого роста показано хирургическое лечение.
Следует помнить, что РЯ является одной из самых частых разновидностей семейного рака (10–15% случаев РЯ). Большинство наследственных опухолевых синдромов характеризуются строгой органоспецифичностью: наличие мутации повышает риск развития РМЖ, рака желудка, кишечника, эндометрия, поджелудочной железы и некоторых других локализаций. В 90–95% случаев наследственный РЯ обусловлен мутациями в генах BRCA1 и BRCA2 [60]. Онкологические больные с отягощенным семейным анамнезом должны быть тестированы на наличие мутаций в генах BRCA1 и BRCA2, родственникам «BRCA-позитивных» пациентов нужно рекомендовать молекулярно-генетическое обследование с целью формирования индивидуального плана профилактического наблюдения.
Для ранней диагностики развития наследственного РЯ показано динамическое наблюдение не реже 1 раз в 6 месяцев (сонография органов малого таза и определение опухоль-ассоциированного антигена СА-125) начиная с 35 лет [61].
Заключение
Ранняя диагностика злокачественных новообразований зависит главным образом от онкологической настороженности врачей общей практики и их знаний, выработки единой тактики эффективных методов обследования пациенток. Совершенствование просветительной работы, применение комплексного современного обследования пациенток улучшат своевременную диагностику злокачественных новообразований и отдаленные результаты лечения.



