В литературе длительное время активно обсуждаются преимущества консервативной миомэктомии. Еще в апреле 1886 г. известный русский профессор акушер-гинеколог А.И. Лебедев первый в России произвел консервативную миомэктомию брюшностеночным путем. В октябре 1886 г. выдающийся русский гинеколог К.Ф. Славянский выполнил вторую консервативную миомэктомию в России.
Практически одновременно, в октябре 1886 г. в Казани профессор акушерства и женских болезней Казанского университета Н.Н. Феноменов произвел операцию по типу вылущения миомы, одновременно были удалены и придатки матки. В ноябре 1887 г., т.е. спустя год, Г.Е. Рейн, профессор университета Св. Владимира в Киеве и директор акушерско-гинекологической клиники, применил консервативную миомэктомию, удалив подслизистую миому. В связи с этим трудно не согласиться со словами нашего современника профессора С.Б. Голубчина, что «сохранить орган, или часть его – благородная задача хирурга. Полное удаление органов, имеющих функциональное значение и играющих определенную роль в балансе организма – калечащая, уродующая операция».
Сегодня, в век эндоскопической хирургии, открыты новые возможности выполнения оперативных вмешательств при миоме матки. Преимущества лапароскопической миомэктомии с применением электрокоагуляционных методов заключаются в простоте и быстроте хирургического вмешательства. В то же время коагуляционные мероприятия на матке – процедура, не лишенная риска развития инфекционных осложнений, геморрагий, эндометриоза, склерозирования рубца, синехий и даже бесплодия и онкологических процессов.
В литературе нет сведений о структуре рубцов миометрия после миомэктомии как у нерожавших женщин, так и у родильниц. Также отсутствуют результаты сравнительного изучения рубцов миометрия после различных хирургических вмешательств на матке.
Цель данного исследования определить клинические и морфологические критерии состоятельности рубца после перенесенной операции миомэктомии, чтобы сформировать группы беременных и рожениц для последующего родоразрешения через естественные родовые пути и выявить целесообразность гормональной реабилитации дроспиренон-содержащим контрацептивом мидиана в послеоперационном периоде.
Материал и методы исследования
Данная работа проводится на кафедре акушерства и гинекологии лечебного факультета НГМУ (ректор – проф. Маринкин И.О.) с 2008 г. и состоит из 2 частей. Первая часть исследования включала 115 женщин после миомэктомии.
Пациентки были разделены на 3 группы, в зависимости от доступа и способа ушивания
ложа миомы:
1 группа – 40 пациенток с рубцом миометрия после лапаротомической миомэктомии с ушива-нием ложа двурядными синтетическими швами.
2 группа – 40 женщин с рубцом на матке после лапароскопической миомэктомии с ушиванием ложа двурядными узловыми синтетическими швами.
3 группа – 35 пациенток с рубцом миометрия после лапароскопической миомэктомии с коагуляцией ложа.
Все 115 пациенток, перенесших миомэктомию, планировали продолжить реализацию своей репродуктивной функции и были взяты на диспансерный учет, в ходе которого с целью оценки
состоятельности рубца на матке в предгравидарном периоде им проводилось ультразвуковое
исследование (УЗИ), гистероскопия и гистеросальпингография (ГСГ).
После проведения УЗИ 14 (12,1%) пациенток были исключены из группы для ведения родов через естественные родовые пути, поскольку у них были выявлены признаки, описанные академиком РАМН В.И. Краснопольским (1993) как неблагоприятные и указывающие на неполноценность рубца на матке.
У пациенток 1 и 2 групп признаки неполноценности рубца, по данным УЗИ, встречались в 10 и 7,5% случаев соответственно; у женщин с лапароскопической коагуляцией ложа – в 20%, т.е. у каждой пятой.
После проведения гистероскопии из дальнейшего участия в программе ведения родов через естественные родовые пути были исключены еще 24 (23,7%) женщины с признаками неполноценности рубца, которые у пациенток 1 и 2 групп, по данным гистероскопии, встречались в 13,9 и 16,2% случаев соответственно, а у женщин с лапароскопической коагуляцией ложа – в 46,4%, т.е. практически у половины.
Еще у 9 (11,6%) женщин в ходе выполнения ГСГ были выявлены рентгенологические признаки, указывающие на неполноценность рубца на матке: в 1 и 2 группах в 6,4 и 9,7% случаев соответственно, после лапароскопической коагуляции ложа – в 26,7%.
Таким образом, уже на этапе предгравидарного скрининга из 115 были исключены 47 женщин,
которым в дальнейшем было выполнено плановое абдоминальное родоразрешение с удалением рубца миометрия [2]. Фрагменты удаленного рубца фиксировали в 4% растворе параформальдегида на фосфатном буфере, обезвоживали в серии этанола возрастающей концентрации, просветляли в ксилоле и заключали в парафин. Срезы окрашивали гематоксилином и эозином, по Романовскому и по Ван-Гизону [1], изучали на световом микроскопе Triton при увеличении до 1200 раз. Выбор тестовых систем, использованных в работе, производили в соответствии с рекомендациями E.R. Weibel [3]. Различия между средними считали достоверными при р<0,05.
Результаты исследования и обсуждение
Рубцы миометрия после лапаротомической миомэктомии с ушиванием ложа двурядным синтетическим швом и после лапароскопической миомэктомии с экстракорпоральным наложением швов представлены тонкими рубцами с параллельным расположением волокон и единичными геморрагиями (рис. 1а, б, см. на вклейке). Клеточное звено было представлено единичными лимфоцитами и нейтрофилами. Граница между миометрием и рубцом после лапаротомической и лапароскопической миомэктомии с ушиванием
ложа характеризовалась полнокровием и кровоизлияниями (рис. 2 а, б, см. на вклейке). В то время
как при лапароскопической миомэктомии с коагуляцией ложа имело место хаотичное расположение волокон и обширные геморрагии в тканях рубца. Сосудистый компонент был представлен большим количеством сосудов со склерозированными стенками. Обращало на себя внимание увеличение численной плотности всех лейкоцитов, особенно нейтрофилов, а также эритроцитов. Граница между миометрием и рубцом после лапароскопической миомэктомии с коагуляцией ложа была наглядно представлена крупными сосудами со склерозированными стенками, полнокровием и кровоизлияниями, а также множеством мелких сосудов, похожих на грануляции (рис. 3 а, б, см. на вклейке).
Таким образом, проведенные гистологические исследования убедительно показали, что в репродуктивном возрасте следует выполнять или лапаротомическую миомэктомию, или лапароскопическую миомэктомию, но с обязательным экстракорпроральным ушиванием ложа двурядным швом (если хирург владеет методикой лапароскопического наложения швов). Коагуляция ложа недопустима, поскольку во время беременности высок риск гистопатического разрыва матки.
Оставшиеся 68 женщин без признаков неполноценности рубца на матке поступали на родоразрешение в Новосибирский городской перинатальный центр в 2008–2012 гг.
Они были распределены по 3 группам:
I группа – 29 беременных и рожениц, которым выполнялась лапаротомическая миомэктомия;
II группа – 28 беременных и рожениц, которым выполнялась лапароскопическая миомэктомия с
ушиванием ложа;
III группа – 11 беременных и рожениц, которым выполнялась лапароскопическая миомэктомия с коагуляцией ложа.
Все беременные были госпитализированы в отделение патологии беременных в плановом порядке при сроке 38–39 нед и прошли полный курс обследования. С целью исключения риска разрыва матки по рубцу, проводилась пальпация нижнего сегмента и динамическое ультразвуковое исследование. При этом достоверных отличий толщины нижнего сегмента у пациенток без рубца на матке и у пациенток I и II групп, обнаружено не было (табл. 1). В то же время имелись эхографические различия толщины рубца у пациенток с рубцом на матке после предшествующей лапароскопической миомэктомии с коагуляцией ложа (III группа).
Таблица 1. Сравнительные данные толщины нижнего сегмента в I периоде родов у пациенток с рубцом на матке после миомэктомии (мм).
Роды через естественные родовые пути произошли у 35 пациенток, что составило 51,5%;
повторная операция кесарева сечения проведена 33 пациенткам (48,5%). В структуре показаний
к экстренному абдоминальному родоразрешению во всех группах превалировали аномалии родовой деятельности: 45,4%, 46,1 и 33,3% соответственно в I–III группах (табл. 2). При этом в III группе пациенток угрожающий разрыв матки явился показанием к абдоминальному родоразрешению в 33,3% случаев, в то время как у рожениц I и II групп – почти в 2 раза реже.
Таблица 2. Показания для экстренного абдоминального родоразрешения у рожениц с рубцом на матке после миомэктомии.
Учитывая медико-социальную значимость миомы, необходима комплексная реабилитация после миомэктомии. Патогенетический подход диктует необходимость проведения гормональной коррекции с помощью гормональных препаратов с антиминералокортикоидным действием. К таким средствам относится новый комбинированный оральный контрацептив мидиана (Гедеон Рихтер, Венгрия), содержащий 30 мкг этинилэстрадиола и 3 мг дроспиренона. Дроспиренон блокирует переход альдостерона в ренин и ангиотензиноген, способствуя уменьшению объема плазмы, риска гипертензии и симптомов задержки жидкости в организме женщины.
В связи с этим с 2011 г. на кафедре акушерства и гинекологии лечебного факультета НГМУ проводится сравнительное изучение влияния мидианы на течение послеоперационного периода после миомэктомии и на инволюцию матки. Проведено комплексное обследование 60 женщин, которые
были рандомизированы в 2 группы:
Основная группа – 30 женщин, которым в комплексной терапии после лапаротомической миомэктомии назначали контрацептив мидиана.
Контрольная группа – 30 женщин, которым после оперативного вмешательства гормональная коррекция не проводилась.
У каждой третьей обследованной пациентки выявляли хроническое воспаление придатков матки, у каждой десятой – эндометриоз и гиперплазию эндометрия. Практически половина пациенток были в возрастной группе 36–41 год – 45 и 50% соответственно; каждая четвертая – моложе 30 лет, планирующая реализацию репродуктивной функции. Репрезентативная выборка была сопоставима (p>0,05) по возрасту, числу узлов, диаметру доминантного узла (табл. 3).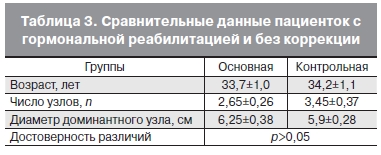
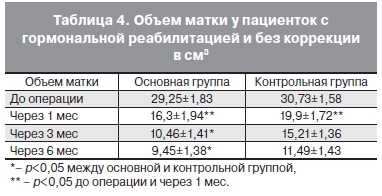
Основные преимущества мидианы были зарегистрированы при ультразвуковой оценке инволюции послеоперационной матки. Уже через 3 мес от начала приема препарата длина тела оперированной матки и ее передне-задний размер были достоверно меньше, чем в контрольной группе, что свидетельствовало о более быстрой инволюции органа. В то же время измерение ширины матки спустя полгода от начала лечения не выявило достоверных отличий в показателе сравниваемых групп. Это указывало на то, что послеоперационный отек матки уже купировался, поскольку прошло достаточное количество времени. Тем не менее сравнение объемов матки в двух группах убедительно показало ощутимые преимущества мидианы в плане уменьшения симптомов задержки жидкости и в организме (потеря массы тела на 1,6 кг), и в матке в частности (табл. 4). Кроме того, у 17 (89,4%) из 19 пациенток после приема препарата мидиана в 6 раз уменьшилась масталгия; у 10 (83,3%) из 12 снизилось напряжение молочных желез. Без гормональной коррекции только у каждой пятой – 4 (22,2%) из 18 пациенток происходило улучшение качества жизни в виде исчезновения масталги и лишь у каждой шестой – 2 (15,3%) из 13 купировалось напряжение молочных желез.
Заключение
Таким образом, в отдаленные сроки после миомэктомии структура рубца матки не зависит от
хирургического доступа, если проводилось ушивание ложа миомы двурядными швами. В то же
время коагуляция ложа миомы при лапароскопической энуклеации недопустима. Проведенные
исследования показали принципиальную целесообразность гормональной реабилитации дроспиренонодержащим контрацептивом (мидиана) после миомэктомии. Незначительные и быстро проходящие побочные действия с успехом компенсировались качественной инволюцией матки, что создает благоприятные условия для полноценного заживления рубца и открывает новые возможности к самопроизвольным родам после консервативно-пластических операций.



