На сегодняшний день очевидна тенденция увеличения количества беременных женщин с миомой матки. Причин роста числа беременных с миомой матки может быть, как минимум, две. Первая, связана с дебютом заболевания в более молодом возрасте, вторая – с увеличением возраста перво- и повторнобеременных, что ставит акушерам-гинекологам задачу вынашивания и сохранения беременности у женщин с миомой матки [1–3]. При этом, все чаще приходится решать вопрос тактики ведения таких пациенток на этапе прегравидарной подготовки. Каждое клиническое наблюдение позволяет прогнозировать риск возможных осложнений в других похожих случаях и способствует профилактике репродуктивных потерь [4].
Миома матки – доброкачественная моноклональная опухоль, происходящая из гладкомышечных клеток шейки или тела матки. Известно, что образование и рост опухоли неразрывно связаны со сложным взаимодействием между стероидными гормонами и чувствительными к ним рецепторами, которые оказывают влияние на процессы пролиферации, апоптоза и ангиогенеза [5]. С началом беременности меняется содержание половых стероидных гормонов в локальном кровотоке матки. Увеличение размеров узлов в первые 8 недель беременности может быть связано с клеточной гиперплазией и гипертрофией. Изменение объема узлов в более поздние сроки беременности чаще всего связано с отеком ткани, нарушениями гемо- и лимфодинамики, деструктивными изменениями и некрозом вследствие блокировки клеточной гиперплазии и гибели миоцитов в центральной зоне узлов [6–8].
Известно, что экспрессия рецепторов CD34, Ki67 напрямую коррелирует со степенью активности пролиферации в миоматозном узле. Так, повышенную экспрессию факторов пролиферации можно рассматривать как критерий прогноза рецидива миомы у пациенток репродуктивного возраста [9].
Все осложнения миомы матки во время беременности можно условно разделить по триместрам беременности. В I триместре самыми частыми осложнениями являются рост миомы, угроза прерывания беременности, кровотечение; во II триместре – быстрый рост миомы с возможным нарушением кровообращения в узлах, аномальное расположение плаценты с повышенным риском ее преждевременной отслойки, развитие плацентарной и истмико-цервикальной недостаточности; в III триместре беременности возможно формирование неправильного положения и предлежания, гипоксии плода, преэклампсии [10, 11].
Большинству беременных с миомой матки не требуется проведение дополнительного обследования и лечебных мероприятий, так как миома не оказывает неблагоприятного воздействия на течение гестации. Однако, у ряда пациентов возможно развитие осложнений [12–15].
Одним из осложнений у беременных с миомой матки является некроз миоматозного узла, клинически проявляющийся болевым синдромом.
Сильная локализованная боль в животе может возникнуть, если миома претерпевает так называемую «красную дегенерацию», перекрут (чаще всего наблюдаемый при субсерозной миоме). Некроз является самым частым осложнением миомы во время беременности и, в основном, наблюдается у женщин с большим диаметром узлов (> 5 см) во II и III триместрах беременности. Для объяснения сильной боли, связанной с красной дегенерацией, были предложены три основные теории. Первая – быстрый рост миомы приводит к тому, что снижается адекватное кровоснабжение узла, что приводит к некрозу и инфаркту тканей. Вторая – растущая матка приводит к изменению кровоснабжения миомы, что приводит к ишемии и некрозу даже при отсутствии роста миомы. Третья – боль возникает в результате высвобождения простагландинов вследствие клеточного повреждения миомы [7, 12, 16].
Показаниями к миомэктомии во время беременности являются: некроз миоматозного узла; перекрут ножки узла миомы; развитие перитонеальных симптомов [17].
Требованиями для проведения миомэктомии во время беременности являются:
- срок гестации 15–19 недель (достижение минимальных рисков для матери и плода);
- оперативный доступ: нижнесрединная лапаротомия;
- выделение миомы тупым или острым путем;
- тщательный гемостаз, наложение двух слоев узловых швов викриловой нитью номер 2/0;
- дренирование брюшной полости по показаниям [10].
Большинство авторов сходятся во мнении о необходимости использования нижнесрединного лапаротомного доступа. Другие доступы описываются реже. Так, Баринов С.В. и соавт. (2019) в своей работе предложил проведение поперечного надлобкового разреза передней брюшной стенки при низко расположенных узлах [18].
Сложности и риски оперативного лечения зависят от локализации узла. Так, по данным Буяновой С.Н. с соавт. (2019) проведение миомэктомии при расположении плаценты на миоматозном узле или на 2/3 ее площадки возможно, если толщина миометрия между узлом и полостью матки не менее 5 мм [2].
Минуллина Ф.Ф. и соавт. (2021) описали возможность использования параректального лапаротомного доступа. Свой выбор коллеги обосновали локализацией узла (миома исходила из левого ребра матки в сторону левого подреберья) [19].
Оперативное лечение миомы матки во время беременности не является рутинной операцией, каждый клинический случай представляет профессиональный интерес, а обмен опытом с коллегами является важной составляющей накопления знаний и компетенций. Отсюда, желание поделиться собственным опытом с другими докторами.
Клиническое наблюдение
Пациентка Л., 33 лет, обратилась в ООО «Клиника профессора Буштыревой» (далее – Клиника) в сроке беременности 7 недель. Настоящая беременность первая, осложненная в I триместре рвотой беременных легкой степени. Диагноз миомы матки впервые установлен в 2016 г.; в 2017, 2019 гг. были проведены гистерорезектоскопии с удалением полипов полости матки. При выполнении ультразвукового исследования (УЗИ) установлено: маточная беременность 7 недель, особенность строения матки (седловидная), миома матки (по правому ребру субсерозный миоматозный узел с признаками кистозной дегенерации, размерами 69 мм, ширина основания 27 мм, по передней стенке в нижней трети субсерозный узел диаметром 8 мм). По результатам ультразвукового исследования в 12 недель 3 дня размеры узлов составили 82 и 27 мм. По данным генетического скрининга I триместра – индивидуальный риск по трисомии 21 1:15859, трисомии 18 – <1:20000, трисомии 13 – <1:20000. В 15 недель беременности пациентку стали беспокоить постоянные острые боли внизу живота, больше справа. Выполнено УЗИ: фетометрические показатели соответствовали 15 неделям 5 дням, предполагаемая масса плода 137 г, длина шейки матки 38 мм, внутренний зев закрыт. По правому ребру матки лоцировался субсерозный миоматозный узел диаметром 86 мм с четкими контурами и неоднородным гетерогенным внутренним строением в виде хаотичных анэхогенных, гипоэхогенных и нормоэхогенных структур с нечеткими контурами неправильной формы. При энергетическом допплеровском картировании кровоток внутри узла не определялся, что по совокупности эхографических знаков соответствует деструктивным изменениям и некрозу узла. Также по передней стенке определялся интерстициально-субсерозный миоматозный узел диаметром 27 мм гипоэхогенной эхоплотности.
Результаты общего анализа крови: эритроциты – 4,6×1012/л, гемоглобин – 140 г/л, тромбоциты – 250×109 г/л, лейкоциты – 10×109/л, нейтрофилы – 78%, эозинофилы – 1%, базофилы – 0,3%, моноциты – 8,4%, лимфоциты – 12,3%, СОЭ – 30 мм/ч, С-реактивный белок – 45 мг/л.
Врачом акушером-гинекологом выставлен предварительный диагноз: беременность 16 недель, миома матки больших размеров, осложненная болевым синдромом.
Учитывая клинические данные (постоянные острые боли внизу живота, больше справа), данные анамнеза (миома матки с 2016 г.), данные УЗИ, принято решение об оперативном лечении, запланирована лапаротомия по Пфанненштилю, консервативная миомэктомия. Важно отметить, что выбор в пользу хирургической тактики во время беременности всегда является непростым. Выбор оперативного доступа – также дилемма. Наиболее распространена нижнесрединная лапаротомия. При этом, поперечный доступ является более физиологичным, косметическим и одновременно сложным в исполнении.
Пациентка осмотрена анестезиологом, определен выбор анестезиологического пособия.
Описание операции: под спинальной аналгезией после трехкратной обработки хирургического поля бетадином, лапаротомическим доступом по Пфанненштилю послойно вскрыта брюшная полость. Ревизией установлено: матка увеличена до 16 недель беременности за счет беременности, в нормотонусе. По задней стенке ближе к нижней трети матки определяется субсерозный миоматозный узел диаметром 8 см (рис. 1). Правая и левая маточные трубы не изменены, фимбрии выражены. Правый яичник размерами 4×2 см с обычной белочной оболочкой, левый яичник размерами 3,5×2 см с обычной белочной оболочкой. По наибольшему полюсу узла по задней стенке произведен продольный разрез, вылущен субсерозный миоматозный узел с вторичными изменениями без вскрытия полости матки, затем из толщи миометрия по продолжению ложа удаленного узла удален миоматозный узел 2,5 см, ложе ушито отдельными викриловыми швами. Миоматозные узлы отправлены на гистологическое исследование (рис. 2). Выполнено дренирование брюшной полости через контрапертуру справа дренажной трубкой Ch/Fr 30. Брюшная стенка восстановлена, ушита послойно. Кровопотеря составила 500 мл. Интраоперационно введен цефазолин 2 г внутривенно однократно. В раннем послеоперационном периоде введен трамадол 2,0 внутримышечно однократно на 1-е сутки после операции.
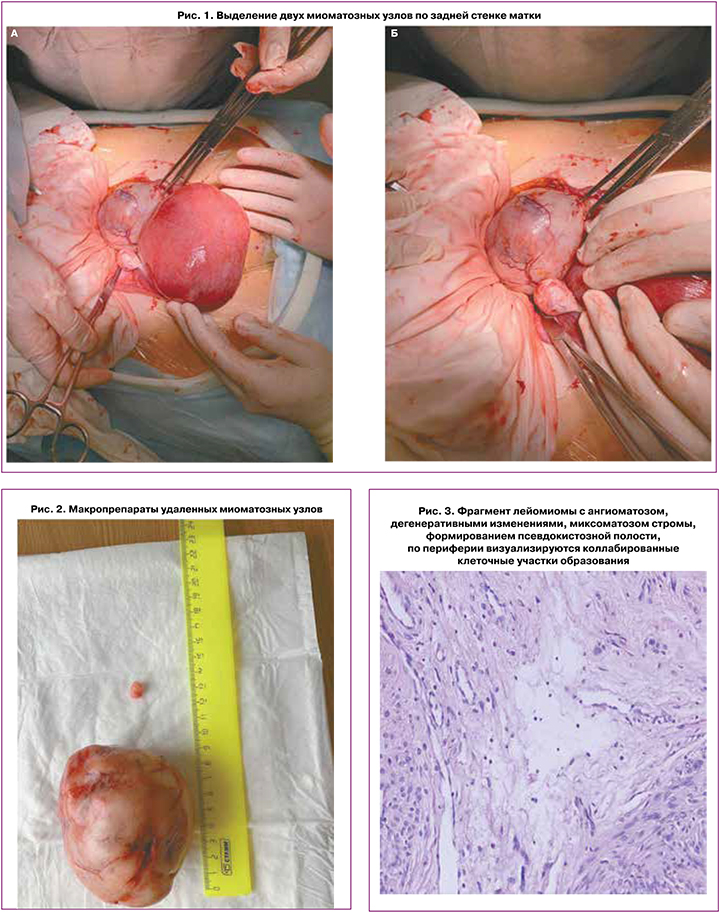
На следующий день после хирургического вмешательства проведено контрольное УЗИ: беременность 16 недель 1 день, в области послеоперационного рубца определяется зона сниженной эхогенности с гиперэхогенными включениями в месте наложения лигатур. Объемных образований, свободной жидкости в заднем своде не обнаружено. Пациентка выписана в удовлетворительном состоянии на 1-е сутки под наблюдение врача акушера-гинеколога с рекомендациями: половой и физический покой, гестагеновая поддержка (дюфастон по 10 мг 3 раза в день).
При гистологическом исследовании выявлена разнообразная картина строения миоматозных узлов, превалировали дегенеративно-дистрофические изменения над сохранной паренхимой в соотношении примерно 3:1, основными проявлениями которых были: центральный некроз узла с кровоизлияниями, скудной воспалительной инфильтрацией, миксоматозная дегенерация стромы с хаотичным расположением волокон, явлениями апоптоза и некробиоза миоцитов (рис. 3). В периферической зоне – дискомплексированная строма с явлениями склероза разной степени выраженности, наличием периваскулярных зон роста с фокусами гиперклеточности, единичными митозами, полиморфизмом отдельных групп клеток (рис. 4).
В сохранной паренхиме и в зоне псевдокапсулы определялось обилие сосудов с щелевидным просветом (рис. 5), что четко подтверждалось при визуализации яркой экспрессией CD34 (рис. 6).
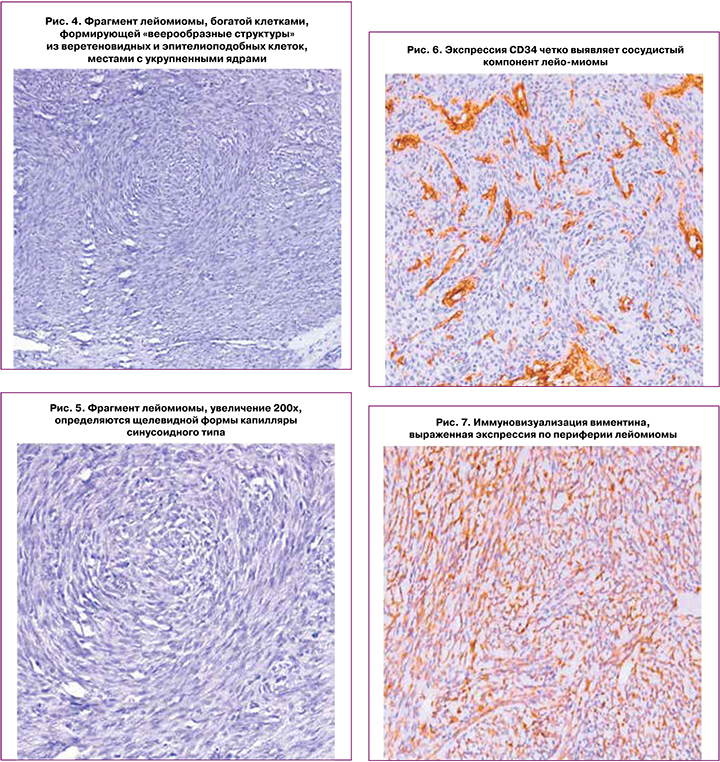
Иммуногистохимически в удаленных лейомиомах выражена экспрессия виментина перифокально вокруг некротизированных участков (рис. 7). В периваскулярных зонах роста с повышенной гиперклеточностью и митотической активностью выявлена низкая экспрессия Ki67 (рис. 8), что подтверждает доброкачественность процесса, несмотря на относительный полиморфизм узлов при обычной окраске, вероятнее всего связанный с реакцией на дегенеративно-дистрофические и некротические изменения в лейомиомах.
 В динамике амбулаторного наблюдения в сроке беременности 23 недели 5 дней выполнено УЗИ: нарушений гемодинамики не выявлено, состояние после консервативной миомэктомии. Область послеоперационного рубца на матке: зона гипоэхогенной эхоплотности, толщина рубца 4 мм, при энергетическом допплеровском картировании определялся кровоток. Пациентка осмотрена акушером-гинекологом, даны рекомендации.
В динамике амбулаторного наблюдения в сроке беременности 23 недели 5 дней выполнено УЗИ: нарушений гемодинамики не выявлено, состояние после консервативной миомэктомии. Область послеоперационного рубца на матке: зона гипоэхогенной эхоплотности, толщина рубца 4 мм, при энергетическом допплеровском картировании определялся кровоток. Пациентка осмотрена акушером-гинекологом, даны рекомендации.
В III триместре проведено УЗИ: беременность 32 недели, головное предлежание, рубец на матке после миомэктомии, нарушений гемодинамики не выявлено. Толщина рубца на момент проведения исследования составляла 3 мм, при энергетическом допплеровском картировании определялся кровоток. Консультирована акушером-гинекологом, даны рекомендации по дальнейшему ведению.
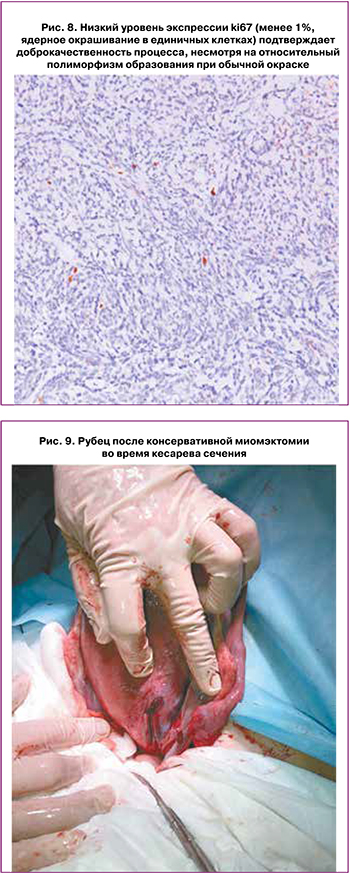
План родоразрешения: учитывая наличие отягощенного акушерско-гинекологического анамнеза (первичное бесплодие, миома матки в анамнезе), рубец на матке после миомэктомии, принято решение о плановом оперативном родоразрешении в 38 недель путем операции кесарева сечения в нижнематочном сегменте. Родился живой доношенный новорожденный женского пола массой 2700 г, длиной 46 см, оценка по шкале Апгар 10/10 баллов. Через 1 минуту после извлечения с целью профилактики гипотонического кровотечения введен пабал 1,0. Послед из полости матки удален тракциями за пуповину. Сгустки и остатки децидуальной ткани удалены стерильной марлевой салфеткой. Плацентарная площадка расположена по задней стенке матки. На углы маточной раны наложены отдельные викриловые швы. Полость матки осушена стерильной салфеткой, обработана раствором хлоргексидина. Стенка матки ушита двурядным непрерывным викриловым швом (рис. 9).
Матка сократилась, плотная. Перитонизация за счет пузырно-маточной складки. Осмотр органов малого таза: без особенностей. На кожу наложен косметический шов. Общая кровопотеря – 700 мл. Моча по постоянному катетеру – светлая, ≈ 100 мл. Послеоперационный период протекал без особенностей. Пациентка выписана с рекомендациями на 3-и сутки.
Обсуждение
Миома матки при беременности может давать осложнения, которые иногда требуют хирургического лечения. Согласно клиническим рекомендациям [17], выбор оперативного доступа следует проводить в пользу нижнесрединной лапаротомии. В представленном клиническом наблюдении пациентке проведено оперативное вмешательство с использованием поперечного надлобкового разреза. Выбор такого оперативного доступа аргументирован меньшей травматичностью, хорошим косметическим эффектом, а также сроком гестации 16 недель, при котором возможно эффективное удаление миоматозных узлов по задней стенке матке. Соблюдение требований и техники операции позволяет минимизировать возможные риски для матери и плода.
Заключение
Увеличение заболеваемости миомой матки женщин репродуктивного возраста ставит перед акушерами-гинекологами задачу вынашивания беременности. Именно, поэтому, важен персонифицированный подход к ведению беременности на фоне миомы матки. Беременные с миомой матки больших и гигантских размеров, с миомой матки на ножке, должны наблюдаться в учреждениях, где возможно проведение органосохраняющих операций с последующим пролонгированием беременности. Оперативному лечению подлежат те миоматозные узлы, которые представляют реальную угрозу для успешной пролонгации беременности (сдавливание смежных органов, признаки некроза или перекрута узла). Таким образом, существует проблема «два в одном» – удаление узла, препятствующего прогрессированию беременности, и сохранение беременности, что является важным и сложным этапом, требующим единства специальности акушерства и гинекологии.



