В 2008 г. благодаря работе немецких ученых во главе с Гарольдом Цур Хаузеном весь мир узнал о причастности вируса папилломы человека (ВПЧ) к развитию рака шейки матки (РШМ). Это открытие послужило поводом для огромного числа новых исследований в области эпидемиологии папилломавирусной инфекции (ПВИ), поиска методов профилактики и лечения неопластических образований различной локализации, обусловленных этим вирусом.
Папилломавирус широко распространен во всем мире и наиболее часто поражает молодых сексуально активных мужчин и женщин уже в первый год после начала половой жизни [1]. В ряде работ было показано, что у молодых женщин, примерно в 50% случаев, происходит спонтанная элиминация вирусной ДНК в течение 12 мес и у 80–85% – в течение последующих 3–5 лет [2–4]. Однако в ряде случаев инфекция сохраняется в организме длительное время и приводит к предраковым изменениям и, в конечном итоге, РШМ.
РМШ развивается менее чем у 1% инфицированных женщин. Тем не менее данный вид рака занимает второе место после опухолей молочной железы по количеству летальных исходов [5]. Риск развития РШМ связывают с такими факторами, как раннее начало половой жизни, число и частота смены половых партнеров, наличие сопутствующих половых инфекций и иммунодефицитных состояний, курение, длительный прием экзогенных эстрогенов, наличие беременностей в раннем возрасте, тип ВПЧ и уровень вирусной нагрузки [6, 7]. Наиболее часто тяжелые интраэпителиальные поражения и РШМ, обусловленные ПВИ, встречаются в возрастной группе женщин старше 35 лет, а распространенность ВПЧ с возрастом снижается. В молодом возрасте отмечается обратная тенденция – высокая распространенность ПВИ и низкая частота тяжелых цервикальных интраэпителиальных неоплазий (ЦИН) и РШМ. Этот факт объясняет возраст начала скрининга на РШМ в большинстве стран мира у женщин старше 30 лет и малую целесообразность скринингового исследования на ВПЧ в более молодой возрастной группе. Однако в современных условиях женщины имеют возможность самостоятельно обследоваться на инфекции, передающиеся половым путем (ИППП), в том числе и ПВИ и при позитивных тестах обратиться к врачу для назначения лечения. Отсутствие четких рекомендаций по ведению молодых женщин с ВПЧ и ЦИН часто приводит к выбору неоправданно радикальных методов лечения, в то время как большинство подобных состояний регрессирует самостоятельно без терапии. Самым опасным в отношении малигнизации состоянием признана персистирующая форма ПВИ, при этом эффективных методов прогноза ее течения пока нет. Согласно многочисленным мировым исследованиям, наиболее часто при тяжелых интраэпителиальных поражениях и РМШ встречаются 16 и 18 типы папилломавируса, распространенность различных типов вируса варьируется в зависимости от региона.
Многочисленными исследованиями доказана эффективность профилактической вакцины против РШМ, но высокоэффективной специфической противовирусной терапии в отношении ПВИ на сегодняшний день не существует. Во многих странах мира идет поиск возможности создания терапевтической вакцины против ВПЧ и РМШ, в основе принципа действия которых лежит активация специфического ответа иммунной системы на измененную антигенную структуру онкобелков Е6 и Е7 [8–10]. Определенную нишу в лечении ВПЧ- ассоциированных заболеваний заняли неспецифические противовирусные и иммуномодулирующие препараты, эффективность и безопасность которых продолжают изучать.
При выборе метода лечения врач всегда стремится руководствоваться следующими принципами: эффективностью, безопасностью, удобством применения и отсутствием выраженных побочных эффектов. Этим требованиям сегодня отвечает производное корня солодки, препарат глицирризиновой кислоты эпиген интим спрей.
Целебные свойства солодки известны с древних времен. Особенно широко это средство применялось в Древнем Китае и остается незаменимым по сегодняшний день. Основными биологически активными компонентами корня солодки являются тритерпеновые сапонины и флавоноиды. Современные исследования показали, что производные солодки обладают антимикробной активностью в отношении грам+ и грамм- бактерий [11], оказывают противовирусное действие и являются мощными ингибиторами ВИЧ в лабораторных условиях [12]. Солодка также оказывает защитное действие на пищеварительную и нервную системы, обладает заживляющим и противоопухолевым эффектами, благоприятно воздействует на эндокринную систему [13]. Хорошо известны ее свойства как природного антиоксиданта.
Целью исследования явилось изучение эффективности применения препарата глицирризиновой кислоты у молодых женщин с персистирующей ПВИ для стимуляции элиминации ВПЧ.
Материал и методы исследования
В рамках профилактического осмотра были обсле- дованы 460 девушек-студенток в возрасте от 18 до 30 лет (средний возраст 22,4 года) на наличие ПВИ высокого канцерогенного риска с одновременным забором материала для цитологического исследования. Через 10–16 мес (в среднем 12,7 мес) после первичного забора проб 91 пациентка из числа ВПЧ-позитивных обследована повторно. Повторное выявление одних и тех же типов ВПЧ являлось критерием постановки диагноза «персистирующая ПВИ». Из 56 человек с персистирующей ПВИ были отобраны 25 молодых женщин в возрасте от 18 до 25 лет (средний возраст 23,1 года) которым был назначен препарат глицирризиновой кислоты интравагинально сроком на 3 мес. Группу контроля составила оставшаяся без лечения 31 девушка (средний возраст 22,7 года), не получавшая лечения.
Определение вирусной ДНК проводили с помо- щью отечественной тест-системы «Амплисенс ВПЧ ВКР скрин-титр FRT» в режиме «реального времени» с количественным определением 13 типов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59,
68) ВПЧ. Также всем девушкам были выполнены расширенная кольпоскопия, исследование состояния микроценоза влагалища и цитологическое исследование мазков с экзо- и эндоцервикса, окрашенных по методу Папаниколау (ПАП-тест). Критериями включения в группу исследования были: положительный ВПЧ-тест с клинически значимым присутствием вируса более 3,0 log, ПАП-тест с изменениями не более LSIL (интраэпителиальные поражения плоского эпителия легкой степени, включающие ЦИН 1 степени и признаки субклинической ПВИ), отсутствие беременности на момент включения и письменное согласие пациентки на участие в исследовании. Всем участницам исследования был назначен препарат глицирризиновой кислоты эпиген интим спрей интравагинально по 1–2 впрыска 2 раза/сут в течение 2 нед с последующим 2-недельным перерывом на протяжении 3 мес.
Оценка результатов (осмотр, кольпоскопия, оценка микроценоза, ВПЧ-тестирование) проводили через 3 и 6 мес от начала терапии, ПАП-тест – через 6 мес. Через 3 мес из исследования была исключена 1 пациентка по причине наступившей беременности, через 6 мес на контроль не явились еще 4 пациентки. Таким образом, результат через 6 мес был оценен у 20 человек в группе, получавшей лечение эпигеном и 31 жен- щина контрольной группы.
Результаты и обсуждение
В нашем исследовании, по результатам ПЦР- тестирования 460 молодых женщин, распростра- ненность типов ВПЧ распределилась следующим образом: наиболее часто выявлялись 16, 51 и 39 типы (табл. 1), частота 18 типа составила 9,5% и оказалась сопоставима с ранее считавшимся редким 68 типом ВПЧ (12,1%).
Таблица 1. Распространенность различных типов ВПЧ среди молодых женщин (n=460).
Общая распространенность ВПЧ среди 460 обследованных девушек-студенток (основная популяция) составила 142 (30,9%). У девушек с нормальной цитологией (n=185) распространен- ность ВПЧ составила 15,1%, у пациенток с LSIL (n=130) – 85,4%.
В ряде научных исследований было показано, что у молодых женщин примерно в 50% случаев происходит спонтанная элиминация ВПЧ и регресс клинических проявлений в течение 12 мес и у 80–85% – в последующие 3–5 лет [2, 3].
Через 10–16 мес после первичного выявления ВПЧ высокого риска мы повторно протестировали 91 пациентку на наличие вируса и изменений цитологии. У 17 (48,6%) женщин исходно выявлялся 16 тип вируса (у 15 человек – моноинфекция, у 2 человек – в сочетании с 59 и 31 типами ВПЧ), у двоих было моноинфицирование 58 и 33 типами, остальные имели сочетание двух и более типов 31, 33, 39, 51, 52, 53, 56, 58. Элиминация вирусной ДНК в течение года произошла у 35 (38,5%) молодых женщин. Тем не менее интраэпителиальные поражения плоского эпителия легкой степени (LSIL) сохранялись у 12 (34,3%) человек, что, возможно, связано с сохраняющейся воспалительной реакцией или наличием других, более редких типов ВПЧ.
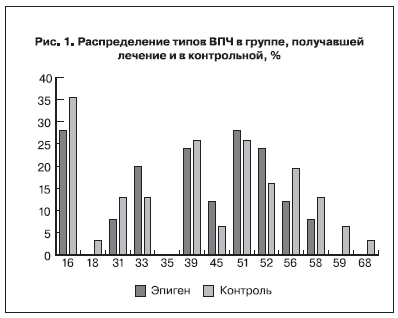
Наиболее часто в обеих группах (исследуемой и контрольной) встречались 16, 51, 52, 39 типы ВПЧ (рис. 1, см. на вклейке). Монотипы вируса выявлены у 15 (60%) человек группы исследования и у 17 (54,8%) – контрольной. В остальных случаях присутствовало несколько типов вируса (от двух до пяти).
При оценке жалоб и данных визуального осмотра в ходе исследования были получены следующие результаты, представленные в табл. 2.
Таблица 2. Оценка результатов применения препарата глицирризиновой кислоты у женщин с персистирующей ПВИ.
Таблица 3. Результаты ПАП-теста через 6 мес на фоне лечения препаратом глицирризиновой кислоты по сравнению с группой контроля.
Выявлено, что на фоне лечения препаратом глицирризиновой кислоты в течение 3 мес число больных, предъявлявших жалобы на периодические зуд, жжение и/или обильные выделения из влагалища уменьшилось почти в 2 раза (с 28 до 16,7%) и по истечении 6 мес подобные жалобы сохранились только у 2 (10%) человек. В группе женщин, не получавших лечения, количество человек с жалобами в течение года достоверно не изменилось.
Также отмечен стойкий противовоспалительный эффект препарата, о чем свидетельствует снижение числа пациенток с симптомами цервицита более чем в 2 раза на фоне лечения и сохранение терапевтического эффекта через 3 мес после отмены лечения (p<0,05). В группе контроля также произошло снижение числа женщин с симптомами цервицита в течение 6 мес на 16,1%, (p>0,05). На фоне лечения отмечено достоверное снижение атипических изменений при кольпоскопии с 40 до 16%, что, вероятно, также связано с противовоспалительным действием препарата.
По результатам ПАП-теста, улучшение цитологической картины до нормы в группе, получавшей лечение препаратом глицирризиновой кислоты, отмечено у 29% пациенток по сравнению с исходными данными, что достоверно чаще, чем в контрольной группе (3,2%). Положительная динамика связана в первую очередь с уменьшением более чем в 2 раза количества мазков воспалительного типа и атипии плоских клеток неясного значения (ASCUS). В группе контроля не выявлено достоверных различий между исходными результатами ПАП-теста, выполненного через 10–16 мес после первичного выявления вируса и через 6 мес наблюдения (табл. 3).
Элиминация вирусной ДНК наблюдалась у 6 (24%) из 25 женщин на фоне 3 мес лечения и через 6 мес – еще у 4, что в целом составило 10 (40%) женщин. В группе контроля элиминация ВПЧ через 6 мес произошла у 9 (29%) из 31 пациентки. Таким образом, на фоне терапии препаратом глицирризиновой кислоты отмечена более значительная (p>0,05) элиминация вируса, чем в группе пациенток, не получавших противовирусной терапии, что косвенно свидетельствует о противовирусной активности.
Таким образом, для молодых женщин характер на высокая распространенность ВПЧ-инфекции(30,9%) даже при нормальной цитологии (15,1%). При этом ВПЧ самостоятельно элиминируется в течение года более чем у трети (38,5%) ВПЧ- позитивных пациенток. Однако на фоне элиминации вирусной ДНК сохраняется достаточно высокий процент женщин с цитологическими признаками интраэпителиальных поражений легкой степени (LSIL), что можно объяснить сопутствующей воспалительной реакцией, значительно затрудняющей трактовку цитологических результатов, и расхождение заключений при оценке разными специалистами. Эта группа женщин требует дальнейшего наблюдения и, в ряде случаев, назначения противовоспалительной терапии по показаниям.
Известно, что шейка матки имеет свои клинические и морфофункциональные особенности в различные возрастные периоды жизни женщины. Для возникновения ПВИ значимыми факторами риска являются эктопия и бактериальный вагиноз [14]. Эктопированный цилиндрический эпителий встречается более чем у 50% молодых женщин и в 80% случаев сопровождается признаками цервицита [15].
Известно, что воспалительные процессы в экзо- и эндоцервиксе могут быть вызваны возбудителями неспецифической и специфической этиологии (ИППП). Хронический воспалительный процесс шейки матки влияет на процессы метаплазии при эктопии (меняется пролиферация и дифференцировка резервных клеток) и в ряде случаев может быть фактором риска развития дисплазии при наличии инфицирования ВПЧ. При нарастании агрессивности антигенного воздействия на слизистую оболочку шейки матки (грибы, простейшие, бактерии, папилломавирусы) у больных хроническим экзоцервицитом прогрессируют деструктивные изменения эпителиоцитов эндо- и экзоцервикального типа, затрагивающие ядро, органеллы и цитоплазматические отростки [16]. При цитологическом исследовании подобные изменения могут быть диагностированы как LSIL. Параллельно развивается вторичный местный дефицит клеточных и гуморальных иммунных реакций.
На фоне адекватной противовоспалительной терапии реактивные и начальные диспластические изменения в большинстве случаев регрессируют, что позволяет более адекватно оценить цитологические мазки и данные кольпоскопии.
Выводы
При наличии у молодых женщин ВПЧ высокого канцерогенного риска и интраэпителиальных поражений шейки матки легкой степени (LSIL) применение препарата глицирризиновой кислоты в течение 3 мес создает благоприятные условия для элиминации ПВИ и регресса цитопатологических проявлений. Препарат глицирризиновой кислоты обладает выраженным противовоспалительным эффектом, что существенно улучшает кольпоскопическую диагностику и способствует более точной цитологической верификации клинических проявлений ВПЧ- инфекции.
Препарат глицирризиновой кислоты эпиген интим спрей можно обоснованно рекомендовать для лечения ПВИ у молодых женщин на этапе диагностики и в процессе диспансерного наблюдения при интраэпителиальных поражениях легкой степени. Требуются дальнейшие исследования для отработки схем профилактического лечения.



