Лейомиома матки, моноклональная, фиброзно-мезенхимальная доброкачественная опухоль, влияет на здоровье более 20% женщин репродуктивного возраста и затрагивает более 50% в пременопаузальном возрасте [1]. Болезнь длительно протекает практически бессимптомно и обнаруживается лишь при ультразвуковом исследовании органов малого таза, однако это одна из наиболее частых проблем женщин с жалобами на гиперполименорею и слабость, обращающихся за помощью к врачу [2]. По данным статистических отчетов США, лейомиома является основной причиной операций у 38,1% женщин в возрасте от 18 до 40 лет и у 67% – в возрасте старше 45 лет. Соотношение радикальных и органосохраняющих операций обычно составляет 6 к 1 [3].
Гетерогенность и неопределенность причин роста лейомиомы матки (аутокринные и паракринные факторы роста, генетические аномалии, расовые и экологические особенности) не позволяют предложить единое патогенетическое лечение больным [4, 5]. Это обусловливает отсутствие органосохраняющего метода со 100% положительным результатом, недоверие многих врачей к медикаментозной терапии, частые радикальные операции по удалению органа. Мультифокальность узлов не позволяет добиться удовлетворительных результатов лечения даже после миомэктомии или эмболизации артерий, оставляя в последующие 3 года 21,4% кумулятивного риска рецидива [6, 7]. Эффективность до 50–70% показали агонисты GnRH и даназол, однако их выраженный недостаток – гипоэстрогения, нежелательные побочные эффекты и частые рецидивы роста узлов ограничивают их широкое применение [8, 9]. Обобщенные молекулярные исследования механизма роста лейомиомы продемонстрировали, что в большинстве наблюдений «…поддержание пролиферации миометрия зависит от активации прогестероном своих рецепторов» в основном во вторую фазу менструального цикла, то есть при высоком уровне прогестерона [10]. Повышенную пролиферативную активность, гиперэкспрессию Ki67 в миометрии за счет геномных эффектов прогестерона в конце секреторной и лютеиновой фазе цикла подтверждают еще несколько последних работ [11–14]. Пролиферация зависит от уровня прогестерона и числа его рецепторов, изменения гормонов могут приводить к стимуляции ростовых факторов, воспалению, фибролизу, спазму артериол и изменению внеклеточного матрикса, что является субстратом для прогрессии роста узлов [15]. Поэтому действие антипрогестинов, блокирующих транскрипторные механизмы активации, имеет хороший таргентный эффект по остановке роста лейомиомы, что мы наблюдаем в клинике [16, 17]. Более 50 научных работ убедительно демонстрируют перспективу медикаментозной стабилизации роста миоматозных узлов небольших размеров с помощью самого изученного антипрогестина – мифепристона [18]. В качестве терапевтического средства для лечения миомы матки препарат был изучен в различных режимах: дозировки от 5 до 50 мг, длительность приема от 3 до 12 мес [19, 20]. Все режимы терапии показали хорошую переносимость лечения и безопасность (побочные эффекты не превышали 4%, включая незначительное повышение трансаминаз) [21, 22]. Ультразвуковая визуализация утолщенного и неоднородного эндометрия при длительном приеме мифепристона морфологически соответствовала кистозной, апоптотической (неактивной) дегенерации эндометрия, с его своеобразной атрофией, но без изменения стромы [23]. Антипрогестероновая активность мифепристона (RU 486) используется уже более 20 лет в различных клинических ситуациях, в том числе и в медикаментозном лечении лейомиомы, за счет его способности к десенситизации прогестероновых рецепторов, преобладающих в измененных миоцитах [24]. Клинические данные свидетельствуют об уменьшении размеров матки и миоматозных узлов от 26 до 74% объема, а также о высоком уровене контроля над симптомами болезни у 96% больных [25], что выводит препарат в первую линию терапии больных миомой матки, однако требует продолжения исследований по совершенствованию режимов.
 Материал и методы исследования
Материал и методы исследования
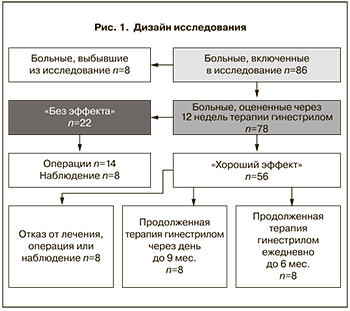
Исследование по изучению препарата гинестрил (мифепристон 50 мг) в ежедневном монорежиме (1 таб./сут) не менее 12 недель лечения было несравнительным и нерандромизированным (рис. 1). Терапия начиналась на 3-й день менструального цикла и при удовлетворительной переносимости и положительном эффекте пациентка продолжала лечение в режиме 1 таб./48 ч (через день). Максимальная продолжительность курса могла достигать 12 мес при условии отсутствия побочных проявлений терапии.
Всего в клинический протокол включены 86 больных миомой матки, соответствующие всем критериям включения и исключения.
Оценка эффективности терапии проведена у 78 больных, 8 (9,3%) пациенток прервали лечение до 12 недель. Отбор пациенток проходил по следующим требованиям: женщины в возрасте от 18 до 50 лет включительно, сохраняющие менструальную функцию и имеющие: продолжительность менструального цикла ≥22 и ≤35 дней; индекс массы тела ≥18 и ≤32 (талия до 90 см); ультразвуковые критерии – миомы матки с максимальным размером доминантного узла не более 6–6,5 см и объем матки, не превышающий стандарты для 12-недельной беременности. Пациентки с любыми другими объемными образованиями малого таза, а также имеющие функциональные расстройства из-за сопутствующей соматической патологии, пропустившие контрольные сроки визитов (±5 дней), принимающие другие гормональные препараты, не включались в исследование. Перед началом лечения все пациентки дали добровольное согласие на предложенную терапию, на проведение обследования в контрольные дни визитов и на обработку их персональных данных.
Ультразвуковые исследования были выполнены с использованием вагинального датчика для цветного допплеровского изображения и спектрального анализа (Асuson Seguoia 512, Voluson 30 pro, Toshiba), проводились одним и тем же врачом по единому протоколу, куда вносились данные при первичном и повторных осмотрах. Исследование начиналось с осмотра в режиме «серой шкалы», оценивались: размеры и контуры матки; толщина, структура, границы миометрия и эндометрия; положение, структура и размеры срединного М-эха; отдельно описывали все узловые образования в сравнительном временном аспекте (размеры, локализация, границы, структура). Цветовое допплеровское картирование выполнялось для всех выявленных патологических структур и области сосудистых пучков матки с обеих сторон, с последующей допплерометрией в зонах аномальной васкуляризации. Максимальная скорость кровотока и индекс резистентности (ИР) были измерены с учетом максимальной толщины эндометрия, миометрия и локализации узлов миомы. При наличии нескольких узлов каждое образование измерялось отдельно. Узлы измерялись по трем наибольшим, перпендикулярным диагоналям: A, B и C, в плоскостях Х, Y и Z.
Объем матки рассчитывался по формуле объема эллипсоида: 0,523 × [А × В × С]
При ультразвуковых признаках патологии эндометрия выполнялась аспирационная биопсия эндометрия или офисная гистероскопия с забором материала на цитологическое и/ или гистологическое исследование.
Оценка эффективности лечения проводилась по уровню купирования симптомов и по ультразвуковой динамике размеров образований: «полный эффект» – исчезновение всех поражений в матке; «частичный эффект»- уменьшение объема узлов ≥25%; «стабилизация» – уменьшение объема узла <25%; «отсутствие эффекта» – сохранение объема узла или его уменьшение <10%, «отрицательная динамика» – рост узла ≥10% или появление новых узлов. При «отсутствии эффекта» или «отрицательной динамике» пациентка переводилась на другое лечение, в том числе хирургическое.
С целью оценки изменения интенсивности маточных кровотечений каждая пациентка вела календарь с отметками изменений менструального цикла, где отмечала характер и интенсивность менструальных выделений. Также больная фиксировала в дневнике изменения и интенсивность болевого синдрома, диспепсические расстройства, нарушения мочеиспускания, стула, динамику настроения, сна, эмоциональную лабильность, головную боль, головокружение и другие нарушения.
Результаты
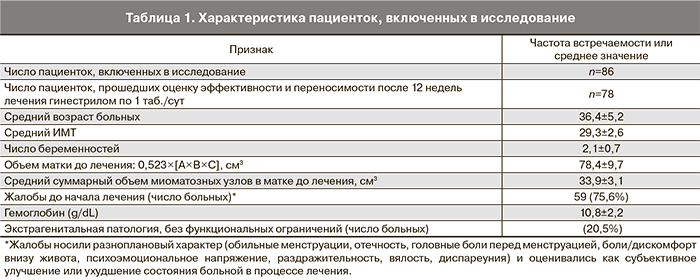
После 12-недельного лечения (гинестрил 1 таб. в день) были оценены 78 пациенток (табл. 1). Восемь из включенных в исследование женщин прекратили лечение раньше или не пришли на контрольное обследование в установленные сроки. Перед началом терапии жалобы пациенток были крайне гетерогенны: обильные менструации, отечность, предменструальный синдром, боли/дискомфорт в низу живота, психоэмоциональное напряжение, раздражительность, вялость, диспареуния. Оценка их в динамике проводилась по субъективным критериям самой больной, как улучшение или ухудшение самочувствия.
Динамика основных жалоб больных представлена в табл. 2. Необходимо отметить, что по контролю основных симптомов: гиперполименорея и боли – дискомфорт в области малого таза отмечена положительная динамика у всех пациенток.
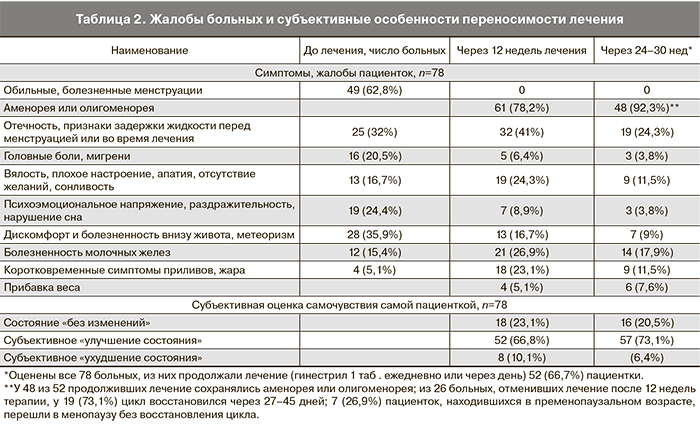
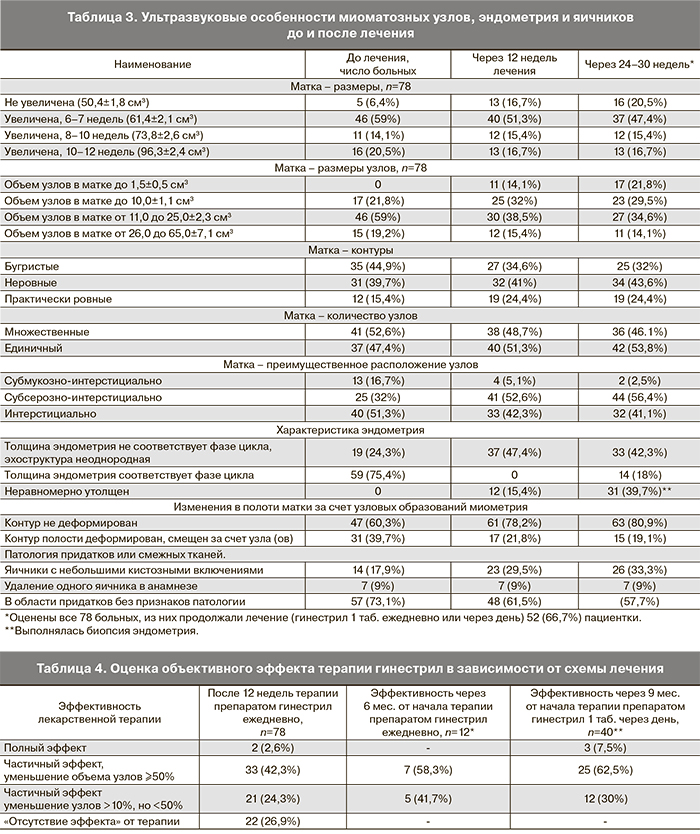
Объективные ультразвуковые критерии динамики заболевания представлены в табл. . У 3 42,3%) больных существенно уменьшились объемы миоматозных узлов (более 50% исходных), а при продолжении терапии в прежнем режиме или при уменьшении кратности приема препарата (через день) эффект наступил еще у 11 больных, что в сумме составило 56,4% к 6 месяцам лечения. Объем матки существенно не менялся и достоверно сократился у 24,3% пациенток. Анализ эффективности терапии в зависимости от размеров и положения миоматозных узлов показал, что лучшая динамика достигнута у женщин, имевших небольшие интерстициальные узлы, не превышающие объемом 25,0 см3. В этих случаях положительная динамика зарегистрирована в 83,3% наблюдений. Интересно, что при положительной динамике менялась и структура узла, визуализировалась его неоднородность и снижение локального кровотока при сохраняемых параметрах в маточных артериях [26]. У 22 (28,2%) больных объемы узлов не изменились, что привело к остановке терапии и изменило тактику лечения.
Анализ переносимости лечения показал, что у 72% больных было зарегистрировано уменьшение размеров миоматозных узлов (табл. 4) и субъективное «улучшение состояния».
Это произошло за счет достигнутого контроля за менструальной кровопотерей и как следствие восстановления гемоглобина. В процессе лечения обратимая аменорея или олигомерорея развивались у 92,3% больных. Появление в процессе лечения у части пациенток симптомов «приливов», «эмоциональной лабильности» или головных болей носило кратковременный характер, быстро нивелировалось и не являлось причиной отказа от терапии.
Анализ причин «незаконченности лечения» показал, что лишь 4 (4,6%) больных из 86 отказались от продолжения терапии через 2–4 недели по причине «дискомфорта и плохого самочувствия». Однако детализация мотивов для прекращения лечения показала, что основной отказ обусловлен больше деонтологическими проблемами: другой врач сказал, что «…это гормональное лечение вредно, и миома все равно будет расти…, …лучше оперироваться…». В этих случаях женщины, естественно, не имели желание продолжать терапию. Как показал наш опыт, достигнуть комплаентности в таких случаях практически не удается, и с учетом добровольного участия в исследовании женщин такие пациентки были отмечены как «выбывшие из оценки». Необходимо признать, что есть объективные причины остановки лечения, например, у одной пациентки через 6 недель лечения появились симптомы маточного кровотечения с характерным болевым синдромом, вызванного рождением миоматозного узла с центрипитальным ростом, размерами до 3,5 см. В этом случае была выполнена консервативная миомэктомия в срочном порядке. Еще трое больных по разным обстоятельствам пропустили сроки контрольных визитов и сами отменили лечение через 4–8 недель, что не позволило включить их в оценку результатов.
Таким образом, в результате анализа безопасности лечения основными побочными проявлениями терапии, наблюдаемые у 8% женщин, были: приливы, незначительная тошнота, головная боль, слабость/усталость, которые не приводили к отмене курса. Ультразвуковые критерии изменений, происходящих в эндометрии (утолщение и неоднородность М-эха) (рис. 2 см. на вклейке), потребовали выполнения диагностической пайпель-биопсии у 48 больных, но ни в одном случае морфоцитологических критериев атипии не выявлено. Такие изменения были крайне похожи на трансформацию эндометрия в анавуляторных циклах и имели различные картины кистозно-деформированных, непролиферативных желез без патологии стромы. Клинически необходимо учитывать такой эффект на эндометрий, однако поскольку восстановление менструального цикла произошло у всех больных репродуктивного возраста, обратимость изменений свидетельствует о функциональном характере патологии, что подтверждается морфологически – метапластическими сдвигами. Таким образом, при хорошем контроле данные ультразвуковые изменения не должны приводить к остановке терапии.
Анализ проведенного лечения и дальнейшего наблюдения за больными в течение 12 мес показал, что необходимость в оперативном лечении возникла у 6 (7,6%) больных. Такое решение было обусловлено большими размерами узла миомы (более 5 см), вновь появившимися болями и гиперполименореей. Лапароскопическая гистерэктомия была выполнена 4 больным, в двух случаях объем операции – консервативная миомэктомия, с учетом хороших технических возможностей и преимущественно субсерозного расположения узла. Две пациентки (2,5%) имели желанные беременности через 5 и 6 мес после окончания лечения.
Обсуждение
Современная тенденция к увеличению гормонозависимых заболеваний органов женской репродуктивной системы (ОЖРС) обусловливает поиск своевременных и безопасных схем медикаментозной терапии, позволяющих избегать радикального лечения в будущем. Несмотря на то, что прогестерон оказывает огромное влияние на ткани-мишени: матка, яичники, молочная железа, активно влияет на центральные и периферические клетки нервной системы, его стимулирующая роль в клетках лейомиомы должна быть блокирована с целью контроля роста узлов и остановки гиперполименореи. Полученные нами данные во многом сопоставимы с ранее проведенными исследованиями, однако позволили выделить группу наиболее «благоприятных пациенток». Это женщины, имеющие интерстициально расположенные узлы, максимально достигающие 4 см. Мы также показали, что может происходить нарастание эффекта терапии в течение 3 месяцев после остановки лечения, а терапия более 6 мес не увеличивает число нежелательных побочных проявлений. Ультразвуковые изменения эндометрия, возникающие на фоне терапии, как по нашим данным, так и подтвержденные специальными исследованиями [27, 28], носят обратимый характер и не имеют морфологических подтверждений развивающейся атипии. Необходимо констатировать, что имеющиеся симптомы болезни, хорошо контролируются медикаментозной терапией, а нарастание изменений в структуре узлов лейомиомы, регрессия размеров происходит лишь к 10–12-й неделям лечения и нарастает постепенно.
Таким образом, хотя исследование не являлось классическим плацебо-контролируемым, однако полученный опыт и достаточно новый режим дозирования (гинестрил 1 таб. через день после 12 недель ежедневного режима) позволяет констатировать, что медикаментозное лечение женщин с миомой матки возможно и эффективно. При этом необходимо помнить, что назначенное лечение при частичном или полном субмукозном расположении узлов может привести к спонтанному их рождению, что потребует срочной операции. В случаях с более крупными доминантными узлами (более 5–6 см) эффект достигается хуже, но в этих случаях гинестрил может быть рекомендован коротким 12-недельным курсом с целью предоперационной подготовки [29]. Хорошим прогностическим фактом являются два случая наступления спонтанных беременностей, которые демонстрируют функционально-обратимые изменения в матке, возникающие на фоне лечения. Этот факт необходимо использовать в выборе тактики лечения молодых женщин с множественными узлами, когда операции бывают крайне травматичны. Женщинам в пременопаузе длительное лечение гинестрилом (>6 месяцев) позволило перейти в менопаузальный период, что положительно сказалось на нарастающей регрессии узлов после остановки терапии. Такой подход дает шанс многим женщинам избежать радикальной операции. В нашей работе мы продолжаем динамическое наблюдение за пролеченными больными, что даст возможность оценить отдаленные результаты терапии: риски и интервалы возникновения рецидивов болезни, которые в период наблюдений от 6 до 12 месяцев пока не зафиксированы.
Заключение
Препарат гинестрил высокоэффективен, безопасен и перспективен в медикаментозном лечении миомы матки с максимальными размерами доминантного узла до 6 см. Схема терапии: мифепристон 50 мг ежедневно – 12 недель, с возможной пролонгацией лечения до 6–9 мес в ежедневном режиме или редуцированном режиме (1 таб./48 ч, через день). Такой подход позволяет хорошо контролировать симптомы болезни и уменьшить размеры узлов лейомиомы у 72% больных.



