Бактериальные и вирусные инфекционные заболевания мочеполовой системы характеризуются широкой распространенностью в популяции и неблагоприятным влиянием на репродуктивное здоровье женщин [1–3]. Урогенитальные инфекции, вызывающие, как правило, выраженную воспалительную реакцию, зачастую носят полимикробный характер, при котором отмечаются массивная колонизация половых путей разнообразными микроорганизмами и снижение доли нормальной микрофлоры. В условиях совместного существования микроорганизмов происходит изменение не только видового и количественного состава представителей микробного сообщества, но и их вирулентности. Хронический воспалительный процесс, вызванный микробными ассоциациями, нарушает работу иммунной системы, в результате чего снижаются уровень интерферонов, функциональная активность нейтрофилов и происходит угнетение функций естественных клеток-киллеров. При этом создаются благоприятные условия для инфицирования и персистенции вирусных инфекций, передаваемых половым путем (ИППП), в частности папилломавирусной инфекции (ПВИ) [4–6].
В настоящее время в терапии урогенитальных заболеваний применяется широкий спектр противомикробных препаратов, однако нерациональное использование системных лекарственных средств нередко приводит к дисбалансу кишечной и вагинальной микрофлоры, что в ряде клинических ситуаций делает более предпочтительным применение местнодействующих форм, обладающих комплексным терапевтическим воздействием, включая иммуностимулирующее, противовоспалительное и регенерирующее. Преимуществами локальной терапии урогенитальных инфекций являются: высокая эффективность использования малых доз препарата, обеспечение необходимой концентрации лекарственного вещества в очаге инфекции, исключение системного влияния на здоровые ткани и, соответственно, оптимальность применения у пациенток с экстрагенитальной патологией [7].
Одним из препаратов, назначение которых с патогенетической точки зрения обосновано у пациенток с инфекционно-воспалительными заболеваниями урогенитальной системы бактериальной и вирусной этиологии, является Эпиген Интим, спрей 0,1%, для наружного и местного применения. Эпиген Интим представляет собой неспецифическое противовирусное и иммуностимулирующее средство, в состав которого в качестве активного вещества входит активированная глицирризиновая кислота. Противовоспалительная активность глицирризиновой кислоты сочетается с ее стимулирующим влиянием на гуморальные и клеточные факторы иммунитета, она способна существенно тормозить выброс кининов и синтез простагландинов клетками соединительной ткани в зоне воспаления, а также обладает регенерирующим действием, обусловленным улучшением репарации кожи и слизистых оболочек [8, 9].
Цель исследования – оценить клиническую эффективность препарата Эпиген Интим, спрей 0,1%, у пациенток с вульвовагинитами и/или цервицитами неспецифической этиологии и пациенток с генитальной ПВИ.
Материалы и методы
Под наблюдением находились 60 пациенток в возрасте от 18 до 56 лет, которые были распределены на 2 группы: 1-я группа – 30 пациенток с клиническими и лабораторными признаками вульвовагинита и/или цервицита, сохраняющимися после этиотропного лечения ИППП; 2-я группа – 30 пациенток с ПВИ и количественными показателями вирусов папилломы человека (ВПЧ) ≥3 lg копий ДНК на 100 тысяч клеток.
Комплекс лабораторных исследований включал: проведение микроскопического исследования для оценки лейкоцитарной реакции и определения морфотипов патогенных и условно-патогенных микроорганизмов; исследование методом полимеразной цепной реакции (ПЦР) для исключения возбудителей ИППП; дополнительно для пациенток 2-й группы – исследование методом ПЦР в реальном времени для количественного определения генотипов ВПЧ (количество копий ДНК ВПЧ, отнесенное к количеству клеток человека) и цитологическое исследование цервикальных соскобов (интерпретацию осуществляли по системе Bethesda: N-SIL – цитологическая картина в пределах нормы; ASC-US – клеточные элементы, трудно поддающиеся классификации (неопределенного значения); L-SIL – поражения низкой степени тяжести, объединяющие цитологические изменения, указывающие на слабую цервикальную интраэпителиальную неоплазию (CIN I) и индуцированные ВПЧ морфологические изменения; H-SIL - поражения высокой степени тяжести, характерные для умеренной (CIN II) и тяжелой (CIN III) цервикальной интраэпителиальной неоплазии).
Эпиген Интим, спрей 0,1%, назначался всем пациенткам интравагинально 3 раза в день, пациенткам 2-й группы – дополнительно наружно (при наличии клинических проявлений ПВИ). Курс лечения пациенток 1-й группы составил 10 дней, пациенток 2-й группы – 30 дней, после чего проводился контроль результатов лечения (оценка клинических симптомов и микроскопическое исследование; дополнительно пациенткам 2-й группы – количественное определение ВПЧ и цитологическое исследование цервикальных соскобов).
Статистический анализ полученных результатов проводили на персональном компьютере с MS Windows 10 с использованием непараметрических методов в программе Statistica 8.0. Сравнение двух рядов данных по их средним величинам и величинам стандартных отклонений проводилось с использованием t-критерия Стьюдента. При уровне значимости p<0,05 различия считались статистически достоверными.
Результаты
На момент включения в исследование клинические и лабораторные признаки вульвовагинита и/или цервицита были зарегистрированы у всех пациенток 1-й группы и у большинства (80,0%) пациенток 2-й группы. Основными клиническими проявлениями заболеваний являлись: патологические вагинальные и/или цервикальные выделения (у 22 (73,3%) пациенток 1-й группы и 7 (23,3%) пациенток 2-й группы), наиболее часто слизисто-гнойного (8; 13,3%), сероватого гомогенного (8; 13,3%) или густого белого (12; 20,0%) характера, зуд/жжение/дискомфорт в области половых органов (у 15 (50,0%) и 19 (63,3%) пациенток соответственно), диспареуния (у 8 (26,7%) и 7 (23,3%) пациенток), боли внизу живота (у 9 (30,0%) и у 1 (3,3%) пациентки соответственно). Выраженная гиперемия и отечность кожных покровов и слизистых оболочек половых органов были выявлены у 9 (30,0%) пациенток 1-й группы и 8 (26,7%) пациенток 2-й группы.
Эпиген Интим, спрей 0,1%, пациентки применяли, используя специальную интравагинальную насадку для нанесения препарата на слизистую оболочку влагалища и шейки матки, 3 раза в сутки в течение 10 или 30 дней.
При контрольном обследовании пациенток после проведенной терапии было установлено достоверное снижение частоты выявления клинических признаков воспалительной реакции: патологических выделений из половых путей (с 48,3 до 13,3%), зуда/жжения/дискомфорта в области половых органов (с 56,6 до 5,0%), болезненности при половых контактах (с 25,0 до 3,3%) и других (рис. 1). Такие симптомы инфекционно-воспалительного процесса, как гиперемия, отечность и кровоточивость кожных покровов и слизистых оболочек половых органов, дизурия и боли внизу живота после проведенной терапии препаратом Эпиген Интим, спрей 0,1%, не выявлялись.
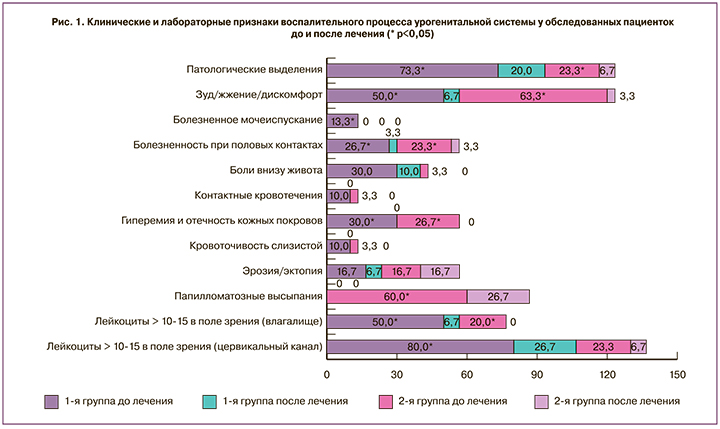
Результаты микроскопического исследования биологического материала, полученного из влагалища и цервикального канала, также свидетельствовали о значимых различиях в показателях лейкоцитарной реакции до и после лечения: повышенное количество лейкоцитов (более 10–15 полиморфноядерных лейкоцитов (ПМЯЛ) в поле зрения), выявленное в вагинальном отделяемом до назначения терапии у 15 (50%) пациенток 1-й группы и 6 (20%) пациенток 2-й группы, после лечения сохранялось только у 2 (6,7%) пациенток 1-й группы. Данные микроскопии отделяемого цервикального канала продемонстрировали аналогичное снижение частоты выявления лейкоцитоза, который до проведения терапии был установлен у 24 (80,0%) пациенток 1-й группы и 7 (23,3%) пациенток 2-й группы, после терапии Эпиген Интим спреем – у 8 (26,7%) и 2 (6,7%) пациенток соответственно (см. рис. 1).
Выраженная лейкоцитарная реакция во влагалище у большинства пациенток сопровождалась обнаружением представителей рода Mobiluncus (4; 6,7%), Lepthotrix (8; 13,3%), «ключевых клеток» (8; 13,3%), грибов рода Candida (8; 13,3%) и преобладанием в клиническом материале коккобациллярной микрофлоры. При этом морфотипы, свидетельствующие о присутствии Lactobacillus, обнаруживали только у 56,7% пациенток 1-й группы и 70,0% пациенток 2-й группы. После проведенной терапии отмечалось увеличение частоты выявления грамположительной бациллярной микрофлоры (у 28 (93,3%) пациенток 1-й группы и 26 (86,7%) пациенток 2-й группы), а ранее выявленные показатели, свидетельствующие о нарушении микроценоза урогенитального тракта с преобладанием анаэробного компонента и кандидозной инфекции, отсутствовали у 28 (93,3%) пациенток 1-й группы и 30 (100%) пациенток 2-й группы.
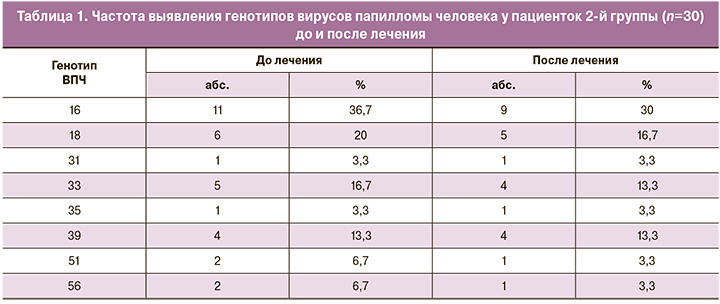
Отдельно были проанализированы результаты дополнительного обследования пациенток с генитальной ПВИ (2-я группа). На момент обращения за медицинской помощью клинические проявления ПВИ (аногенитальные (венерические) бородавки) были диагностированы у 20 (66,7%) пациенток. По результатам исследования методом ПЦР в общей структуре генотипов преобладал ВПЧ 16 типа (11; 36,7%); ВПЧ 18 типа выявляли у 6 (20%) пациенток, 33 типа – у 5 (16,7%), 39 типа – у 4 (13,3%) пациенток (табл. 1).
После проведенной монотерапии Эпиген Интим спреем (3 раза в сутки интравагинально и наружно в течение 30 дней) регресс папилломатозных высыпаний был достигнут у 12 (60,0%) пациенток (см. рис. 1). У большинства из них (10; 83,3%) площадь папилломатозных высыпаний не превышала 2 см2, а длительность заболевания варьировала в диапазоне от 1 недели до 2 месяцев.
Элиминация ВПЧ при контрольном лабораторном исследовании была зарегистрирована у 6 (20,0%) пациенток: ВПЧ 16 генотипа – у 2 пациенток, ВПЧ 18 генотипа – у 1 пациентки, ВПЧ 33 генотипа – у 1 пациентки, ВПЧ 51 генотипа – у 1 пациентки и ВПЧ 56 генотипа – у 1 пациентки (см. табл. 1).
Согласно данным исследований методом ПЦР в режиме реального времени, высокие количественные показатели содержания ВПЧ (от 4,0 до 5,0 lg копий ДНК ВПЧ на 100 тысяч клеток) были выявлены у 11 (36,7%) пациенток и сохранялись после лечения у 9 (30,0%) пациенток. Значимые показатели содержания ВПЧ (от 3,0 до 4,0 lg копий ДНК ВПЧ на 100 тысяч клеток) выявляли у 19 (63,3%) пациенток до лечения и у 7 (23,3%) пациенток после лечения. У 8 (26,7%) пациенток после лечения наблюдалось снижение показателей содержания ВПЧ менее 3,0 lg копий ДНК ВПЧ на 100 тысяч клеток, а у 6 (20%) пациенток ДНК ВПЧ выявлена не была. Обращало на себя внимание, что у пациенток с количественными показателями ВПЧ от 4,0 до 5,0 lg копий ДНК ВПЧ на 100 тысяч клеток наблюдалось их снижение, но не была достигнута эрадикация ВПЧ ни в одном из наблюдений. Достижение эрадикации ВПЧ было зарегистрировано только в группе пациенток с меньшими количественными показателями вируса – от 3,0 до 4,0 lg копий ДНК ВПЧ на 100 тысяч клеток (рис. 2).
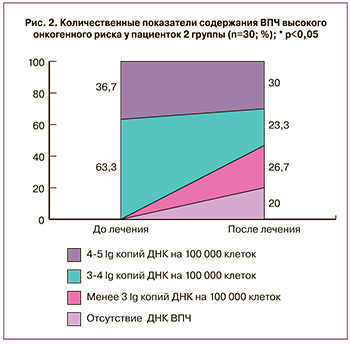 Нами не было выявлено достоверной зависимости наличия или отсутствия регресса высыпаний от генотипов ВПЧ, однако удалось установить таковую в отношении показателей вирусной нагрузки: у 9 из 12 пациенток (75,0%) с регрессом клинических проявлений ПВИ количественные показатели ВПЧ находились в пределах от 3,0 до 4,0 lg копий ДНК ВПЧ на 100 тысяч клеток и только у 3 пациенток превышали данные значения (от 4,0 до 5,0 lg копий ДНК ВПЧ на 100 тысяч клеток) (р<0,05).
Нами не было выявлено достоверной зависимости наличия или отсутствия регресса высыпаний от генотипов ВПЧ, однако удалось установить таковую в отношении показателей вирусной нагрузки: у 9 из 12 пациенток (75,0%) с регрессом клинических проявлений ПВИ количественные показатели ВПЧ находились в пределах от 3,0 до 4,0 lg копий ДНК ВПЧ на 100 тысяч клеток и только у 3 пациенток превышали данные значения (от 4,0 до 5,0 lg копий ДНК ВПЧ на 100 тысяч клеток) (р<0,05).
Цитологическое исследование цервикальных соскобов продемонстрировало отсутствие патологических изменений (Norma/NSIL) у 25 (83,3%) пациенток до лечения и у 28 (93,3%) пациенток после проведенной терапии; клеточные элементы, трудно поддающиеся классификации (ASC-US), выявлялись у 3 (10,0%) и 1 (3,3%) пациентки, слабо выраженные интраэпителиальные поражения (L-SIL) – у 2 (6,7%) и 1 (3,3%) пациентки соответственно.
В процессе терапии все пациентки отмечали хорошую переносимость и удобство применения препарата Эпиген Интим, спрей 0,1%. О слабовыраженных нежелательных лекарственных явлениях в виде легкого жжения после нанесения препарата на слизистые оболочки свидетельствовали 2 (6,6%) пациентки 1-й группы и 1 (3,3%) пациентка 2-й группы.
Обсуждение
В опубликованных ранее работах авторами было установлено, что активированная глицирризиновая кислота, входящая в состав Эпиген Интим, спрей 0,1%, обладает комплексным терапевтическим эффектом, включая иммуностимулирующее, противовоспалительное, противозудное и регенерирующее действия [8, 9]. Результаты настоящего исследования также продемонстрировали высокую противовоспалительную активность препарата: нами было установлены достоверное снижение частоты выявления субъективных и объективных признаков воспалительной реакции со стороны урогенитальной системы (патологических выделений, гиперемии, кровоточивости, отечности кожных покровов и слизистых оболочек половых органов и др.), нормализация показателей лейкоцитарной реакции во влагалище (у 96,7% пациенток) и в цервикальном канале (у 83,3% пациенток), а также выявлено улучшение показателей микробиоценоза половых органов. Большинство пациенток (86,7%) свидетельствовали о значительном снижении интенсивности таких симптомов, как зуд, жжение и болезненность в области половых органов, после первых суток применения препарата Эпиген Интим.
Путем экспериментальных исследований ученым удалось установить, что в отношении ВПЧ Эпиген Интим спрей действует, прерывая репликацию вирусов на ранних стадиях и вызывая выход вириона из капсида, тем самым не допуская его проникновения в клетки, а также инактивирует вирусы в нетоксичных для нормально функционирующих клеток концентрациях. В этой связи интересными представляются результаты исследований отечественных и зарубежных ученых в отношении влияния глицирризиновой кислоты на состояние слизистой оболочки шейки матки пациенток, инфицированных ВПЧ. В экспериментальном исследовании Farooqui A. et al. [10], целью которого являлся анализ антипролиферативных и апоптотических свойств глицирризина в раковых клетках шейки матки HeLa, был установлен высокий цитотоксический потенциал препарата, а также отмечена его противораковая эффективность за счет индукции апоптоза и остановки клеточного цикла в раковых клетках шейки матки HeLa in vitro. Воздействие глицирризина значительно снижало жизнеспособность клеток HeLa с сопутствующим увеличением конденсации и фрагментации ДНК в ядре в зависимости от дозы. В отечественных работах было продемонстрировано, что в результате проведенного противовирусного лечения препаратом Эпиген Интим спрей наблюдалось отсутствие клинических проявлений ПВИ у 84% пациенток, у 40% из них показатели цитограммы соответствовали норме, а явления цервицита и количество атипических клеток плоского эпителия снизились в 2 раза [11]. Профилактическое применение препарата активированной глицирризиновой кислоты у пациенток с бессимптомным носительством ВПЧ позволило снизить количество реализованных CIN в 3,2 раза при вагинальном нормоценозе и в 2,5 раза – при нарушениях микробиоценоза после коррекции эубиотиком [8].
В настоящем исследовании в результате проведенной терапии Эпиген Интим спреем у пациенток с ПВИ удалось достичь эрадикации ВПЧ (20,0%) и снижения количественных показателей ВПЧ до клинически малозначимых значений (26,7%) у обследованных женщин, а также улучшить показатели цитологического исследования цервикальных соскобов у 6 (20,0%) пациенток. Наилучшие показатели эффективности препарата Эпиген Интим, спрей 0,1%, при ПВИ были установлены у пациенток с небольшой площадью (менее 2 см2) папилломатозных высыпаний, длительностью заболевания менее 2 месяцев и количественными показателями вируса от 3,0 до 4,0 lg копий ДНК ВПЧ на 100 тысяч клеток.
Заключение
Таким образом, в процессе настоящего исследования в результате применения препарата Эпиген Интим, спрей 0,1%, у пациенток с вульвовагинитами, цервицитами и генитальной ПВИ были установлены достоверное снижение частоты выявления субъективных и объективных признаков воспалительных заболеваний урогенитальной системы, нормализация показателей лейкоцитарной реакции во влагалище (96,7%) и цервикальном канале (83,3%), регресс клинических проявлений ПВИ (60,0%), элиминация (20,0%) или снижение количественных показателей ВПЧ (26,7%), улучшение показателей цитологического исследования цервикальных соскобов (20,0%). Эпиген Интим, спрей 0,1%, продемонстрировал высокий профиль эффективности в лечении урогенитальных инфекций и может быть рекомендован в качестве противовоспалительного, противовирусного и иммуностимулирующего компонентов терапии вульвовагинитов, цервицитов и генитальной папилломавирусной инфекции.



