Широкое внедрение в клиническую практику методов вспомогательных репродуктивных технологий обусловливает неизбежность возникновения такого грозного ятрогенного состояния, как синдром гиперстимуляции яичников (СГЯ).
В основе клинических проявлений СГЯ лежит резкое повышение сосудистой проницаемости, приводящее к массивному выходу жидкости в «третье пространство». В особенно тяжелых случаях СГЯ сопровождается тромбоэмболиями магистральных сосудов, острой почечной недостаточностью, печеночной дисфункцией, острым респираторным дистресс-синдромом взрослых, что может стать причиной летального исхода [1]. Смертность от осложнений, провоцируемых СГЯ, составляет 3 случая на 100 тыс. стимулированных циклов, в которых отмечается развитие тяжелых проявлений данного синдрома [2].
По данным разных авторов частота развития СГЯ при введении хорионического гонадотропина человека (ХГЧ) в качестве триггера овуляции в протоколах ЭКО с антагонистом гонадотропин-рилизинг гормона (ГнРГ) у пациенток с высоким риском развития СГЯ колеблется от 3 до 18,8% [3–9].
С учетом начала клинических проявлений выделяют раннюю и позднюю формы СГЯ, которые по критерию ряда предрасполагающих факторов и связанных с ними особенностей патогенеза рассматриваются как два различных состояния. Ранний СГЯ возникает в первые 9 дней после трансвагинальной пункции фолликулов (ТВП), обусловлена введением экзогенного ХГЧ и ассоциирована с увеличением частоты самопроизвольных выкидышей [10, 11]. Диагноз позднего СГЯ принято подтверждать при развитии данного синдрома на сроках более 9 дней после пункции фолликулов, как следствие подъема уровня эндогенного ХГЧ в плазме крови при наступившей беременности [10, 11].
Несмотря на большой клинический опыт, патофизиология СГЯ еще недостаточно изучена, однако пусковым механизмом развития СГЯ считается введение овуляторной дозы ХГЧ [10]. В настоящее время использование протоколов с антагонистами ГнРГ позволяет снизить риск СГЯ как за счет более щадящей стимуляции, так и за счет возможности использования в качестве триггера овуляции агониста ГнРГ взамен ХГЧ. Механизм действия агониста ГнРГ основан на конкурентном замещении рецептора ГнРГ с последующим его выбросом и высвобождением гонадотропинов [12, 13].
Однако индуцированная ЛГ волна состоит из двух фаз и длится в общей сложности 24–36 ч, в то время как естественный цикл характеризуется тремя фазами и длится 48 ч. Также известно, что период полураспада ЛГ составляет 20–40 мин, в то время как период полураспада ХГЧ – более 24 часов. Таким образом, длительность воздействия гонадотропинов, выделяемых при введении агониста ГнРГ, меньше по сравнению с естественным циклом, что приводит к регрессу желтого тела и снижению его функциональной активности [13].
На сегодняшний день лютеолиз считается основной причиной профилактики СГЯ при замене триггера овуляции, а также причиной низкой частоты наступления беременности и высокой частоты репродуктивных потерь [14].
В 2011 году M. Youssef и соавт. проанализировали частоту наступления беременности и развития СГЯ в 11 контролируемых рандомизированных исследованиях (n=1055). Частота наступления беременности в циклах с использованием ХГЧ составила 30% при частоте развития СГЯ – 3%, а при введении агониста ГнРГ колебалась от 12 до 20% при частоте СГЯ 0%. При этом частота наступления беременности в циклах донор-реципиент не отличалась в группах с агонистом ГнРГ и с ХГЧ [4]. В 2014 году эти же авторы включили в обзор 17 контролируемых рандомизируемых исследований (n=1847), 13 из которых изучали частоту наступления беременности в лечебном цикле при замене триггера овуляции. Результаты анализа были сходны с таковыми в предыдущем обзоре: агонист ГнРГ ассоциирован с более низкой частотой развития СГЯ по сравнению с ХГЧ в лечебном цикле (ОШ 0,15, 95% ДИ 0,05–0,47; 8 КРИ , n=989); с низкой частотой наступления клинической беременности (ОШ 0,70, 95% ДИ 0,54–0,91; с низкой частотой живорождения (ОШ 0,47, 95% ДИ 0,31–0,70; 5 КРИ, n=532), 11 КРИ, n=1198) и высокой частотой прерывания беременности (ОШ 1,74, 95% ДИ 1,10–2,75; 11 КРИ, n=1198) по сравнению с ХГЧ [15].
Таким образом, использование агониста ГнРГ в качестве триггера овуляции снижает риск возникновения СГЯ, но также снижает частоту наступления беременности по сравнению с таковой при введении ХГЧ.
Целью исследования является совершенствование программ ЭКО у пациенток с высоким риском развития СГЯ путем замены триггера овуляции и моделирования лютеиновой фазы.
Материал и методы исследования
В исследование были включены 258 женщин в возрасте от 20 до 39 лет с высоким риском развития СГЯ (концентрация антимюллерова гормона в сыворотке крови более 2,5 нг/мл, наличие более 14 антральных фолликулов, наличие 18 и более фолликулов диаметром более 11 мм в день введения триггера овуляции [16, 17]), которым проводили программы ЭКО или ЭКО/ИКСИ с последующим переносом эмбрионов в лечебном цикле в период с марта 2013 г. по декабрь 2014 г. Проведение исследования было одобрено этическим комитетом ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России.
Отобранные для исследования пациентки были разделены на три группы с учетом введенного триггера овуляции: I группа (n=91), где триггером являлся агонист ГнРГ (диферелин) в дозе 0,2 мг; II группа (n=82), где триггером являлся агонист ГнРГ (диферелин) в дозе 0,2 мг и ХГЧ (прегнил) в дозе 1500 МЕ; III группа (n=85), где триггером являлся ХГЧ (прегнил) в дозе 10 000 МЕ. Распределение пациенток по группам осуществлялось методом случайных чисел.
Со 2-го дня менструального цикла и до дня введения триггера овуляции пациенткам назначали индивидуально подобранную дозу рекомбинантного ФСГ (пурегон/гонал) от 112,5 МЕ до 200 МЕ в сутки. В процессе стимуляции дозу корригировали в зависимости от ответа яичников. При достижении фолликулами диаметра 14 мм для предотвращения преждевременного пика ЛГ пациенткам вводили антагонист ГнРГ (цетрореликс 0,25 мг). Триггер овуляции вводили при наличии в яичниках ≥3 фолликулов диаметром ≥17 мм. ТВП выполняли через 35–36 часов после введения триггера овуляции. Перенос 1 или 2 эмбрионов осуществляли на 5-е сутки.
Поддержку лютеиновой фазы в группе пациенток с заменой триггера овуляции на агонист ГнРГ проводили с первых суток после ТВП микронизированным прогестероном (утрожестан) в дозе 600 мг/день и эстрадиола валератом (прогинова) 4 мг/день. Дополнительно для поддержки лютеиновой фазы вводили 1500 МЕ ХГЧ в день забора ооцитов.
В группе пациенток, получавших в качестве триггера овуляции агонист ГнРГ и ХГЧ, для поддержки лютеиновой фазы использовали микронизированный прогестерон (утрожестан) в дозе 600 мг/день и эстрадиола валерат (прогинова) 4 мг/день.
В группе пациенток, получавших ХГЧ для финального дозревания ооцитов, для поддержки лютеиновой фазы использовали микронизированный прогестерон (утрожестан) в дозе 600 мг.
Оплодотворение ооцитов проводили путем инсеминации при нормозооспермии и посредством ИКСИ при олигоастенотератозооспермии I–II степени. Культивирование эмбрионов осуществляли в средах ISM1 и BAOrigio(Дания). Оценку степени развития и морфологию эмбрионов осуществляли ежедневно по бальной системе. При переносе на 3-и сутки выбирались 8-клеточные эмбрионы с оценкой не менее 2,5 баллов. Оценка эмбрионов 5-х суток осуществлялась согласно классификации D.K. Gardner и W.B. Schoolcraft (1999) [18]. Для переноса использовали 1 или 2 бластоцисты, имеющие оценку не менее 3BB на 5-е сутки.
Случаи развития СГЯ подтверждали наличием клинической картины (жалобы на абдоминальное напряжение, тошноту, рвоту и др.), ультразвуковых признаков асцита, увеличения объема яичников более 6 см, гиперкоагуляции по данным коагулограммы, повышением уровня гемоглобина, гематокрита и лейкоцитов за счет гемоконцентрации. Степень тяжести СГЯ оценивали согласно классификации, изложенной в федеральных клинических рекомендациях от 2013 года [1].
Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как среднее ± ошибка среднего (М±m). Значимость наблюдаемых отклонений оценивали с помощью однофакторного мультидисперсного анализа (ANOVA) с использованием пакета статистического анализа SPSS Statistics 22. Статистически значимыми считали отличия при р<0,05. Непараметрические данные исследовали также с использованием пакета статистического анализа SPSS Statistics 22. Т-тест Стьюдента считали значимым при значении менее 0,05.
Результаты исследования
Все пациентки, вошедшие в исследование, были сопоставимы по возрасту и индексу массы тела (ИМТ). Средний возраст в I группе составил 30,1±3,3 года, во II группе – 30,6±3,8 года, в III группе – 30,5±3,5 года (p>0,05); ИМТ в I группе – 22,4±0,3, во II группе – 23,2±0,5, в III группе – 23,01±0,4 соответственно (ANOVA>0,05).
Также не выявлено статистически достоверных различий в продолжительности стимуляции суперовуляции, которая составила 9,0±1,5 дня в I группе, 9,4±1,8 дня во II группе, 8,9±1,3 дня в III группе (ANOVA>0,05) и суммарной дозе гонадотропина: 1571,24±532,58 МЕ в I группе, 1625,37±537,01 МЕ во II группе, 1553,84±501,9 МЕ в III группе (ANOVA>0,05). Число фолликулов в день введения триггера овуляции составило: 22,8±4,4 в I группе, 22,2±3,5 во II группе, 22,5±2,6 в III группе (р>0,05); количество фолликулов диаметром 17 мм и более составило 15,2±3,4, 14,7±3,8 и 15,6±3,5 соответственно (ANOVA>0,05). Средняя концентрация эстрадиола в день введения триггера овуляции в I группе составила 11 178,73±5337,25 пмоль/л, во II группе – 10 734,62±6344,76 пмоль/л и в III группе – 9474,06±4320,5 пмоль/л (ANOVA>0,05).
Среднее число полученных ооцитов во всех группах статистически достоверно не различалось и составило 15,52±5,22 в группе с агонистом ГнРГ, 13,99±4,84 в группе с агонистом ГнРГ и ХГЧ и 15,15±5,28 в группе с ХГЧ (ANOVA>0,05); из них количество зрелых ооцитов составило 11,82±4,63 в I группе, 12,83±4,33 во II группе и 14,62±3,94 в III группе (ANOVA>0,05). Оплодотворение производилось путем инсеминации у 41,8% женщин в I группе, 46,3% – во II группе и 36,5% – в III группе; с помощью ИКСИ – у 58,2, 53,7 и 63,5% соответственно. Количество нормально оплодотворившихся ооцитов во всех группах было сопоставимо: в I группе – 9,44±4,13, во II группе – 8,45±4,07, в III группе – 9,39±3,05 (ANOVA>0,05). Частота оплодотворения составила 59,87% в группе с агонистом ГнРГ, 61,88% в группе с двойным триггером, 63,83% в группе с ХГЧ. Морфологическая оценка эмбрионов на 3-и сутки согласно бальной системе составила 2,89±3,91, 2,90±4,15, 2,84±3,0 балла соответственно (ANOVA>0,05). Количество бластоцист составило 5,9±3,4 в I группе, 4,8±3,7 во II группе и 4,8±3,1 в III группе. При попарном сравнении групп выявлено статистически значимо большее количество бластоцист в I группе при сравнении со II (p=0,036) и III группой (p=0,02); при сравнении количества бластоцист в группе с двойным триггером и в группе с ХГЧ статистически значимой разницы не выявлено (ANOVA>0,05). При анализе количества бластоцист высокого качества также выявлено достоверно значимое увеличение последних в группе с агонистом ГнРГ – 3,7±2,8 , по сравнению со II и III группой – 2,8±2,5 и 2,8±2,4 соответственно (p1/2=0,024, p1/3=0,022). Количество эмбрионов на перенос составило 1,30±0,07 в I группе, 1,24±0,08 во II группе, 1,35±0,07 в III группе (ANOVA>0,05). Число криоконсервированных эмбрионов составило 3,67±2,8 в I группе; 3,6±2,9 в группе с двойным триггером; 3,24±2,6 в группе с ХГЧ, но статистической значимости полученных результатов не выявлено (ANOVA>0,05).
Вышесказанное позволяет говорить об отсутствии негативного влияния замены триггера овуляции на параметры оо- и эмбриогенеза, что согласуется с данными кокрановского обзора [4, 16].
В ходе исследования выявлено, что в группе с заменой триггера на агонист ГнРГ СГЯ легкой степени развился у 11 пациенток (12,1%) (таблица), в группе с двойным триггером – у 16 (19,5%), в группе с ХГЧ – у 27 (31,8%). Имело место статистически значимое различие по частоте развития СГЯ легкой степени при сравнении I и III группы (p=0,001); при сравнении I и II группы, а также II и III группы статистически значимой разницы не обнаружили (р>0,05).
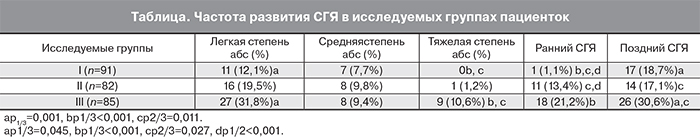
СГЯ средней тяжести развился в I группе у 7 пациенток (7,7%), во II группе у 8 (9,8%), в III группе – у 8 (9,4%);статистически значимых различий при сравнении частоты СГЯ средней степени тяжести в исследуемых группах не выявили (р>0,05).
Не зарегистрировано ни одного случая развития тяжелого СГЯ в группе с агонистом ГнРГ. В группе с двойным триггером частота развития СГЯ тяжелой степени составила 1,2% (n=1), что статистически значимо меньше по сравнению с группой с ХГЧ – 10,6% (n=9) (р1/2>0,05, р1/3<0,001, р2/3=0,011).
Немаловажно, что в I группе зарегистрирован всего 1 случай развития раннего СГЯ, не потребовавший госпитализации. У данной пациентки получено 14 ооцитов, концентрация эстрадиола в день введения триггера овуляции составила 19 896 пмоль/л, развившаяся клиническая картина соответствовала легкой степени тяжести, от переноса эмбриона было решено отказаться по желанию пациентки, симптомы СГЯ купировались самостоятельно. Остальные 17 случаев СГЯ в группе с агонистом ГнРГ возникли на фоне наступления беременности (поздний СГЯ), 7 из них – средней тяжести послужили поводом для госпитализации.
В группе с двойным триггером (II группа) зарегистрировано 11 случаев раннего развития СГЯ (3 из которых были средней степени тяжести) и 14 случаев позднего СГЯ на фоне беременности. Госпитализации потребовали все случаи СГЯ средней степени тяжести, а также тяжелая форма для проведения терапии, направленной на купирование симптомов СГЯ.
В группе с ХГЧ (III группа) зарегистрировано 18 случаев раннего развития СГЯ (два из которых были средней степени тяжести и два – тяжелой) и 26 случаев позднего развития СГЯ (таблица). Госпитализировали 18 пациенток, у которых развился СГЯ средней и тяжелой степени для проведения терапии, направленной на купирование симптомов СГЯ.
Таким образом, частота развития как ранних, так и поздних форм СГЯ статистически значимо ниже в I группе по сравнению с группой с ЧХГ (p1/3р<0,001, p1/3п=0,045). При сравнении I группы и группы с двойным триггером овуляции обнаружена статистически значимая разница в развитии раннего СГЯ (p1/2<0,001).
Перенос эмбрионов был отменен у 7 человек I группы: у 1 пациентки, как было сказано выше, развился ранний СГЯ легкой степени, у 3 произведен предимплантационный генетический скрининг с последующей криоконсервацией всех эмбрионов; у 1 – по семейным обстоятельствам, у 2 – в связи с острым респираторным заболеванием. Во II группе отмена переноса имела место у 11 пациенток в связи с развившимся СГЯ легкой и средней степени, в III группе – у 6 пациенток в связи с развившимся СГЯ средней и тяжелой степени. В каждом случае вопрос об отмене переноса решался индивидуально, с учетом клинической ситуации.
Таким образом, в группе, где в качестве триггера овуляции применялся агонист ГнРГ, имела место наименьшая частота развития СГЯ вообще (18 из 91, 19,8%); практически не наблюдалось случаев раннего развития СГЯ, что позволило произвести перенос эмбрионов большей части пациенток. Отмена переноса в этой группе в основном имела место из-за других показаний. Также в I группе не отмечено ни одного случая развития тяжелого СГЯ; у большинства пациенток степень синдрома была расценена как легкая, не потребовавшая госпитализации (11 из 18), и ухудшение самочувствия ассоциировалось с наступлением беременности.
Наиболее часто СГЯ развивался в группе, где не производилась замена триггера (группа с ХГЧ) – у 44 из 85 женщин (51,8%). Также на эту группу приходится наибольшая доля тяжелого СГЯ – 10,6%, то есть у каждой десятой пациентки и наибольшее число случаев раннего развития синдрома – 21,2%, что потребовало госпитализации и отмены переноса у трети пациенток.
Группа с двойным триггером занимает промежуточное место по частоте развития СГЯ между I и III группой – 25 случаев из 82 (30,5%). В этой группе зарегистрирован лишь 1 случай тяжелого СГЯ (1,2%), и реже, чем в группе с ХГЧ, имеет место раннее развитие синдрома (11 из 82 (13,4%)). Тем не менее, во II группе нередко отменяли перенос эмбрионов (11 женщин (13,4%)) в связи с ухудшением самочувствия пациенток к 5-м суткам после ТВП.
Частота наступления беременности на перенос эмбрионов составила 45,2% (n=38) в группе, где в качестве триггера овуляции был введен аГнРГ, 42,2% (n=30) в группе с двойным триггером и 45,6% (n=36) в группе с ХГЧ (ANOVA>0,05). Частота имплантации в I группе составила 38%, во II группе 30%, в группе с введенным ЧХГ 33% (ANOVA>0,05).Частота наступления клинической беременности статистически значимо не различалась и составила в I группе 45,2% (n=38), во II группе 40,8% (n=27) и в III группе 44,3% (n=35) (ANOVA>0,05). При сравнении групп между собой не было выявлено статистически значимых различий по частоте прерывания беременности: 4,8% (n=4), в группе с агонистом ГнРГ, 5% (n=4) в группе с двойным триггером, 8,4% (n=6) в группе с ЧХГ (ANOVA>0,05). Частота прогрессирующей беременности составила 40,5% (n=34), 32,4% (n=23) и 39,2% (n=31) соответственно (ANOVA>0,05). В группе с двойным триггером и в группе с ЧХГ было зарегистрировано по 1 случаю внематочной беременности, в группе с агонистом ГнРГ и ЧХГ также зарегистрировано по 1 случаю биохимической беременности. Частота многоплодной беременности составила 7,1% (n=6) в I группе, 5,6% (n=4) во II группе, 7,1% (n=6) в III группе (ANOVA>0,05). Частота родов живым плодом составила 27,4% (n=23) в I группе, 25,4% (n=18) во II группе, 34,2% (n=27) в III группе (ANOVA>0,05).
Обсуждение
Полученные данные позволяют говорить об эффективности использования замены триггера овуляции в целях профилактики развития СГЯ. Аналогичное нашему исследование провели в 2013 г. Humaidan и соавт. (двойное проспективное мультицентровое рандомизированное исследование), где применили замену триггера овуляции как у пациенток с высоким риском развития СГЯ, так и у женщин с нормальным ответом яичников. 118 пациенток с высоким риском развития СГЯ были разделены на группы с заменой триггера овуляции и введением 1500 МЕ ХГЧ в день ТВП (n=60) и с использованием только ХГЧ в дозе 5 000 ЕД (n=58). Поддержка лютеиновой фазы осуществлялась вагинальным прогестероном 90 мг 2 раза в день и препаратами эстрадиола в дозе 4 мг в день. Частота развития СГЯ в группе с ХГЧ составила 3,2%, в группе с заменой триггера овуляции случаев развития СГЯ не зарегистрировано. Частота наступления беременности на перенос составила 48,1% в первой группе и 36,8% во второй (p=0,23), частота клинической беременности – 35,0 и 29,3% соответственно (p=0,51), частота прогрессирующей беременности – 28,3 и 25,9% соответственно (p=0,76), частота ранних репродуктивных потерь также статистически достоверно не различалась – 16,0 и 19,0% [19].
По нашим данным частота наступления беременности, частота клинической беременности, частота прогрессирующей беременности и частота прерывания беременности также статистически достоверно не различались между аналогичными группами, и составили 45,2 и 45,6% (ANOVA>0,05), 45,2 и 44,3% (ANOVA>0,05), 40,5 и 39,2% (ANOVA>0,05), 4,8 и 5,0% (ANOVA>0,05) соответственно. Однако наши данные различаются по частоте развития СГЯ в исследуемых группах. В этой связи хочется отметить, что в работе Humaidan, несмотря на включение в исследуемые группы пациенток с высоким риском СГЯ, концентрация преовуляторного эстрадиола у последних составила 7936 пмоль/л и 6416 пмоль/л, а количество полученных ооцитов – 13,7 и 13,5 в группе с агонистом ГнРГ и в группе ХГЧ соответственно. В нашем же исследовании уровень эстрадиола в день введения триггера овуляции, а также среднее количество полученных ооцитов было выше; возможно, с этим и связана более высокая частота развития СГЯ у наших пациенток.
При анализе эмбриологических показателей, как и в нашем исследовании, не было выявлено разницы в количестве полученных ооцитов, зрелых, а также нормально оплодотворенных ооцитов. Однако оценка эмбрионов на 3-и и 5-е сутки не была опубликована, в то время как по нашим данным, выявлено статистически значимо большее количество бластоцист и бластоцист высокого качества в группе, где триггером овуляции был агонист ГнРГ [20]. В 2006 г. Acevedo и соавт. изучили эмбриологические показатели у доноров ооцитов, получавших в качестве триггера овуляции агонист ГнРГ (n=30) и ХГЧ (n=30). Не было выявлено статистически значимой разницы в количестве полученных ооцитов (327 и 288, р>0,05), зрелых ооцитов (70 и 76%, р>0,05), частоте оплодотворения (80 и 65%, р>0,05), качестве эмбрионов на 3-и сутки [3]. Bodri и соавт. в 2007 году в аналогичном исследовании выявили статистически значимо большее количество ооцитов и зрелых ооцитов, более высокую частоту оплодотворения у доноров в группе с агонистом ГнРГ, но качество эмбрионов на 3-и сутки статистически значимо не отличалось. СГЯ был зарегистрирован у 13 доноров, получивших в качестве триггера овуляции ХГЧ [21].
Наши результаты также подтверждают, что частота наступления беременности, частота клинической беременности, частота репродуктивных потерь сопоставима при замене триггера овуляции и последующем введении ХГЧ в день ТВП при сравнении с группой, получившей только ХГЧ. При анализе результатов в группе с двойным триггером овуляции мы обнаружили несоответствие с данными зарубежных авторов, так как частота наступления беременности в данной группе оказалась самой низкой среди исследуемых групп, а частота развития СГЯ выше по сравнению с группой, где использовался только агонист ГнРГ. Так Shapiro и соавт. в 2011 году изучили влияние двойного триггера на частоту развития СГЯ и частоту наступления беременности у 182 пациенток с высоким риском развития СГЯ; частота наступления беременности составила 58%, при частоте ранних репродуктивных потерь 23,4%; зарегистрирован только 1 случай развития СГЯ на фоне наступившей беременности [22].
Однако следует отметить некоторые отличительные особенности гормональной поддержки данного исследования: поддержка лютеиновой фазы осуществлялась препаратами эстрадиола, как трансдермальными формами в дозе 0,2–0,4 мг/день, так и пероральными – в дозе 6 мг/день; препараты прогестерона вводились и вагинально – 800 мг/день, и внутримышечно – инъекции 100 мг 2 раза в день. В качестве триггера овуляции вводили 4 мг лейпролида ацетата одномоментно с ХГЧ, дозировка последнего не была фиксирована и рассчитывалась как ≤33 МЕ/кг, средняя доза введенного ХГЧ составила 1428±831 МЕ [23]. В 2012 году Griffin и соавт. получили схожие результаты: частота наступления беременности составила 41,9%, частота клинической беременности 58,8%, при частоте ранних репродуктивных потерь 11%, зарегистрирован 1 случай развития СГЯ. В качестве триггера овуляции вводили 1 мг лейпролида ацетата одномоментно с фиксированной дозой 1000 МЕ ЧХГ. Поддержка лютеиновой фазы осуществлялась внутримышечным введением прогестерона 50 мг/день, 0,3 мг трансдермального эстрадиола [23]. Так как в нашем исследовании не использовалось внутримышечное введение прогестерона, мы предполагаем, что заявленная нами частота наступления беременности при двойном триггере овуляции может быть связана с низкими концентрациями прогестерона в лютеиновую фазу, несмотря на проводимую поддержку.
Данные, полученные нами при анализе группы с ХГЧ, сопоставимы с таковыми, полученными в 2008 году Engmann и соавт, где частота развития СГЯ при введении ХГЧ составила 31%. Однако в данной группе пациентки подвергались стимуляции суперовуляции в рамках длинного протокола [24].
Несмотря на то что вышеизложенные исследования говорят об отсутствии развития СГЯ на фоне замены триггера овуляции, в последние годы появляются сообщения о развитии СГЯ при введении агониста ГнРГ и тотальной криоконсервации всех полученных эмбрионов с отменой переноса в лечебном цикле. Так Seyhan и соавт. в 2013 году у 23 пациенток с высоким риском развития СГЯ, при замене триггера овуляции и последующем введении ХГЧ в дозе 1500 МЕ в день ТВП, выявили раннюю форму СГЯ у 6(26%) пациенток, у пятерых из них – тяжелой степени; однако концентрация преовуляторного эстрадиола достигала 30 695,88 пмоль/мл, а число ооцитов – от 23 до 65 [25]. В противоположность этим результатам Atkinson и соавт. в 2014 году не зарегистрировали ни одного случая СГЯ после замены триггера овуляции и тотальной криоконсервации эмбрионов, но в данной работе не использовали дополнительное введение ХГЧ в день ТВП [26].
По нашим данным, замена триггера овуляции полностью не предотвращает развития СГЯ, но эффективно снижает его. Так при расчете чувствительности и специфичности выявлено, что при введении ХГЧ женщине с высоким риском развития СГЯ вероятность развития синдрома средней и тяжелой степени составляет 53%, однако при замене триггера овуляции в 77% случаев данное осложнение не развивается.
Заключение
На основании результатов исследования можно сделать вывод о том, что замена триггера овуляции на агонист ГнРГ у пациенток с высоким риском СГЯ эффективно снижает частоту развития СГЯ и не оказывает негативного влияния на частоту наступления беременности при модификации лютеиновой фазы. Возможно, с накоплением новых данных точка зрения на роль и место замены триггера овуляции в протоколах с антагонистами ГнРГ изменится, и агонист ГнРГ станет не только методом профилактики СГЯ, но и заменит ХГЧ как триггер овуляции у всех категорий женщин.



