Воспалительные заболевания женских половых органов до настоящего времени составляют серьезную медицинскую и социальную проблему в акушерстве и гинекологии, занимая ведущее место (55–70%) в структуре гинекологической заболеваемости [1]. Значительную долю в них занимают инфекции вульвы и влагалища. Наиболее часто в клинической практике выявляются бактериальные вагинозы (БК) (22–50% случаев патологических вагинальных выделений), кандидозный вульвовагинит (КВВГ) (17–39%), трихомонадный вагинит (4–35% случаев) [2–5]. Пациентки с данными проблемами встречаются на приеме не только гинеколога, но и дерматовенеролога, проктолога, уролога, терапевта, клинического иммунолога.
В последнее десятилетие, несмотря на комплексные подходы в использовании антибактериальных препаратов, антимикотиков, противовирусных препаратов, препаратов местного использования, в корне изменился спектр микроорганизмов, доминирующих в этиологии воспалительных процессов вульвы и влагалища. Все чаще стали встречаться микробные ассоциации, обусловливающие более тяжелое течение процесса или же протекающие в виде хронической, невыраженной клинически форме.
Главными причинами развития патологического процесса во влагалище считают гормональные нарушения, изменения состояния местного и общего иммунитета (снижение количества иммуноглобулина А (IgA), циркулирующих иммунных комплексов, СЗ-компонента комплемента), бессистемную антибактериальную терапию, перенесенные или сопутствующие воспалительные заболевания женских половых органов. При этом снижение неспецифической резистентности у больных с нарушением микробиоценоза влагалища является одной из причин воспалительного процесса, рецидивирующего его течения, торможения регенерации и восстановления функции пораженных органов [6–9].
Не менее важной и трудоемкой задачей практикующего гинеколога является лечение дисбиотических заболеваний влагалища. В связи с широким и порой бессистемным назначением противомикробных и антимикотических препаратов, а также высокой частотой самолечения возбудители данных заболеваний в настоящее время характеризуются резистентностью в отношении большого числа лекарственных средств. В настоящее время до 80% таких заболеваний проявляются в хронических формах, имеют рецидивирующий характер на фоне снижения иммунологической резистентности организма, которое позволяет даже маловирулентным возбудителям проявлять свои патогенные свойства, с торпидным к этиотропным препаратам течением процесса [6–8, 10, 11].
В настоящее время разработаны многочисленные схемы комбинированной терапии, традиционные подходы с доказательной базой ее эффективности, но не всегда специалистами учитывается значимость иммунологических процессов в патогенетическом механизме развития хронического воспалительного процесса, первоначально с позиции нарушения врожденного иммунного ответа, а в последующем с течением времени и адаптивного. Отсюда и подход к комбинированной терапии с использованием иммуномодулирующих препаратов, выбор которых многообразен для клинического использования, он должен учитывать эти аспекты. Нарушение координированной работы иммунной системы является значимым фактором в исходе того или иного заболевания.
Вопрос о тактике ведения пациентов с заболеванием вульвы и влагалища инфекционно-воспалительного генеза в плане назначения иммуномодулирующих препаратов остается дискутабельным, поскольку нет четких рекомендаций по выбору препарата, использование иммуномодуляторов врачами не-иммунологами происходит зачастую без предварительного иммунологического обследования. Некоторые специалисты полагают, что тактика должна быть выжидательной, в связи с чем назначение препаратов местного воздействия на слизистую генитальной сферы с целью иммунокоррекции происходит в конце курса терапии, без контроля иммунологических показателей, что зачастую не дает возможности убедительно отследить терапевтический эффект.
 Разумеется, использовать иммунотропные препараты необходимо лишь в тех случаях, когда изменения иммунной системы носят патогенетически значимый характер. Это в первую очередь происходит при хронической рецидивирующей инфекционной, онкологической, аутоиммунной, лимфопролиферативной и аллергопатологии [11].
Разумеется, использовать иммунотропные препараты необходимо лишь в тех случаях, когда изменения иммунной системы носят патогенетически значимый характер. Это в первую очередь происходит при хронической рецидивирующей инфекционной, онкологической, аутоиммунной, лимфопролиферативной и аллергопатологии [11].
Кроме того, иммунокоррегирующая терапия должна быть индивидуальна, с учетом данных анамнеза, клиники, показателей иммунного статуса, носить поэтапный характер в зависимости от этапа иммунокоррекции (базисный, закрепляющий, поддерживающий, профилактический).
В связи с этим целью исследования стало изучение эффективности индуктора интерферона оксодигидроакридинилацетата натрия на динамику клинических проявлений и иммунологических показателей в комплексной терапии бактериальных вагинозов (БВ) и кандидозных вульвовагинитов (КВВ).
Материал и методы исследования
Исследование проводилось на базе клиники Омского государственного медицинского университета в период с февраля по август 2015 г.
В исследовании участвовали 56 женщин в возрасте от 25 до 39 лет (средний возраст – 32,42±6,98 года), направленных на консультацию к иммунологу врачами гинекологами лечебно-профилактических учреждений (ЛПУ) города Омска.
Критерии включения: наличие клинико-лабораторных признаков БВ и КВВ; длительность заболевания с момента постановки диагноза не менее 1 года; предшествующее неэффективное лечение с учетом стандартов и клинических рекомендаций; возраст 25–40 лет.
Критерии исключения: беременность; наличие тяжелой коморбидной патологии, сопровождающейся декомпенсацией функций внутренних органов и систем; наличие аллергических заболеваний и заболеваний, протекающих с аутоиммунным компонентом; прием любых иммуномодулирующих препаратов менее чем за 3 месяца до включения в исследование; курсы стероидных гормонов. На этапе включения в исследование все пациентки подписали информированное согласие.
Базовый гинекологический осмотр и дополнительные обследования (общеклинический анализ крови, обследование содержимого влагалища и цервикального канала на вирусные, бактериальные, протозойные агенты методом полимеразной цепной реакции (ПЦР); бактериоскопическое исследование влагалищной флоры; цитологическое исследование мазков-отпечатков влагалища и из нижней трети цервикального канала) выполнялись врачами-гинекологами ЛПУ.
С целью оценки состояния иммунного и интерферонового статуса у всех участниц исследования было проведено определение Т- и В-лимфоцитов и их субпопуляции с применением моноклональных антител (CD-3, CD-4, CD-8, CD-19, CD16 и др.) (цитофлюориметр, FACSCalibur (США)), основных классов иммуноглобулинов (метод ИФА, реактивы ЗАО «Вектор-Бест», г. Новосибирск).
В итоге в группу исследования вошли 56 пациенток с клиническими проявлениями воспалительного процесса генитальной сферы в виде бактериального вагиноза и кандидозного вульвовагинита.
В процессе исследования всем женщинам проведена терапия бактериального вагиноза, кандидозного вульвовагинита в соответствии с принятыми стандартами (Приказ МЗРФ от 24.12.2012 г. № 1502н «Об утверждении стандарта первичной медико-санитарной помощи при воспалительных заболеваниях половых органов»). Системная терапия дополнялась местными физическими и лекарственными воздействиями на слизистую. Выбор метода и препаратов определялся широтой спектра действия и возможностью быстрого достижения противовоспалительного эффекта.
Комплексная терапия была дополнена индуктором интерферона оксодигидроакридинилацетатом натрия (неовир, ЗАО «Фармсинтез», Россия) [12–14].
Оксодигидроакридинилацетат натрия включали в комплексную терапию с момента обострения заболевания в виде внутримышечных инъекций. Первая инъекция производилась внутримышечно в дозе 500 мг накануне этиотропной терапии. Вторая, соответственно, в дозе 250 мг, через 24 часа после первой и совпадала с назначением антимикробной и антимикотической терапией. Далее оксодигидроакридинилацетат натрия вводился трижды в дозе 250 мг с интервалом между введениями 48 часов. Противорецидивное лечение в виде еженедельных инъекций по 250 мг проводилось дважды, затем трижды по 250 мг с интервалом в 2 недели. Непосредственно перед инъекцией допускалось разведение препарата 2 мл 1% раствора новокаина (с учетом переносимости препарата).
Выбор препарата был обусловлен его способностью вызывать быстрое нарастание титров эндогенных интерферонов α, β, γ, в особенности интерферона-α (INF-α). Известно, что иммуномодулирующее действие препарата обусловлено способностью активировать стволовые кроветворные клетки, устранять дисбаланс субпопуляций Т-лимфоцитов, с активацией эффекторных звеньев Т-клеточного иммунитета, оказывать стимулирующий эффект на функциональную актвиность макрофагов и полиморфноядерных лейкоцитов, усиливая их фагоцитарную активность [12].
Комплекс перечисленных механизмов действия позволяет оксодигидроакридинилацетату натрия напрямую или посредством регуляции активности иммунной системы включаться в процесс элиминации самых разнообразных инфекционных агентов, проявлять иммуномодулирующее действие. Иммуномодулирующая, противовирусная, противовоспалительная активность оксодигидроакридинилацетата натрия способствует улучшению общего состояния больных, астенизированных хроническим воспалительным процессом [15]. Кроме того, препарат обладает противовирусной активностью в отношении ДНК- и РНК-геномных вирусов. Активность препарата связана с его способностью индуцировать образование в организме высоких титров эндогенных интерферонов, особенно INF-α. Данные литературы свидетельствуют, что применение оксодигидроакридинилацетата натрия эффективно в лечении ряда заболеваний (урогенитальный хламидиоз, микоплазмозы, уреаплазмозы, остроконечные кондиломы, рецидивирующий герпес, хроническая пиодермия, нейровирусные инфекции, вирусные гепатиты, респираторные инфекции, герпесвирусные инфекции, эпидемический паротит, клещевой боррелиоз, бактериальные менингиты и пневмонии, фурункулез, кандидозные поражения кожи и слизистых, приобретенные иммунодефициты с угнетением системы интерферонов, в терапии онкологических заболеваний и др.) [16, 17].
Клинические эффекты применения оксодигидроакридинилацетата натрия получены и в гинекологической практике, в комплексной терапии герпесвирусной инфекции, папиломавирусной инфекции, что диктует необходимость более глубокого изучения клинической эффективности оксодигидроакридинилацетата натрия в терапии воспалительных заболеваний гинекологической сферы [16].
Согласно протоколу исследования, оценка эффективности комплексной терапии с включением препарата оксодигидроакридинилацетата натрия у пациенток с БВ и КВВ проводилась в трех исследовательских точках: исходно (исследовательская точка 1), через 4 недели (исследовательская точка 2), через 24 недели (исследовательская точка 3), на основании: клинических данных (исчезновение жалоб; динамики объективных проявлений заболевания; увеличение продолжительности ремиссии не менее чем в 1,5 раза); лабораторных данных (динамики показателей интерферонового статуса; количества Т-лимфоцитов, субпопуляций CD4 и CD8, CD3, количества В-лимфоцитов (CD20), иммуноглобулинов A, M, G).
Описание и статистическая обработка полученных результатов проводилась с учетом характера распределения и типа данных. Для описания количественных признаков связанных групп использовали критерий Вилкоксона. Критический уровень значимости нулевой статистической гипотезы (р) принимали равным 0,05.
Результаты и обсуждение
Анализ данных показал, что давность бактериального вагиноза и кандидозного вульвовагинита составила 2,1±0,67 года; частота обострений – 1 раз в 1–2 месяца.
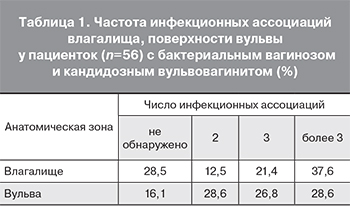
По данным исследования микрофлоры вульвы, влагалища чаще диагностировался стафилококк (14,6%; 21,2% соответственно), грибы кандида (28,1%; 27,6% соответственно), вирус простого герпеса 2-го серотипа (17,4%; 11,5% соответственно), серотипы вируса папилломы человека высокого онкогенного риска (11,6%; 10,8% соответственно). Причем во всех анатомических зонах отмечена высокая частота сочетаний различных инфекционных агентов, что, вероятно, свидетельствует о нарушениях в биоценозе генитального тракта с развитием хронического воспаления в тканях (табл. 1). Вследствие длительного воздействия токсических экзогенных или эндогенных веществ, а также за счет увеличенной бактериальной и вирусной нагрузки на иммунную систему наблюдается рецидивирование локального инфекционно-воспалительного процесса.
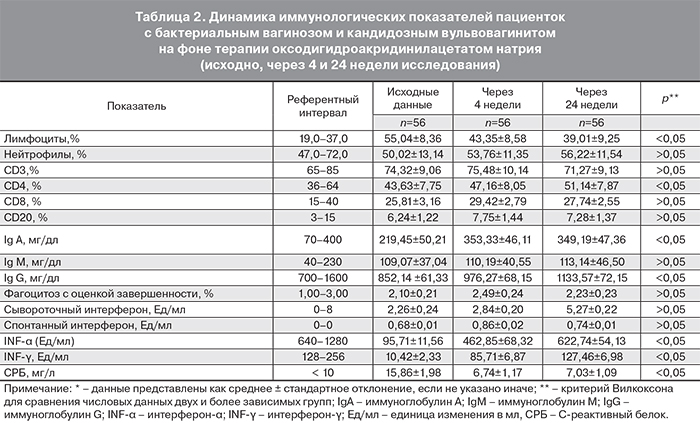
Анализ параметров иммунного статуса, полученных исходно (на этапе включения в исследование) выявил, несмотря на, казалось бы, локальный характер воспалительного процесса, недостаточность иммунологического контроля на системном уровне (табл. 2).
Клиническая эффективность проводимой терапии с применением оксодигидроакридинилацетата натрия выражалась в исчезновении выделений из половых путей в 17,0% случаев на 3-и сутки от начала терапии, в 69,0% – через 5 дней от начала лечения, в 100,0% случаев – через 10 дней контрольного наблюдения. Уменьшение субъективных симптомов (зуда и жжения в области вульвы, дизурических расстройств) у 59,0% пациенток наблюдалось к третьим суткам терапии. К пятым суткам доля пациенток с уменьшением субъективных проявлений возросла до 89,0%. Полное исчезновение симптомов наблюдалось к 10-му дню терапии (100,0%).
Очевидно, что исходно у всех (100,0%) участниц исследования имели место изменения интерферонового статуса (табл. 2). Причем значимых изменений со стороны сывороточного и спонтанного интерферона обнаружено не было. В то время как выявлена недостаточность резервных возможностей интерфероногенеза: существенно снижена (в 4–8 раз ниже нормы) способность клеток крови к выработке INF-α, и в 8–16 раз – INF-γ. Анализ параметров интерферонового статуса на фоне терапии оксодигидроакридинилацетатом натрия, показал существенную динамику уже к концу 4-й недели терапии, которая в значительной мере сохраняется на протяжении всего срока наблюдения. Иными словами, к концу курса терапии оксодигидроакридинилацетатом натрия нарушение функционирования системы интерферонов стабилизировалось, существенно возросла (в 6 и 12 раз соответственно) способность клеток к продукции INF-α и INF-γ.
В ходе исследования дополнительно проводилось контрольное изучение показателей интерферонового статуса после второй и пятой инъекции оксодигидроакридинилацетата натрия. Уже после второй инъекции препарата отмечался рост концентрации сывороточного интерферона. Причем несмотря на то что значения параметров укладывались в референтный интервал нормы (0–8 ЕД/мл), имело место значимое увеличение продукции клетками крови INF-α (в 2 раза) и INF-γ (в 1,5 раза).
При анализе иммунологических показателей выявлено также исходное снижение субпопуляции Т-лимфоцитов (CD4+), главных регуляторных клеток иммунного ответа, от деятельности которых зависит его эффективность. На фоне применения препарата отмечалась незначительная динамика CD4+ к 4-й неделе лечения, в то время как к концу наблюдения динамика стала весьма очевидной, приближаясь к нижней границы референтного интервала, что указывает на иммуномодулирующее свойство препарата с активацией эффекторных звеньев Т-клеточного иммунитета.
При оценке гуморального иммунитета выявлено увеличение острофазовых белков, в частности С-реактивного белка, с четкой динамикой его снижения на фоне комплексной терапии; изменение количества общего IgА, достаточно значимых при сопоставлении 1-й и 3-й исследовательских точек, что чрезвычайно важно для стабилизации местного иммунного ответа у пациенток с БВ и КВВ.
Достаточно высокие значения относительного количества лимфоцитов (при неизменных абсолютных показателях) объясняют функциональное предназначение иммунокомпетентных клеток в борьбе с бактериальной и вирусной инфекцией (табл. 2).
Полученные результаты убедительно демонстрируют роль оксодигидроакридинилацетата натрия в стойкой нормализации интерферонового статуса и стабилизирует Т-клеточное звено иммунитета, что позволяет рекомендовать включение его в состав комплексной терапии больных с бактериальным вагинозом и кандидозным вульвовагинитом.
Безусловно, исследование имеет ряд ограничений: небольшая выборка, отсутствие контрольной группы, короткий период наблюдения. Планируется продолжить исследование для получения отдаленных результатов с целью оценки межрецидивного периода в аспекте изменения иммунологических параметров.
Заключение
На основании представленных данных можно говорить об эффективности иммунотропной терапии оксодигидроакридинилацетатом натрия в гинекологической практике в комплексной терапии заболеваний, сопровождающихся длительной персистенцией инфекционного агента, дисбиотическими процессами, такими как бактериальный вагиноз, кандидозный вульвовагинит, плохо поддающихся лечению стандартными методами терапии.



