Известно, что в течение нормальной беременности наблюдается значительное повышение маркеров окислительного стресса. Окислительный стресс связан с развитием ряда таких заболеваний и осложнений беременности, как преэклампсия (ПЭ), задержка роста плода, сахарный диабет и др. [1–4]. Кроме того, была доказана роль окислительного стресса в сосудистой дисфункции плаценты и нарушении адаптации новорожденного [5].
Показано, что повышенный окислительный стресс во время беременности вызывает нарушения на эпигенетическом уровне, которые приводят к развитию предрасположенности к сердечнососудистым заболеваниям у детей [6, 7]. При исследовании системы мать-плацента-плод было обнаружено, что уровень продуктов перекисного окисления липидов и малонового диальдегида значительно снижен в пупочном канатике по сравнению с материнской кровью [8–10]. Эти данные указывают на ключевую роль плаценты в предохранении плода от негативного воздействия окислительного стресса, возникающего в крови матери во время беременности. Основным продуцентами активных форм кислорода (АФК) являются нейтрофилы, которые способны к поглощению кислорода (респираторному взрыву) с образованием супероксид-аниона кислорода и его производных путем немитохондриальной активации многокомпонентного белкового комплекса НАДФН-оксидазы, способного окислять восстановленный никотинамидадениндинуклеотидфосфат (НАДФН) и перемещать электроны с НАДФН на молекулярный кислород. Известно, что во время беременности нейтрофилы подвергаются деактивации, и во время «респираторного взрыва» вырабатывается сниженное количество АФК [11]. Однако при ПЭ деактивации нейтрофилов не происходит [12]. Исследование активности ферментов нейтрализующих АФК в крови показали, что у женщин с ПЭ активность фермента супероксиддисмутазы (SOD), дисмутирующего супероксидные радикалы, снижена по сравнению с нормой. При этом ферменты разрушающие перекись водорода (каталаза, глутатионпероксидаза и глутатионредутаза) имеют повышенную активность при ПЭ [13].
Ранее при исследовании плаценты было обнаружено, что при ПЭ в плаценте выражены процессы апоптоза, приводящие к нарушению целостности сосудистой части плаценты, на фоне компенсирующего возрастания уровня экспрессии антиоксидантных ферментов глутатионпероксидазы GPX1 и глутатионредутазы GSR [11].
В связи с чем, в работе был оценен окислительный стресс в крови женщин в III триместре физиологически протекающей беременности и при ПЭ. Для уточнения причин возникновения окислительного стресса, и возможных патологических процессах, развивающихся вследствие окислительного стресса, был изучен ряд биохимических и общих параметров с проведением корреляции с уровнем окислительного стресса.
Материал и методы исследования
В исследование были включены 29 пациенток, в том числе 21 беременная женщина в III триместре беременности. Из них 10 с тяжелой или умеренной ПЭ и 11 женщин с физиологически протекающей беременностью, также было исследовано 8 здоровых небеременных женщин. Все пациентки, включенные в исследование, были сопоставимы по возрасту и исходной клинической характеристике. Средний возраст составил 27,4±1,2, 28,6±1,4 и 26,9±2,2 года соответственно.
Критерии включения в исследование:
- Для основной группы: одноплодная беременность, наступившая в естественном цикле, осложненная ПЭ.
- Для группы сравнения: неосложненное течение данной одноплодной беременности, наступившей в естественном цикле. Критерии исключения общие: многоплодная беременность, острые воспалительные заболевания, тяжелая экстрагенитальная патология, аутоиммунные и онкологические заболевания.
Уровень АФК и антиоксидантной защиты был определен с помощью прибора FORM 3000 (Каллегари, Италия) с использованием тестов FORT, FORD соответственно. Тест FORT основан на способности ионов железа катализировать в присутствии гидроперекисей (ROOH) образование свободных радикалов кислорода, при связывании которых производное амина CrNH2 образует устойчивое окрашенное соединение. Интенсивность окраски прямо коррелирует с уровнем АФК в исследуемом образце. Тест FORD основан на взаимодействии предварительно образованных окрашенных радикалов с антиоксидантами исследуемого образца. Интенсивность окраски обратно коррелирует с уровнем антиоксидантов в исследуемом образце. Уровень АФК представлен в виде эквивалентного количества перекиси водорода (ммоль/л; Н2О2), уровень антиоксидантов – представлен в виде эквивалентного количества антиоксиданта тролокса (ммоль/л; тролокс). В качестве исследуемого материала была использована сыворотка венозной крови, полученная путем центрифугирования при 800g в течение 10 мин при 4оС. Для забора крови использовались стандартные пробирки с гепарином в качестве антикоагулянта. От момента забора крови до проведения тестов проходило не более 30 минут. Тесты проводились согласно инструкции изготовителя.
Был проведен корреляцинный анализ полученных результатов с 13 лабораторными показателями (уровень лейкоцитов, нейтрофилов абсолютных и относительных, тромбоцитов, гемоглобина, белка в моче, фибронектина, протромбинового индекса, ферментов аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ)).
Значимость различий между выборками оценивали с использованием однофакторного дисперсионного анализа (ANOVA), со значением p<0,05.
Достоверность корреляционных зависимостей определяли при помощи теста ранговой корреляции Спирмена. Достоверными корреляции считались при р<0,05. Данные представлены в виде среднего значения ±стандартное отклонение.
Результаты исследования
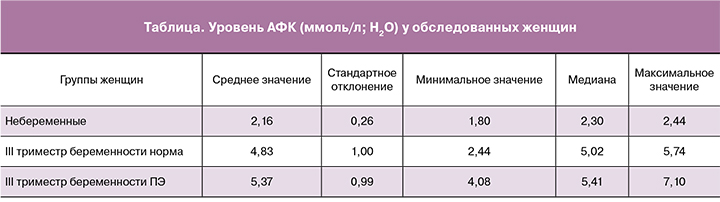
Был проведен сравнительный анализ уровня АФК (FORT) и антиоксидантной защиты (FORD) в периферической крови беременных. Установлено, что уровень АФК в норме к III триместру беременности повышается в 2,2 раза (таблица).
Значение уровня АФК в группе небеременных здоровых женщин находилось в диапазоне от 1,80 до 2,44 ммоль/л; Н2О2, среднее значение 2,16±0,26. В группе физиологически протекающей беременности колебалось от 2,44 до 5,74 ммоль/л; Н2О2, среднее значение составили 4,83±1,00. В группе ПЭ уровень АФК составлял от 4,08 до 7,10 ммоль/л; Н2О2, среднее значение 5,37±0,99. Вместе с тем, группе с ПЭ среднее значение FORT было выше на 20%, в отличие от здоровых беременных, статистически значимых различий не выявлено. По уровню антиоксидантной защиты также не было выявлено статистически значимых различий среди исследуемых групп.
Значения уровня антиоксидантов в группе небеременных здоровых женщин находились в пределах от 0,5 до 1,66 ммоль/л; тролокс, среднее значение 0,98±0,47; при физиологически протекающей беременности значимых отличий выявлено не было, и уровень составил от 0,4 до 1,07 ммоль/л; тролокс, среднее значение 0,7±0,25. При ПЭ отмечалось снижение уровня антиоксидантов, не достигающее, однако статистической значимости (0,25–0,89 ммоль/л тролокс), среднее значение 0,6±0,18.
Был проведен корреляционный анализ значений АФК и уровня антиоксидантной защиты в группах с физиологически протекающей беременностью и ПЭ со следующими параметрами: уровень лейкоцитов, нейтрофилов абсолютных и относительных, тромбоцитов, гемоглобина, белка в моче, фибронектина, протромбинового индекса, ферментов АЛТ, АСТ (рисунок).
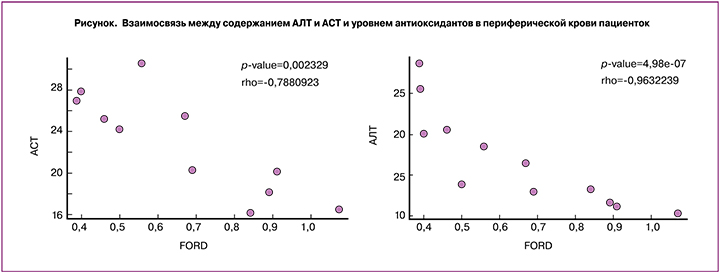
Было установлено, что в обеих группах имеется корреляция между увеличением уровня ферментов АЛТ, АСТ в крови и снижением антиоксидантной защиты (рисунок). Кроме того, при ПЭ была обнаружена корреляция между повышением уровня АФК с увеличением относительного количества нейтрофилов и уровня белка в моче и положительная корреляция между уровнем окислительного стресса и уровнем протеинурии. В тоже время при физиологической беременности повышение уровня АФК в крови не коррелировало с наличием белка в моче.
Обсуждение результатов
Было установлено, что уровень АФК к III триместру беременности в крови женщин возрастает более чем в два раза по сравнению с небеременными, и не имеет значимых различий при физиологической беременности и ПЭ. Вместе с тем, ПЭ сопровождается увеличением содержания уровня свободных радикалов в 1,3 раза, что свидетельствует о дисбалансе про и антиоксидантных систем. Кроме того, обнаружена корреляция между тяжестью ПЭ, уровнем АФК в крови и протеинурией. Полученные результаты отражают, что при ПЭ достижение уровня АФК даже соответствующее нормативным показателям приводит к развитию патологии. При этом анализ корреляции между протеинурией и уровнем АФК установил пороговое значение АФК выше 4,3 ммоль/л; Н2О2. Причиной развития ПЭ при нормальных уровнях окислительного стресса может быть отсутствие необходимой адаптации организма к беременности. Это подтверждается отсутствием деактивации «респираторного взрыва» нейтрофилов у женщин с ПЭ [12]. При этом происходит более значительная продукция супероксид-аниона кислорода нейтрофилами при взаимодействии с аллогенными клетками плода и плаценты. При ПЭ снижается активность фермента супероксиддисмутазы (SOD), дисмутирующего супероксидные радикалы [8],
что в целом может способствовать разрушению клеток плаценты. Обнаруженная нами корреляция уровня АФК с относительным количеством нейтрофилов в группе ПЭ подтверждает взаимосвязь нейтрофилов с ПЭ. Несмотря на то, что значительный уровень окислительного стресса в крови у женщин с физиологической беременностью не вызывает развития ПЭ, его необходимо контролировать, так как АФК могут вызывать развитие эндотелиальной дисфункции у плода [6, 7]. В данной работе мы не увидели значимых различий в уровне антиоксидантов среди исследуемых групп, что, по-видимому, требует проведения дальнейших исследований.
Заключение
Таким образом, проведенное исследование показывает значимость окислительного стресса в развитии ПЭ и необходимости динамического контроля за уровнем окислительного стресса и антиоксидантной защиты, и обосновывает целесообразность изучения возможности применения антиоксидантов в терапии и профилактике осложнений беременности, в том числе и ПЭ.



