Несмотря на успехи репродуктивной медицины, частота наступления беременности в программах вспомогательных репродуктивных технологий (ВРТ) не превышает 35% [1]. Для успешной имплантации необходимо гармоничное взаимодействие зрелой бластоцисты с рецептивным эндометрием. Имплантация – это сложный многоуровневый процесс, включающий адгезию, инвазию бластоцисты и индукцию плацентации. Безусловно, качество эмбриона в значительной степени определяет успех имплантации. Однако при повторных неудачных имплантациях с высоким качеством эмбриона большое внимание уделяется оценке рецептивности эндометрия и процессам синхронизации между развитием бластоцисты и слизистой оболочкой матки.
Известно, что первым и длительное время считавшимся золотым стандартом методом оценки рецептивности эндометрия являлось гистологическое исследование в соответствии с критериями Noyes R.W. [2]. Однако проведенные впоследствии исследования показали, что с помощью гистологических критериев зачастую не удается дифференцировать эндометрий фертильных женщин от бесплодных [3, 4]. Поэтому исследования в поисках новых методов оценки рецептивности эндометрия продолжались.
Одним из последних направлений этой области стало изучение транскриптома генов в тканях эндометрия. В большинстве работ изучали транскриптомы эндометрия в соответствии с гистологической верификацией стадии трансформации эндометрия. Так как считается, что период «окна имплантации» соответствует средней стадии фазы секреции естественного менструального цикла, то основное внимание уделялось этой стадии [5–9]. В результате были предложены возможные кандидаты на роль биомаркеров идентификации «окна имплантации».
Результатом молекулярно-генетических исследований стало внедрение в коммерческую практику двух тестов: ЕRА – Endometrial Receptivity Array [10] и Win-Test [5]. Тест-система ERA включает в себя массив из 238 генов с последующим определением рецептивности эндометрия. В то же время Win-Test основан на оценке экспрессии 11 генов с применением алгоритмов, также позволяющих оценить восприимчивость эндометрия. В России данные разработки для применения в рутинной практике до настоящего времени не распространены.
Условия современных тенденций определяют необходимость проведения дополнительных исследований для оптимизации выбора биомаркеров рецептивности эндометрия и определения их роли в установлении диалога между эндометрием и бластоцистой, которые влияют на наступление и исход беременности.
Цель исследования состояла в оценке исходов программ ВРТ в зависимости от молекулярно-генетических профилей дифференциально экспрессируемых генов в период предполагаемого «окна имплантации».
Материалы и методы
В исследование включены 104 женщины, обратившиеся для проведения программы криопереноса. Была проведена пайпель-биопсия эндометрия на 7–8-й день после пика лютеинизирующего гормона (ЛГ) в естественном цикле. Пик ЛГ определяли с помощью мочевого теста на овуляцию Clear Blue (Unipath Ltd, Великобритания). Пайпель-биопсию эндометрия производили с помощью аспирационной кюретки Pipele de Corner (Laboratorie C.C.D., Франция). Полученный материал был разделен на 2 части: для гистологического и молекулярно-генетического исследования. Материал для изучения экспрессии генов методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) в реальном времени помещали в пробирки с транспортной средой для стабилизации РНК (Стор-экс, ООО «НПО ДНК-Технология», Россия).
Гистологическое исследование: биоптаты эндометрия фиксировали в течение 24 ч в 10% формалине с фосфатным буфером, с последующим помещением в парафин. Срезы толщиной не более 4–5 мкн окрашивали гематоксилин-эозином и исследовали с помощью светового микроскопа при увеличении от ×50 до ×400.
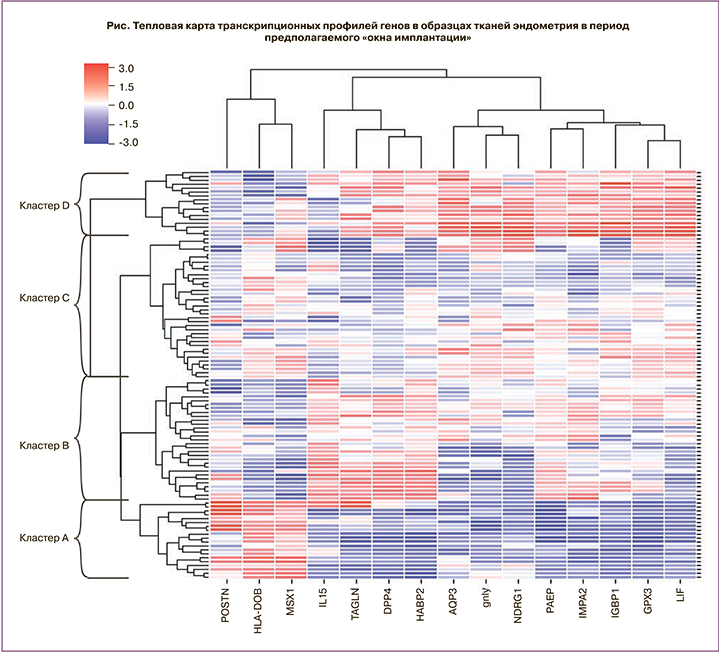
Молекулярно-генетическое исследование: в полученных образцах эндометрия было проведено изучение экспрессии мРНК генов: GPX3, PAEP, LIF, DPP4, TAGLN, HABP2, IMPA2, AQP3, HLA-DOB, MSX1, POSTN, IGFBP1, IL15, GNLY, NDRG1 методом ОТ-ПЦР в режиме реального времени.
Образцы тканей размораживали при комнатной температуре, удаляли транспортную среду и выделяли РНК с использованием QIAzol Lysis Reagent и RNeasy Mini Kit (Qiagen, Германия).
Для постановки ОТ-ПЦР использовали реактивы, оригинальные олигонуклеотиды и детектирующий амплификатор «ДТПрайм» производства ООО «НПО ДНК-Технология» (Россия). Реакцию ОТ проводили при температуре 40° С в течение 30 минут, с последующей инактивацией обратной транскриптазы при 95 ºС в течение 5 минут.
Амплификацию осуществляли в режиме реального времени в объеме 12 мкл по программе: 15 циклов – 80˚С 5 с, 94˚С 5 с; 1 цикл – 94˚С 5 минут; 50 циклов – 94˚С 20 с, 64˚С 20 с; 10˚С – хранение. Измерение уровня флуоресценции проводили на каждом цикле при температуре 64 ºС по каналу флуоресценции FAM. Для повышения чувствительности и специфичности ПЦР применяли «горячий старт», который обеспечивался полимеразой с антителами (TechnoTaq). Активация фермента происходила только после прогрева амплификационной смеси при 95°С в течение 5 минут. Реакцию ставили в двух повторах для каждой точки.
Обработка результатов осуществлялась с помощью программы Exсel на основании данных, полученных с помощью прибора. Использован метод сравнения индикаторных циклов (метод ΔCq и метод ΔΔCq). Уровень экспрессии мРНК исследуемых генов измерялся в относительных единицах (о.е.), отражающих представленность транскрипта гена относительно нормировочного фактора, рассчитанного на основе уровня экспрессии мРНК референсных генов TBP, B2M и GUSB.
Транскрипционные профили образцов были отображены при помощи тепловой карты. Проводились log-трансформация и нормировка данных стандартным способом z-оценки. На основании этих показателей был реализован кластерный анализ методом полной связи с использованием евклидового расстояния. Тепловая карта и сопутствующие вычисления были выполнены при помощи программных разработок на языке Python 2.7 и его библиотек: Sklearn, Skipy, Pandas, Matplotlib, Seaborn.
Перенос 1 размороженного эмбриона в полость матки 22 пациенткам был произведен на день ЛГ+7–8 в естественном цикле; 82 женщинам – на 6-й день назначения микронизированного прогестерона (П+5) в цикле гормональной терапии под контролем ультразвукового исследования с помощью катетера Соок (Австралия). Прием микронизированного прогестерона продолжали в течение 14 дней с последующим тестом на диагностику беременности. Основными показаниями для переноса эмбрионов на фоне циклической гормонотерапии были безуспешные попытки переноса эмбриона в анамнезе в естественном цикле.
Исходы лечения оценивали путем определения уровня ß-хорионического гонадотропина (ß-ХГ) в сыворотке крови через 14 дней после переноса эмбриона. Положительным считали уровень ß-ХГ более 20 МЕ/л. Заключение об успешной имплантации (клиническая беременность) было установлено после верификации сердцебиения эмбриона в полости матки при сроке беременности 5–6 недель.
Статистический анализ
Обработка данных выполнялась с помощью электронных таблиц Microsoft Excel и пакета статистической программы IBM SPSS Statistics v22 (США). Для описания количественных данных, подчиняющихся нормальному распределению, определяли среднее значение (М), среднеквадратичное отклонение (δ). Для оценки межгрупповых различий количественных анамнестических данных использовали t-критерий Стьюдента. Для анализа количественных признаков, не подчиняющихся нормальному распределению, была определена медиана (Me), а также межквартильный интервал (верхний (Q1) и нижний квартили (Q3)), для оценки различий между группами использовались методы непараметрической статистики (тест Манна–Уитни).
Качественные данные анализировались путем определения частоты признака (%). Для оценки значимости различий между группами в частоте встречаемости качественных признаков использовали тест χ2. Отношение шансов и значимость различий в частоте встречаемости качественных признаков рассчитывали с помощью свободно-распространяемого программного продукта WINPEPI версии 11.30. Статистически значимыми считались различия между полученными данными при р≤0,05.
Для определения закономерностей в зависимости от изменения экспрессии генов использовался кластерный анализ.
Для подтверждения гипотезы о связи стадии развития эндометрия, согласно кластерному анализу, с частотой наступления беременности и родов использовался точный критерий Фишера.
Результаты
Средний возраст пациенток составил 34 (4,4) года. Все женщины имели нормальные значения индекса массы тела (22,3 (3,0)), регулярный овуляторный менструальный цикл средней продолжительностью 28 (2,1) дней и сохраненный овариальный резерв. Средняя длительность бесплодия составила 3,9 (2,7) года. Частота первичного и вторичного бесплодия составила 50% (52 случая). На безуспешные попытки ЭКО в анамнезе указали 76 женщин (73,1%). На момент обследования среднее количество криоконсервированных эмбрионов хорошего качества составило в среднем 3,7 (2,5). Все пациентки имели оптимальную толщину эндометрия в день забора пайпель-биопсии в среднем 9,0 (1,6) мм. Средний уровень эстрадиола в сыворотке крови на день пайпель-биопсии составил 586,8 (300,0) пмоль/л, прогестерона – 38,9 (16,7) нмоль/л.
По результатам гистологического исследования установлено, что ранняя стадия фазы секреции была выявлена в 32 (30,8%), средняя стадия фазы секреции – в 72 (69,2%) случаях.
Выбор спектра генов был основан на результатах ранее проведенного биоинформатического анализа баз данных микроматричных исследований эндометрия ArrayExpress [11] при сопоставлении с тестом ERA [10]. В исследование было включено 15 генов, уровень экспрессии которых отличался более чем в 2 раза на средней стадии фазы секреции по сравнению с ранней стадией фазы секрецией (табл. 1).
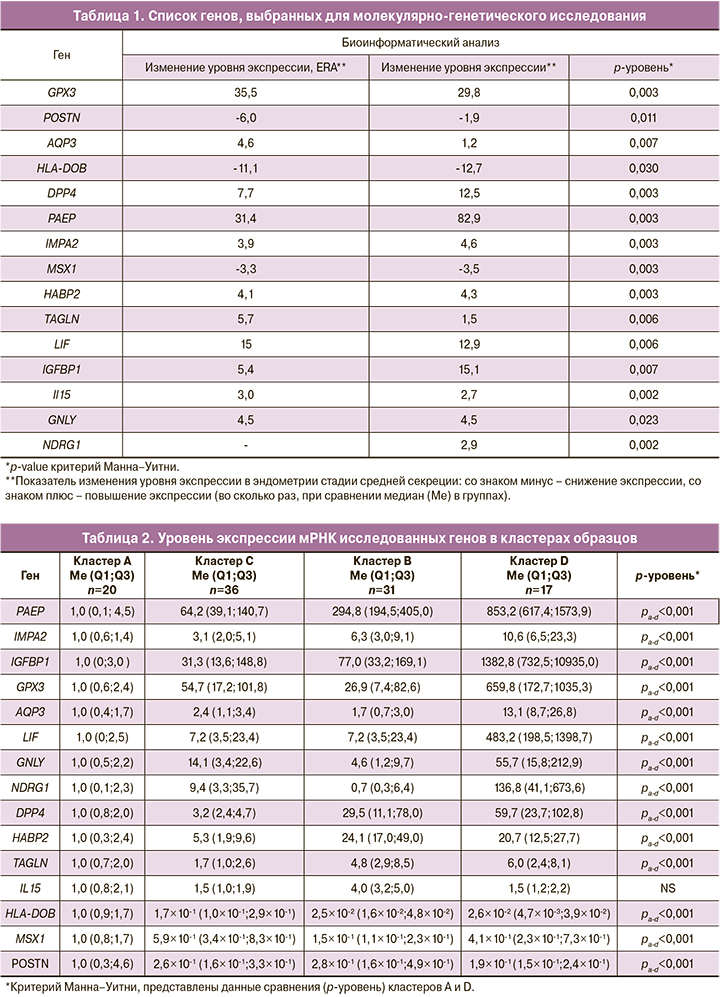
Оценка уровня экспрессии мРНК генов была проведена с помощью кластерного анализа. Результаты кластерного анализа образцов представлены в виде тепловой карты на рисунке.
На рисунке хорошо видно, как распределились образцы по изменению уровня экспрессии генов. Проведенный кластерный анализ позволил выделить 4 кластера образцов: кластер А, кластер В, кластер С, кластер D.
Для кластера А (n=20) характерно повышение экспрессии генов POSTN, HLA-DOB, MSX1 и снижение экспрессии мРНК генов LIF, GPX3, AQP3, NDRG1, GNLY, IMPA2, PAEP, IGFBP1, HABP2, DPP4 и TAGLN. Промежуточные уровни экспрессии были выявлены в кластерах В (n=31) и С (n=36). И наконец, для кластера D (n=17) установлена высокая экспрессия мРНК генов GPX3, AQP3, NDRG1, GNLY, IMPA2, PAEP, IGFBP1, HABP2, DPP4 и TAGLN и низкая экспрессия генов POSTN, HLA-DOB, MSX1 (см. рисунок).
Результаты сравнительного анализа транскрипционного профиля генов в тканях эндометрия в выделенных кластерах образцов представлены в таблице 2.
На основании изменения уровня экспрессии гена PAEP, экспрессия которого увеличивается под действием гормонов эстрадиола и прогестерона в течение менструального цикла, было предложено кластерное стадирование развития эндометрия от кластера к кластеру: А → С → В → D.
При сопоставлении результатов кластерного анализа и гистологического исследования эндометрия установлено, что образцы кластера А в равном количестве разделились между ранней и средней стадиями фазы секреции. Образцы кластера С в 24 случаях (66,7%) соответствовали средней стадии фазы секреции. Образцы же кластеров В и D в 25 и 15 случаях, т.е. более чем в 80% случаев, соответствовали средней стадии фазы секреции. Таким образом, в результате исследования установлена гетерогенность молекулярно-генетических профилей генов в период предполагаемого «окна имплантации», отражающая этапы развития секреторного эндометрия.
После проведения программы переноса размороженных эмбрионов был проведен анализ исходов, проведенного лечения. Частота положительного результата ß-ХГ составляла от 23,5% до 40% без статистически значимых различий между кластерами. Была выявлена статистически значимая разница по частоте родов живым плодом в кластерах В и С и составила 9 и 10 случаев (29% и 27,8% соответственно), то есть когда молекулярно-генетический профиль эндометрия соответствовал промежуточному этапу развития между ранне- и среднесекреторной трансформацией эндометрия (табл. 3).

Обсуждение
В настоящее время накоплены многочисленные данные об изменении транскрипционных профилей генов в эндометрии в течение менструального цикла. При этом наибольший интерес для исследователей представляют молекулярно-генетические «особенности» имплантационного эндометрия. Однако окончательно так и не известно, какие гены участвуют в процессе формирования «окна имплантации».
Полученные нами данные, характеризующие изменения уровня экспрессии генов в предполагаемый период «окна имплантации», а также результаты биоинформатического анализа согласуются с тестом ERA, указывающим на повышение уровня экспрессии мРНК генов LIF, GPX3, AQP3, NDRG1, GNLY, IMPA2, PAEP, IGFBP1, HABP2, DPP4 и TAGLN при одновременном снижении экспрессии генов POSTN, HLA-DOB, MSX1 по мере развития секреторного эндометрия [10].
Результаты настоящего исследования продемонстрировали возможность молекулярно-генетического исследования выделить, дополнительные – промежуточные этапы (кластеры С и В) развития секреторного эндометрия, которые являются наиболее благоприятными для переноса размороженных эмбрионов в полость матки. При этом частота наступления биохимической беременности не зависела от молекулярно-генетической стадии развития эндометрия в отличие от частоты живорождений, которая оказалась значимо лучше в кластерах В и С, соответствующих переходному периоду от ранней стадии фазы секреции к средней стадии секреторной трансформации эндометрия. Беременности, наступившие после переноса эмбрионов в так называемый «ранний» период молекулярно-генетического развития эндометрия (кластер А) во всех случаях завершились самопроизвольными выкидышами на ранних сроках гестации.
Результаты проведенного пилотного исследования представляются крайне перспективными для разработки упрощенных критериев оценки рецептивности эндометрия с использованием интегральных способов описания транскрипционных профилей генов на основе статистических методов многофакторного анализа, что требует системного подхода и апробации на больших выборках пациенток.
Преимплантационное генетическое тестирование эмбрионов в данной работе не проводилось, и часть неблагоприятных исходов могла быть обусловлена хромосомными аномалиями, что с одной стороны, является недостатком данной работы. Однако исключительное попадание таких эмбрионов в кластер А маловероятно. С другой стороны, это дает надежду на более высокую частоту (свыше 29%) получения живорождений в промежуточных кластерах В и С.
На основании проведенной работы может быть предложен алгоритм для персонализированного подхода к подготовке и выбору дня переноса эмбрионов.
Для определения рецептивного статуса эндометрия у пациенток, проходящих подготовку к переносу размороженных эмбрионов, целесообразно использовать молекулярно-генетическое исследование уровня экспрессии мРНК вышеуказанных генов, с последующим определением кластерной принадлежности эндометрия. При установлении высокой рецептивности эндометрия, а именно соответствие кластерам В и С, рекомендовано производить перенос в естественном цикле на 7–8-й день после овуляторного пика ЛГ, либо в цикле гормональной терапии на 5 день назначения прогестерона. В случае получения образца эндометрия, соответствующего кластерам А и D, рекомендовано проведение дополнительной подготовки эндометрия перед переносом эмбриона, или может быть рекомендован сдвиг переноса эмбриона: на 12–24 ч позже стандартного подхода (для кластера А) – в цикле гормональной терапии на день П+5,5–6, или раньше (для кластера D) – в цикле гормональной терапии на день П+4,5.
Заключение
Молекулярно-генетические профили экспрессии генов LIF, GPX3, AQP3, NDRG1, GNLY, IMPA2, PAEP, IGFBP1, HABP2, DPP4, TAGLN, IL15, POSTN, HLA-DOB, MSX1 дают информацию об этапах развития секреторного эндометрия и позволяют выявить дополнительные – промежуточные этапы между «классическими» гистологически верифицированными стадиями ранней и средней секреции, наиболее благоприятные для переноса криоконсервированных/размороженных эмбрионов.



