В настоящее время в РФ проблема недостаточности и дефицита витамина D имеет широкое распространение. Она затрагивает большую часть общей популяции, включая детей и подростков, беременных и кормящих женщин, взрослых, женщин в менопаузе и пожилых людей [1–3]. В 2020 г. авторы из Великобритании задались вопросом, стоит ли проводить повсеместное обогащение пищевых продуктов витамином D. Согласно национальному исследованию, в Великобритании почти каждый пятый взрослый в возрасте 19–65 лет имеет низкую концентрацию витамина D в сыворотке (ниже 25 нмоль/л). В некоторых возрастных группах распространенность еще выше, например, среди девушек-подростков в возрасте 11–18 лет – 39%. Рекомендации МЗ Великобритании подчеркивают важность обеспечения адекватного уровня витамина D для всех [4]. Всемирная организация здравоохранения (ВОЗ) и Продовольственная и сельскохозяйственная организация объединенных наций определили три потенциальных стратегии решения проблемы неудовлетворительного потребления питательных микроэлементов: (1) увеличение разнообразия потребляемых продуктов, (2) обогащение пищевых продуктов и (3) использование добавок [5]. Каждая из стратегий, наряду с воздействием солнечного света в летние месяцы, потенциально может сыграть свою роль в решении проблемы недостатка витамина D.
Витамин D – это жирорастворимый витамин, который поступает в организм человека двумя путями: непосредственно с пищей или вырабатывается в коже под действием ультрафиолетовых (УФ) лучей. Витамин D, который организм получает из продуктов питания, пищевых добавок или образующийся при пребывании на солнце, биологически неактивен. Витамин D (кальциферол) объединяет холекальциферол (витамин D3) и эргокальциферол (витамин D2). Эргокальциферол поступает в организм алиментарным путем, а холекальциферол образуется в коже под действием УФ-излучения. Данные метаболиты являются неактивными формами витамина D, которые после прохождения двух реакций гидроксилирования (в печени и почках) превращаются в активную форму D-гормона (кальцитриол) [6].
Следует помнить, что не только условия проживания, национальность, тип кожи, но и особенности питания могут оказывать влияние на активацию витамина D в организме человека. К факторам риска снижения уровня витамина D относятся: снижение потребления жира, уменьшение пребывания на солнце, постоянное нахождение в помещении, определенное географическое расположение, недостаточное потребление магния, наличие синдрома мальабсорбции [7].
Функция витамина D не ограничивается влиянием на кальций-фосфорный обмен, отмечена его роль в некоторых физиологических процессах, включающих нервно-мышечную проводимость, модуляцию клеточного роста, иммунитет и воспаление (т. е. его неклассические эффекты). К настоящему времени получены данные об увеличении риска некоторых онкологических заболеваний у женщин (рак толстого кишечника, молочной железы, эндометрия, яичников, мочевого пузыря) на фоне дефицита витамина D [6]. Однако однозначно утверждать о наличии причинно-следственной связи пока не представляется возможным, требуется проведение дополнительных исследований.
Рецепторы к витамину D присутствуют в большинстве тканей и клеток организма. Специфические рецепторы расположены в классических органах-мишенях: кишечнике, почках и костях, но также могут быть обнаружены и в других органах, например: сердце, гладкомышечных клетках, поджелудочной, предстательной и паращитовидной железах, эндотелии сосудов и т.д. Поэтому роль витамина D и его активных метаболитов не ограничивается кальциево-фосфорным обменом, он также участвует в работе иммунной, сердечно-сосудистой, репродуктивной систем, в углеводном обмене, стимулирует рост волос. Помимо этого, витамин D активирует дифференцировку кератиноцитов кожи и тормозит их пролиферацию, предотвращает развитие различных опухолей. Также кальцитриол прямо или опосредованно влияет на работу определенных генов, регулируя клеточную дифференцировку, пролиферацию, апоптоз и ангиогенез [1].
Витамин D оказывает важное влияние на женскую половую систему воздействуя на стероидогенез, синтез антимюллерова гормона (АМГ) и на трансформацию эндометрия. Существуют убедительные данные о взаимосвязи метаболизма витамина D и развития определенных гинекологических заболеваний [8, 9]. Рецепторы витамина D были выявлены в ткани яичника, что помогло понять его роль в регуляции некоторых процессов, например, снижение экспрессии рецептора фолликулостимулирующего гормона (ФСГ) и АМГ-рецептора II в гранулезных клетках яичников, уменьшение уровня фосфорилирования внутриклеточных сигнальных белков Smad 1/5/8 и их транслокацию в ядро клетки. Витамин D также индуцирует экспрессию фермента 3b-HSD, что повышает выработку и высвобождение прогестерона. Кроме того, витамин D увеличивает экспрессию фермента 17β-HSD и ароматазы (эстроген-синтетазы), способствующей конверсии тестостерона в эстрон, эстрадиол и таким образом способствует снижению гиперандрогении. Это подтверждается экспрессией его рецептора в яичниках, эндометрии, плаценте и гипофизе [1, 8, 9]. В последние годы проводятся исследования, целью которых является оценка влияния витамина D на организм женщины в период менопаузы.
Влияние витамина D на течение менопаузального периода
Примерно треть жизни женщины приходится на период менопаузы. В настоящее время демографическая ситуация характеризуется увеличением продолжительности жизни, а следовательно, и ростом популяции пожилых людей в целом. По данным ВОЗ, к 2025 г. количество женщин старше 60 лет превысит 1 млрд. В России численность женщин пери- и постменопаузального возраста составляет около 21 млн [10].
Фаза менопаузального перехода характеризуется снижением функциональной активности яичников, на фоне чего развиваются различные менопаузальные симптомы (вазомоторные, психоэмоциональные, вагинальные, сексуальные и др.). Также периоду климактерия характерно и нарушение соматического здоровья: потеря минеральной плотности костной ткани, формирование неблагоприятного профиля сердечно-сосудистого риска вследствие развития абдоминального/висцерального ожирения, дислипидемия, эндотелиальная дисфункция, нарушение толерантности к глюкозе, а также различные нарушения психологического статуса [10].
У женщин старше 50 лет повышается риск недостаточности/дефицита витамина D вследствие заболеваний желудочно-кишечного тракта, малоподвижного образа жизни и, как следствие, более редкого пребывания на солнце, снижения возможности синтеза витамина D на коже под воздействием УФ-лучей [6].
Исследования по выявлению связи между низким уровнем витамина D и риском преждевременной недостаточности яичников или развитием ранней менопаузы велись с начала 2000-х годов. Появившиеся вначале данные о том, что дефицит витамина D может быть фактором риска наступления ранней менопаузы (до 45 лет), а добавление препаратов витамина D в сочетании с кальцием способствует снижению этого риска [11], были опровергнуты проспективным исследованием, включавшим более 116 тыс. медсестер в возрасте 25–42 лет, которое показало отсутствие корреляции между низким уровнем 25-ОН-D и преждевременной недостаточностью яичников [12].
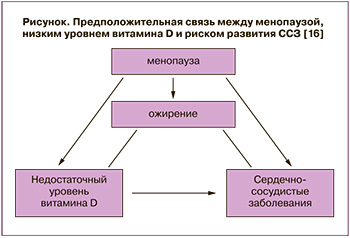 Дефицит витамина D составляет 31–70% у женщин в постменопаузе. Женщины в постменопаузе имеют повышенный риск сердечно-сосудистых заболеваний (ССЗ). Авторы некоторых исследований предполагают, что существует связь между менопаузой, низким содержанием витамина D в сыворотке и риском развития ССЗ или их более тяжелым течением [13] (рисунок).
Дефицит витамина D составляет 31–70% у женщин в постменопаузе. Женщины в постменопаузе имеют повышенный риск сердечно-сосудистых заболеваний (ССЗ). Авторы некоторых исследований предполагают, что существует связь между менопаузой, низким содержанием витамина D в сыворотке и риском развития ССЗ или их более тяжелым течением [13] (рисунок).
Последние данные подтверждают наличие связи между дефицитом витамина D и гипертонической болезнью, заболеваниями периферических сосудов, сахарным диабетом, метаболическим синдромом (МС), ишемической болезнью сердца и сердечной недостаточностью. James L. Vacek и соавт. оценивали связь между дефицитом витамина D, его приeмом и результатами лечения пациентов с некоторыми ССЗ. Оценки уровней витамина D в сыворотке крови за 5 лет и 8 месяцев были сопоставлены с демографическими, физиологическими и клиническими данными пациента. За нормальный уровень витамина D были приняты значения ≥30 нг/мл, недостаточные – <30 нг/мл. Из 10 899 пациентов, средний возраст которых составлял 58±15 лет, 71% составили женщины (n=7758), средний индекс массы тела был 30±8 кг/м2. Средний уровень 25-ОН-D в сыворотке крови составил 24,1±13,6 нг/мл.
Из 10 899 пациентов только 3294 (29,7%) имели нормальные значения витамина D. Дефицит витамина D был связан с несколькими сердечно-сосудистыми заболеваниями (артериальной гипертензией, ишемической болезнью сердца, кардиомиопатией), сахарным диабетом (СД) 2 типа (р<0,05), а также был независимым предиктором смерти от всех причин (ОШ 2,64; 95% ДИ 1,901–3,662; р<0,0001). Прием витамина D показал существенное улучшение выживаемости (ОШ на смерть 0,39; 95% ДИ 0,277–0,534; р<0,0001). Авторы сделали вывод, что дефицит витамина D был связан со значительным риском ССЗ у женщин в постменопаузе и снижением выживаемости при развитии ССЗ [14]. Аналогичные результаты были получены в результате крупного эпидемиологического исследования в США [11]. Целью рандомизированного клинического исследования S. Moghasemi и соавт. было оценить влияние приема витамина D на сердечно-сосудистые факторы риска у женщин в постменопаузе с недостаточностью витамина D. В исследование были включены 76 здоровых женщин в постменопаузе с недостаточностью 25(ОН)D (<30 нг/мл), которые были разделены на две равные группы: одна получала витамин D3 2000 МЕ/сут, вторая – плацебо. Уровень глюкозы натощак, липидный профиль и артериальное давление достоверно не различались между группами через 12 недель (р>0,05). Авторы сделали вывод, что прием пищевых добавок с витамином D с малой долей вероятности способен снизить сердечно-сосудистые факторы риска у женщин в постменопаузе с дефицитом витамина D. Однако следует обратить внимание на малую выборку, невысокую дозу назначенного препарата и короткое время наблюдения [13].
В 2020 г. J.H. Kwak и соавт. показали, что у женщин в пременопаузе уровень витамина D≥25 нг/мл, может оказывать протективное действие в отношении артериальной гипертензии. Однако аналогичной связи у женщин в постменопаузе отмечено не было [15].
Было замечено, что индекс массы тела (ИМТ) имел значимую обратную корреляцию с уровнем витамина D независимо от времени года и возраста. Значения сывороточного витамина D демонстрировали сезонно-направленную синусоидальную тенденцию, они повышались в течение весны/лета одинаковым образом как у женщин с ожирением, так и без ожирения. Однако в группе с ожирением средние значения витамина D были ниже по сравнению с группами с избыточным весом и нормальным весом вне зависимости от времени года, часто достигая состояния выраженного дефицита (<10 нг/мл) [16]. Эти результаты указывают на необходимость принимать во внимание ИМТ при лечении недостатка/дефицита витамина D у женщин с избыточным весом и ожирением. Также отмечено, что у женщин в постменопаузе его уровень значительно коррелирует не только с ИМТ, но количеством висцерального жира [17]. В 2020 г. H. Vázquez-Lorente и соавт. показали, что недостаточный уровень витамина D обратно пропорционально коррелирует с ИМТ ( r=-0,25, р=0,04), окружностью бедер (r=-0,26 и r=-0,24, все р<0,05), окружностью плеча (r=-0,29, р=0,01) и массой жира (r=-0,28 и r=-0,26, все р<0,05) [18].
По данным Healthy Women’s Study, в первые три года после наступления менопаузы масса тела в среднем увеличивается на 2,3 кг, а через восемь лет – на 5,5 кг. По данным М.А. Репиной (2003), прибавка массы тела обычно начинается в возрасте 42–46 лет, то есть с началом перименопаузального периода. В этой группе женщины с ИМТ более 30 кг/м2 встречаются лишь в 7% случаев. Однако в период постменопаузы количество женщин с таким ИМТ возрастает в 3 раза. Для верификации метаболического менопаузального синдрома (ММС) наличие ожирения (по ИМТ) не является обязательным, более того, ММС часто встречается у пациенток с нормальным ИМТ. В исследовании P.P. Ferreira и соавт. было продемонстрировано, что у женщин в постменопаузе с дефицитом витамина D прием 1000 МЕ/сут в течение 9 месяцев способствовал снижению риска развития МС. В этом двойном слепом плацебо-контролируемом исследовании 160 женщин в постменопаузе в возрасте 50–65 лет были рандомизированы на две равные группы: первая получала 1000 МЕ витамина D3/сут, вторая – плацебо. Через 9 месяцев наблюдалось значительное увеличение уровней витамина D в первой группе (+45,4%; р<0,001) и снижение (-18,5%; р=0,049) в группе плацебо. В первой группе также наблюдалось значительное снижение уровня триглицеридов (-12,2%; р=0,001), инсулина (-13,7%; р=0,008) и инсулинорезистентности (-17,9%; р=0,007), а во второй – повышение уровня глюкозы (+6,2%; р=0,009) [19]. В 2018 г. в журнале Maturitas были опубликованы результаты перекрестного когортного исследования, показывающего, что женщины в постменопаузе с дефицитом витамина D имеют больший риск развития МС. Уровень 25(OH)D менее 20 нг/мл был связан с большей вероятностью высокого уровня триглицеридов (ТГ) и низкого уровня липопротеидов высокой плотности (ЛПВП). Исследование включало 463 женщины в возрасте 45–75 лет, которые не принимали препараты витамина D и имели ССЗ в анамнезе. У женщин определяли уровни общего холестерина, липопротеидов низкой плотности (ЛПНП), ЛПВП, ТГ, глюкозы, инсулина и 25(ОН)D. Достаточный уровень витамина D выявлен у 32% женщин, недостаток витамина D – у 32,6%, у 35,4% – дефицит. Уровни физической активности, использование гормонотерапии, курение и распространенность СД 2 типа или артериальной гипертензии были одинаковыми среди женщин всех трех групп. Возраст наступления менопаузы, ИМТ, окружности талии (ОТ), уровни ЛПНП, ЛПВП, АД, глюкозы, также были схожи среди всех исследуемых. МС был выявлен у более чем половины (57,8%) женщин с уровнем 25(ОН)D (менее 30 нг/мл) и у 39,8% женщин с достаточным его уровнем (р=0,003). Концентрация 25(ОН)D менее 30 нг/мл была ассоциирована с повышенными уровнями общего холестерина, ТГ и инсулина. После поправки на возраст, сроки наступления менопаузы, ИМТ, курение и уровень физической активности, риск развития МС у женщин с недостатком витамина D был в 2 раза выше (OR=1,9). Риск повышения ТГ и ЛПНП у женщин с недостатком витамина D выше на 55% и 60% соответственно. Снижение концентрации витамина D повышало риск развития МС. Авторы предположили, что витамин D влияет на секрецию инсулина и чувствительность рецепторов к инсулину и это играет ведущую роль в патогенезе развития ММС. Исследователи также отметили общие факторы риска для СД 2 типа и дефицита витамина D: пожилой возраст, этническое/расовое меньшинство, ожирение и низкая физическая активность [20].
Распространенность нарушений углеводного обмена в мире довольно велика, диагноз установлен примерно у 314 млн человек и эта цифра неуклонно растет. По данным P. Zimmet (2000), около 25% населения Западной Европы имеют нарушение толерантности к глюкозе или МС [21]. Подобные темпы распространения предиабета приводят к повышению распространенности СД 2 типа. По данным Международной федерации диабета на 2019 г., СД 2 типа страдали 463 млн пациентов в возрасте 20–79 лет, по прогнозам к 2045 г. эта цифра увеличится до 700 млн [22].
Дефицит витамина D характерен для пациенток с СД 2 типа до и после наступления менопаузы, но чаще встречается в постменопаузе. Адекватный уровень в сыворотке крови 25(OH)D был связан с более клинически значимой компенсацией нарушений углеводного обмена, в то время как гиповитаминоз D у женщин в постменопаузе был связан с более низким уровнем компенсации [23].
В рамках климактерического синдрома пациенток часто беспокоит вазомоторная симптоматика (приливы), особую роль в развитии которой отдают нарушению баланса нейромедиаторов в головном мозге, а именно снижению уровня серотонина [24]. В исследованиях на крысах получены данные о том, что витамин D может предотвратить снижение серотонина, происходящее в менопаузальный период [25]. В исследовании Women’s Health Initiative у 530 женщин в менопаузе (возраст от 51 до 80 лет) были проанализированы течение климактерического синдрома (в т.ч. нарушений сна, эмоциональной лабильности) и уровень 25(ОН)D в сыворотке крови. Исследователи не выявили клинически значимой взаимосвязи между сывороточными уровнями 25(OH)D и проявлениями климактерического синдрома [26]. В сравнительном исследовании A.F. Polisseni и соавт. оценили клинический эффект менопаузальной гормональной терапии (МГТ), тиболона и дополнительного приема кальция и витамина D в отношении купирования вазомоторных симптомов. Была обнаружена одинаковая эффективность в улучшении показателей качества жизни во всех группах, в том числе и контрольной, с использованием только кальция и витамина D [27].
Лабильность настроения – одно из проявлений климактерического синдрома. Витамин D, как и эстрогены, способен влиять на настроение и на церебральные функции. Существует корреляция между дефицитом витамина D и сосудистой нейропатией [28]. В ряде работ отмечено несколько протективных эффектов витамина D: антиоксидантный эффект, повышение фагоцитоза амилоидных бляшек, иммуномодулирующее действие и сосудистая защита [29], а также изменения в гомеостазе кальция [30]. Исходя из полученных данных небольших обзорных исследований известно о положительном влиянии солнечного света и/или адекватных уровней витамина D на познавательную функцию головного мозга, память, риск развития болезни Альцгеймера и болезни Паркинсона [28–30].
Согласно данным Международной эпидемиологической ассоциации, можно проследить связь между низким уровнем витамина D и риском развития депрессии и болезни Альцгеймера [31, 32]. Изначально предположения о взаимосвязи витамина D с депрессией были основаны на ассоциации между его низким уровнем и высокой распространенностью аффективных расстройств зимой в северных широтах. По данным различных международных исследований, в течение последних 10 лет не было получено убедительных данных о связи низких уровней витамина D с развитием депрессии [33]. Однако выводы некоторых исследований все же выявили положительный клинический результат от приема препаратов витамина D при лечении депрессивных расстройств [31, 34, 35]. В исследовании Bener A. и соавт., включившем женщин в возрасте от 45 до 65 лет, была выявлена корреляция между низкими концентрациями 25(ОН)D в плазме и минеральной плотностью костной ткани, а также депрессивными расстройствами в менопаузе. Депрессия являлась фактором риска низкой МПК и зависела от уровня витамина D [36]. Похожие результаты продемонстрировало исследование Okereke O.I. и соавт., в нем было показано, что низкий уровень витамина D был фактором риска развития депрессивных симптомов у лиц пожилого возраста [37]. В 2020 г. J. Yuan и соавт. провели метаанализ, результатом которого стал вывод о том, что недостаток витамина D ассоциирован с возникновением депрессии у женщин в перименопаузе [38].
Через 3–5 лет от наступления менопаузы пациентки часто предъявляют жалобы на различные урогенитальные расстройства (сухость во влагалище, боль при половом акте, зуд, жжение, урогенитальный синдром, цисталгия, инконтиненция), а также изменения со стороны кожи и ее придатков (сухость кожи, ломкость ногтей, морщины, выпадение волос). S.S. Badalian и соавт. провели работу с целью оценить распространенность дефицита витамина D у женщин с различными нарушениями тазового дна с целью выявить возможную связь между этими проблемами. Примерно 23% женщин сообщили об одном или нескольких проявлениях несостоятельности мышц тазового дня. Средние уровни витамина D были значительно ниже у женщин, сообщивших по крайней мере об одном из проявлений, и у женщин с недержанием мочи, независимо от возраста. Авторы наблюдали снижение риска выявления одного и более симптомов пропорционально повышению уровня витамина D у всех женщин в возрасте 20 лет и старше (ОШ 0,94; 95% ДИ 0,88–0,99), в том числе в подгруппе женщин старше 50 лет (ОШ 0,92; 95% ДИ 0,85–0,99). При нормальной концентрации 25(ОН)D (≥30 нг/мл) у женщин старше 50 лет частота жалоб на недержание мочи была значительно ниже (ОШ 0,55; 95% ДИ 0,34–0,91) [39]. Согласно крупному обзору литературы (2020), пероральный прием витамина D был назван одним из методов альтернативной терапии генитоуренального синдрома [40].
Следует отметить положительное влияние витамина D на дерматологический статус женщины в менопаузе: кожу, волосы, ногти. Витамин D содействует замедлению процессов старения кожи [41], его адекватный уровень в сыворотке крови способствует росту волос [42].
Важно подчеркнуть, что эстрогены усиливают активность фермента, ответственного за активацию витамина D, поэтому снижение уровня эстрогенов может привести к недостатку в организме витамина D [43]. Можно предположить, что все органы, где есть рецепторы к витамину D, в период гормональной перестройки женского организма из-за возникновения эстроген-дефицита могут пострадать.
Профилактика и лечение недостатка и дефицита витамина D
Адекватным уровнем витамина D является концентрация 25(ОН)D от 30 до 100 нг/мл (75–250 нмоль/л), недостаточность определяется при значениях от 20 до 30 нг/мл (от 50 до 75 нмоль/л), а дефицит — при концентрации менее 20 нг/мл (50 нмоль/л). Согласно National Osteoporosis Society, не стоит рекомендовать крайне высокие дозы витамина D, т.к. это может оказать негативное влияние на здоровье человека (хроническая гиперкальциемия, гиперкальциурия с риском развития мочекаменной болезни, повышенный риск падений и т.д.) [44]. Оптимальное значение 25(ОН)D составляет 30–60 нг/мл (75–150 нмоль/л) [6].
Согласно рекомендациям Российской ассоциации эндокринологов (2016), колекальциферол (D3) является препаратом выбора для профилактики и лечения дефицита витамина D. Для профилактики дефицита витамина D в возрастной группе 18–50 лет рекомендуется получать витамин D не менее 600–800 МЕ/сут, а в группе старше 50 лет – не менее 800–1000 МЕ/сут (УД B I). К факторам, повышающим риск дефицита витамина D, относятся (в группе старше 50 лет): возрастная недостаточность лактазы, заболевания ЖКТ, сопровождаемые снижением всасывания витамина D, редкое пребывание на солнце, снижение возможности синтеза витамина D в коже под воздействием УФ-лучей, применение солнцезащитных кремов [6].
Для поддержания нормального (>30 нг/мл) уровня витамина D может потребоваться его потребление не менее чем 1500–2000 МЕ/сут (УД А II). Не следует назначать более 10 000 МЕ/сут на длительный период (>6 месяцев), без медицинского наблюдения и контроля за уровнем 25(ОН)D в крови (УД B I) [6].
Всем лицам важно адекватное (с учетом возрастных потребностей) потребление кальция с пищей. В случае недостаточного поступления кальция с продуктами питания необходимо использовать добавки кальция (УД А I) [6].
Взрослым с дефицитом витамина D рекомендовано назначение колекальциферола в дозе 7000 МЕ/сут или 50 000 МЕ в неделю – в течение 8 недель, с дальнейшим приемом поддерживающей дозировки 1500–2000 МЕ/сут. У пациентов с ожирением, синдромом мальабсорбции или принимающих препараты, нарушающие метаболизм витамина D, может потребоваться увеличение лечебной дозы колекальциферола до 6000—10000 МЕ/сут и поддерживающих – от 3000 до 6000 МЕ/сут [6].
В РФ зарегистрировано немало лекарственных препаратов витамина D, в том числе в виде водного раствора. Задача клинициста в рамках персонализированной медицины – рекомендовать препараты с точки зрения эффективности и учитывать профиль безопасности лекарств.
Для осуществления биологических эффектов жирорастворимый витамин D должен всосаться из тонкого кишечника и поступить в кровь. Наиболее высокая скорость кишечного всасывания в проксимальных и средних сегментах тонкой кишки. Фармакологические и физико-химические исследования показали, что кишечная абсорбция витамина D наиболее полно происходит из растворов так называемых мицелл (от лат. mica – крупинка; в физической химии – коллоидные наночастицы, образующие мелкодисперсную взвесь в большом объеме растворителя).
Мицеллированная форма витамина D3 важна потому, что физиологическое усвоение витамина D3 в кишечнике происходит только при участии желчных кислот (что подразумевает образование мицелл). У пожилых, пациентов с холестазом, муковисцидозом и другими нарушениями печени (например, стеатогепатитом) или при соблюдении определенных диет секреция желчных кислот снижается. Это может затруднять мицеллообразование и, как следствие, резко снижать усвоение витамина D (в т. ч. из масляных растворов) и других жирорастворимых витаминов [44, 45].
Водный мицеллярный раствор колекальциферола («Аквадетрим») поступает в готовой для всасывания форме, обеспечивает хорошую степень всасывания витамина D в тонком кишечнике с минимальной зависимостью от состава диеты, состояния печени и биосинтеза желчных кислот. Может быть рекомендован пациентам даже при наличии патологии ЖКТ (мальабсорбция, муковисцидоз, ферментативная недостаточность поджелудочной железы, холестаз и т.п.). Многие пациенты плохо переносят жирную пищу или страдают от той или иной патологии печени, приводящей к снижению синтеза желчных кислот (ЖК). Синтез ЖК снижается при использовании так называемых диет для похудания, включении в рацион блокаторов мицеллирования и усвоения витамина D (пальмитиновой кислоты, сатурированных жиров, маргарина). Поэтому мицеллированные («водорастворимые») растворы витамина D («Аквадетрим») обеспечивают хорошую степень всасывания практически во всех возрастных группах пациентов (дети, взрослые, пожилые) с минимальной зависимостью от состава диеты, приема препаратов, состояния печени и биосинтеза желчных кислот [45].
Важным преимуществом водных растворов («Аквадетрим») витамина D является возможность титрации дозы путем изменения количества капель препарата. Это делает растворы применимыми при насыщающих и поддерживающих режимах.
Дефицит витамина D и COVID-19
В условиях пандемии COVID-19 во всем мире следует учесть результаты американского исследования, которые показали, что дефицит витамина D является неблагоприятным прогностическим фактором тяжелого течения новой коронавирусной инфекции. Авторы проанализировали уровни 25(OH)D в сыворотке крови у 11 из 13 переведенных в отделение интенсивной терапии больных. Эти уровни были менее 30 нг/мл, что соответствовало недостатку, а у 7 из 13 пациентов этот показатель был на уровне дефицита (<20 нг/мл). Авторы предположили, что недостаток витамина D может быть независимым фактором риска тяжелого течения COVID-19. Исследователи подчеркнули «неклассические» эффекты витамина D, которые могли бы объяснить такую закономерность: дефицит витамина D связан с протромботическими влияниями на систему гемостаза и способен нарушить иммунный ответ организма [46].
Однако однозначные выводы делать преждевременно, необходимы длительные наблюдательные популяционные исследования.
Заключение
Данный обзор подтверждает тот факт, что коррекция дефицита витамина D – это уже не только педиатрическая проблема. Многочисленные исследования свидетельствуют о важном влиянии витамина D на женское здоровье на протяжении всей жизни. Данные исследований последних десятилетий указывают на важную роль витамина D у женщин менопаузального возраста. Изучение влияния дефицита витамина D на развитие и течение соматических заболеваний, аффективных состояний и когнитивно-поведенческих проявлений во время климактерия и эффективность применения колекальциферола для их профилактики и лечения представляют большую теоретическую и практическую ценность.



