Хромосомные аномалии (ХА), в частности, анеуплоидии по 21-й и 18-й хромосомам, являются одной из ведущих причин перинатальной смертности и детской инвалидности в развитых странах (Информационный бюллетень ВОЗ № 370). Исследования последних лет показали, что анеуплоидии являются причиной около 60,0% спорадических выкидышей [1]. Анеуплоидная беременность часто сопровождается угрожающим выкидышем, неоднократными кровотечениями, заканчивается преждевременными родами. Инвазивные методы пренатальной диагностики в подобных клинических ситуациях противопоказаны.
Существующий на современном этапе скрининг беременных основывается на данных ультразвукового исследования, определении материнских сывороточных маркеров, компьютерного анализа. На основании результатов скрининга выделяют женщин группы высокого риска, которым показано инвазивное обследование (Приказ Минздрава России от 12 ноября 2012г. № 572н). Инвазивные процедуры – биопсия ворсин хориона, амниоцентез, реже кордоцентез, с последующим цитогенетическим исследованием являются диагностическим «золотым» стандартом. Проведение инвазивных процедур требует тщательного учета противопоказаний, в связи с риском развития осложнений вплоть до самопроизвольного прерывания беременности в 1–2% случаев. Вместе с тем, только однозначный результат обследования на наличие анеуплоидии плода позволяет определить рациональную тактику ведения осложненной беременности. После открытия явления циркуляции в материнском кровотоке ДНК плода [2] был разработан и в последние годы активно внедряется метод неинвазивной пренатальной диагностики анеуплоидий (Non Invasive Prenatal Test – NIPT), доступный начиная с 10–11-й недели беременности [3–5]. Одним из немногих ограничений NIPT на сегодняшний день является высокая стоимость теста, от 460 евро (373 фунтов) за одно исследование [3, 4, 6]. Однако разработка отечественных тест-систем на основе высокопроизводительного секвенирования (NGS-next-generation sequencing) может существенно снизить стоимость анализа.
Таким образом, цель настоящего исследования – оценить возможность применения метода высокопроизводительного (полупроводникового) секвенирования для неинвазивной пренатальной диагностики анеуплоидий плода.
Материал и методы исследования
Обследованы 200 женщин с высоким риском хромосомной патологии плода, обусловленным возрастом беременной, изменениями в уровнях сывороточных маркеров, особенностями фенотипа плода. Обследование было проведено в сроках беременности от 10 до 20 недель (медиана – 14 недель) и включало: скрининг I и II триместров беременности – эхография, определение содержания сывороточных маркеров, компьютерный анализ; инвазивные процедуры; цитогенетическое исследование. Внутриматочные вмешательства с целью получения хориона, плаценты, амниотической жидкости выполняли в 11–14 недель (n=120) или в 17–20 недель (n=80) в связи с противопоказаниями к проведению в ранние сроки беременности или поздним обращением женщины. У всех женщин было получено согласие на инвазивную пренатальную диагностику (биопсия ворсин хориона, плаценты, амниоцентез) и получение крови из вены для молекулярного анализа. Перед проведением инвазивной пренатальной диагностики у женщин из периферической вены аспирировали 10,0 мл крови в 2 пробирки с ЭДТА.
Полученный материал анализировали с помощью цитогенетического и молекулярно-генетического методов. Кариотип плода устанавливали с помощью цитогенетического исследования (G-окрашивание) клеток ворсин хориона, плаценты, амниотической жидкости по стандартному протоколу [7]. В периферической крови женщины определяли наличие или отсутствие у плода анеуплоидий, а также его пол следующим образом. На первом этапе из крови матери отделяли плазму. На втором этапе выделяли внеклеточную ДНК, содержащую материнскую и фетальную фракции. В дальнейшем последовательно осуществляли приготовление библиотек ДНК для полупроводникового секвенирования, эмульсионную полимеразную цепную реакцию (эПЦР) и высокопроизводительное секвенирование на приборе Ion Proton (Life TechnologiesThermo Fisher, США). Результаты оценивали с помощью биоинформатической обработки данных секвенирования ДНК. Для сравнения покрытия внутри образца применяли T-test. В последующем сопоставили результаты инвазивной цитогенетической и неинвазивной молекулярно-генетической диагностики. Специфичность оценивали как долю правильно определенных анеуплоидий (при получении идентичных результатов различными методами исследования).
Результаты исследования
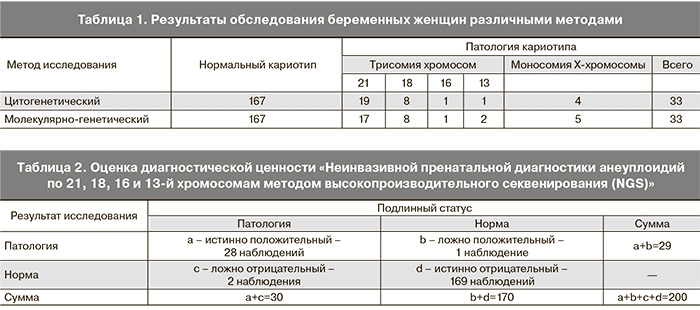
Из 200 наблюдений у 167 плодов по данным цитогенетического исследования установлен нормальный хромосомный набор, у 33 (16,5%) – патологический. Патология кариотипа была представлена: трисомией 21 – 19 наблюдений, трисомией 18 – 8 наблюдений, трисомией 13 – 1 наблюдение, трисомией 16 – 1 наблюдение, моносомией Х – 4 наблюдения (табл. 1).
При неинвазивной пренатальной диагностике установлено следующее. Определены 28 анеуплоидий по 21, 18, 13 и 16-й хромосомам, из них трисомия по 21-й хромосоме – 17 наблюдений, трисомия по 18-й хромосоме – 8 наблюдений, трисомия по 16-й хромосоме – 1 наблюдение, трисомия по 13-й хромосоме – 2 наблюдения (табл. 1, рис. 1). При сопоставлении с данными цитогенетического анализа установлено наличие 2 ложноотрицательных результатов по трисомии 21-й хромосомы, 1 ложноположительного – по трисомии 13-й хромосомы, полное соответствие по трисомии 18-й хромосомы.
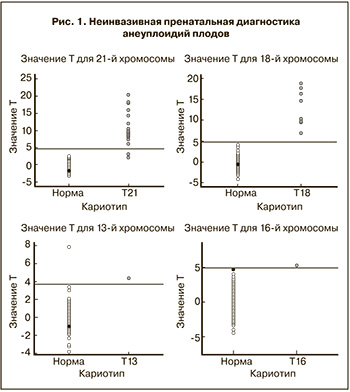 Среднее содержание доли фетальной ДНК в образцах составило 11,6% (90% CI: 6,6%-17,5%). У пяти образцов уровень фетальной ДНК был менее 4,0%. Все клинические образцы при определении Y-хромосомы были оценены, как принадлежащие к мужскому полу, все отрицательные по Y-хромосоме образцы – как относящиеся к женскому полу. Следует отметить, что в исследовании не выявляли увеличение количества хромосом Х и Y ввиду отсутствия таких образцов. По данным цитогенетического анализа моносомия Х-хромосомы была определена в 4 наблюдениях, а молекулярно-генетического – в 5 (табл. 1). В одном случае был получен результат, трактуемый как Х-моносомия при наличии у плода хромосом XХ в кариотипе. Таким образом, чувствительность определения пола плода составила более 0,995»99,5%, что свидетельствует о возможности использования NGS метода для определения пола плода, а также моносомии по Х-хромосоме (рис. 2). Оценка диагностической ценности неинвазивной пренатальной диагностики представлена в табл. 2.
Среднее содержание доли фетальной ДНК в образцах составило 11,6% (90% CI: 6,6%-17,5%). У пяти образцов уровень фетальной ДНК был менее 4,0%. Все клинические образцы при определении Y-хромосомы были оценены, как принадлежащие к мужскому полу, все отрицательные по Y-хромосоме образцы – как относящиеся к женскому полу. Следует отметить, что в исследовании не выявляли увеличение количества хромосом Х и Y ввиду отсутствия таких образцов. По данным цитогенетического анализа моносомия Х-хромосомы была определена в 4 наблюдениях, а молекулярно-генетического – в 5 (табл. 1). В одном случае был получен результат, трактуемый как Х-моносомия при наличии у плода хромосом XХ в кариотипе. Таким образом, чувствительность определения пола плода составила более 0,995»99,5%, что свидетельствует о возможности использования NGS метода для определения пола плода, а также моносомии по Х-хромосоме (рис. 2). Оценка диагностической ценности неинвазивной пренатальной диагностики представлена в табл. 2.
В проведенном исследовании при анализе анеуплоидий по аутосомам (не половым хромосомам) при сравнении с референс-методом были получены совпадающие результаты у 197 образцов из 200.
Чувствительность – доля истинно положительных результатов в группе больных = a/(a+c)=0,93 »93%.
Специфичность – доля истинно отрицательных результатов в группе здоровых = d/(b+d)=0,99»99%.
Обсуждение
В настоящее время скрининг беременных на ХА плода позволяет оценить только косвенные маркеры, в связи с чем он имеет недостаточно высокую чувствительность и специфичность [8]. Однозначный результат может быть получен только при инвазивной диагностике. Однако после ее проведения возможны осложнения, основным из которых является прерывание беременности: от 0,5 до 2% [9]. В то же время увеличение числа женщин старше 35 лет с тяжелой соматической и гинекологической патологией, нарушениями репродуктивной функции, которые планируют деторождение, может оказать влияние на повышение частоты выявляемой хромосомной патологии [10].
В течение последних лет активно развиваются молекулярно-генетические методы диагностики [11, 12]. На их основе разрабатывают различные направления, в том числе прогнозирование исхода беременности, неинвазивной пренатальной диагностики анеуплоидий плода. Они основаны на анализе внеклеточной ДНК плода в крови матери [3, 4, 13]. Увеличение ее количества позволяет прогнозировать развитие преэклампсии и угрозы прерывания беременности [14]. Риск ХА, установленный с использованием ДНК-технологий, в 99,5–100% наблюдений подтверждается при исследовании кариотипа плода. Частота ложноположительных результатов при этом составляет 0,1–1% [15].
В представленной работе при инвазивном обследовании 200 женщин группы риска, отобранных на основе существующего неинвазивного скрининга беременных, ХА выявлены у 33 (16,5%). При сравнении с молекулярно-генетическим анализом совпадающие результаты получены для 197 образцов из 200. Метод неинвазивной пренатальной диагностики имеет некоторые ограничения, в частности невозможность определения с его помощью микроаномалий и мозаицизма по отдельным хромосомам и полиплоидии, невозможность получения корректных результатов при низкой доле фетальной ДНК. Проанализированы ложноотрицательные наблюдения пациенток с трисомией 21-й хромосомы плода – в 2 случаях подобные результаты были обусловлены долей фетальной ДНК менее 4,0%. По данным литературы, результат нельзя считать валидным при доле фетальной ДНК менее 4–5% [16]. На снижение доли свободной ДНК могут влиять такие факторы, как срок беременности менее 10–11 недель и вес беременной женщины более 70 кг [17]. Некоторые авторы рекомендуют изымать из исследования образцы с низким уровнем фетальной ДНК и повторять забор материала и проведение анализа примерно через 2 недели [18–20]. Нельзя исключить возможность получения ложноотрицательного результата при беременности плодом женского пола, когда не определена доля фетальной ДНК. Однако даже учитывая вероятность такого события чувствительность метода по оценке разных авторов приближается к 99–99,95%, что значительно превышает уровень скрининговых методов на трисомию 21-й хромосомы [15, 21, 22]. Ложноположительный результат трисомии 13-й хромосомы и моносомии Х-хромосомы, вероятно, был обусловлен плацентарным мозаицизмом [23]. Достоверно установлена трисомия 18-й и 16-й хромосом. Однако единичное наблюдение относительно трисомии 16-й хромосомы не позволяет сделать однозначный вывод о чувствительности и специфичности метода в данном случае.
 Таким образом, с учетом результатов настоящего исследования, можно рекомендовать использование высокопроизводительного секвенирования для неинвазивного скрининга на анеуплоидии 21-й, 18-й и Х-хромосом с последующим инвазивным обследованием при их обнаружении. Что касается определения риска анеуплоидий по другим хромосомам, то по мере накопления материла и получения достоверной информации количество их будет увеличиваться. В настоящее время вопрос о внедрении методики неинвазивной пренатальной диагностики методом высокопроизводительного секвенирования в качестве рутинного скрининга беременных широко дискутируется [6].
Таким образом, с учетом результатов настоящего исследования, можно рекомендовать использование высокопроизводительного секвенирования для неинвазивного скрининга на анеуплоидии 21-й, 18-й и Х-хромосом с последующим инвазивным обследованием при их обнаружении. Что касается определения риска анеуплоидий по другим хромосомам, то по мере накопления материла и получения достоверной информации количество их будет увеличиваться. В настоящее время вопрос о внедрении методики неинвазивной пренатальной диагностики методом высокопроизводительного секвенирования в качестве рутинного скрининга беременных широко дискутируется [6].
Многие авторы указывают, что методы неинвазивной пренатальной диагностики до сих пор не могут быть альтернативой или заменить инвазивные процедуры, особенно в случаях мозаицизма, когда число анеуплоидных клеток уступает нормальным. Однако метод может быть использован для скрининга и определения риска у всех беременных, независимо от возраста до постановки окончательного диагноза, как самостоятельный метод, так и в дополнение к существующим методам. Исследователи полагают, что определение свободной ДНК эмбрионального происхождения может заменить или усовершенствовать существующие скрининговые тесты. Подобные выводы были сделаны, основываясь на результатах нескольких проспективных исследований, во всех случаях подтвержденных классическим кариотипированием.
Использование технологии NGS (next generation screening) у женщин с высоким риском рождения ребенка с хромосомной патологией перед инвазивным пренатальным обследованием экономически обосновано и активно проводится в некоторых странах [24]. Два профессиональных сообщества – Великобритании и США высказали различные мнения о необходимости внедрения методов неинвазивной пренатальной диагностики по определению фетальной ДНК для беременных низкого риска по реализации хромосомной патологии [25]. Так, Королевское общество акушеров-гинекологов Великобритании (RCOG) полагает, что в настоящее время неинвазивная пренатальная диагностика должна стать первичным звеном скрининга хромосомных аномалий во время беременности. В противоположность этому мнению, Американская ассоциация по фетальной медицине (Society for Maternal Fetal Medicine – SMFM) осторожно заявляет, что неинвазивная пренатальная диагностика является многообещающим методом, который демонстрирует прекрасные результаты, но этого недостаточно, чтобы изменить существующие в настоящее время рекомендации Американского общества акушеров-гинекологов (ACOG) и специалистов по фетальной медицине (SMFM).
В нашей стране подобный подход пока не внедрен в повседневную практику. В то же время реализация проекта по проведению высокоинформативной «молекулярной неинвазивной пренатальной диагностики беременным» имеет большие перспективы. Прежде всего, она значительно сократит применение необоснованных инвазивных внутриматочных вмешательств, что особенно важно у женщин с осложненным течением данной беременности. Неинвазивные пренатальные методы приобретают особую клиническую значимость у женщин с гестационными осложнениями, когда с одной стороны, есть ограничения и противопоказания к проведению инвазивных методов диагностики, с другой стороны, угроза прерывания беременности может быть обусловлена вынашиванием плода с анеуплоидией, что делает консервативную тактику ведения беременности бесполезной и неэффективной.
В настоящей работе из 200 женщин группы риска только у 33 (16,5%) выявлена хромосомная патология, а у большинства – 167 (83,5%) она отсутствовала. Процент выявленных инвазивным методом анеуплоидий соответствует литературным данным [26, 27].
Кроме того, снизятся затраты на наблюдение за беременной женщиной в стационарных условиях, которое в ряде случаев бывает необходимо как перед инвазивной манипуляцией – для подготовки, так и после нее в качестве профилактики осложнений.
Таким образом, необходима дальнейшая национальная валидация неинвазивной пренатальной диагностики анеуплоидий методом высокопроизводительного секвенирования. Подобный подход позволит создать российские рекомендации по внедрению новых скрининговых программ у женщин высокого и низкого риска реализации хромосомных аномалий плода.



