В последнее десятилетие во всем мире особое внимание уделяется развитию и улучшению перинатальной помощи. Плод рассматривается как пациент в связи с возможностью внутриутробной коррекции тяжелых патологических состояний. Одним из таких антенатальных состояний является неиммунная водянка плода (НИВП).
НИВП определяется как скопление экстраваскулярной жидкости в двух и более серозных полостях и тканях плода, возникающее на различных сроках беременности при отсутствии циркулирующих антител к антигенам мембраны эритроцитов. Скопление жидкости может быть в подкожном пространстве (более 5 мм), перикардиальной, плевральной и брюшной полостях [1–4].
НИВП впервые описана в 1892 г. J. Ballantyne [5]. Ранее преобладала иммунная форма водянки, однако после разработки и внедрения в клиническую практику антирезусного иммуноглобулина в настоящее время в мире 85–90% случаев водянки носят неиммунный характер [6–7].
Зарегистрированная частота НИВП составляет около 3 на 10 000 родов, однако заболеваемость значительно выше в связи с самопроизвольным или искусственным прерыванием беременности в I и II триместрах [8].
В основе НИВП лежат различные причины (более 150 нозологий), которые, по результатам проведенного крупномасштабного исследования Bellini C. и соавт. [9], распределены на 14 категорий. На территории Российской Федерации структура причин НИВП не определена ввиду отсутствия крупных исследований по данной проблеме.
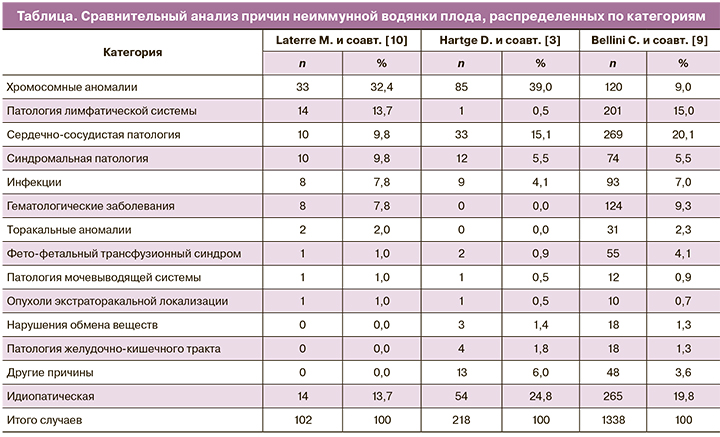
Laterre M. и соавт. [10] провели сравнительный анализ причин НИВП (таблица). В исследованиях, проведенных Hartge D. и соавт. [3] и Laterre M. и соавт. [10], наиболее распространенной причиной НИВП были хромосомные аномалии (32% и 39% соответственно), тогда как у Bellini C. и соавт. [9] – сердечно-сосудистые аномалии (20,1%). Второй наиболее распространенной причиной у Bellini C. и соавт. [9] и Laterre M. и соавт. [10] были заболевания лимфатической системы (13,7 и 15% соответственно). В эту категорию были включены случаи, связанные с кистозной гигромой, кишечной лимфангиэктазией и хилезными расстройствами. В исследованиях Hartge D. и соавт. [3] заболевания лимфатической системы составляли лишь 0,5%, хотя следует отметить, что в 4 из 54 случаев в идиопатической категории выявили кистозную гигрому. Это говорит о том, что в связи с отсутствием крупномасштабных исследований до конца не отработаны критерии распределения причин НИВП по категориям.
Этиология НИВП играет важную роль в определении сроков манифестации и исходов [2, 7, 9, 11–15]. Так, Ota S. и соавт. [2] показали, что НИВП, манифестирующая до 22-й недели беременности, ассоциирована с высоким риском хромосомных аномалий и неблагоприятными исходами, тогда как после 22-й недели в основе НИВП лежат другие причины, а прогноз при этом является более благоприятным. Данную тенденцию подтвердили исследования, проведенные Ota S. и соавт. [2] в Японии с 2000 по 2012 гг., где средний срок беременности при постановке диагноза НИВП из-за трисомии, структурной аномалии сердца и синдрома Нунана (тернероидный синдром с нормальным кариотипом) были 18 недель (диапазон 11–31 неделя), 30 недель (диапазон 22–36 недель) и 30 недель (диапазон 22–33 недели) соответственно. При этом НИВП, вызванная трисомией или синдромом Тернера, ассоциировалась с высокой частотой прерывания беременности. Исследователи также отметили, что выживаемость при НИВП, диагностированной до 22 недели, между 22 и 25 неделями, между 26 и 29 неделями и после 30 недели составляли 12, 5, 23 и 26% соответственно. Таким образом, данные результаты показывают, что не только этиология, но также и срок беременности при манифестации НИВП влияют на исходы.
Причины развития водянок могут отличаться среди различных популяций. Так, например, в Юго-Восточной Азии и на Тайване наиболее распространенной причиной НИВП являются гемоглобинопатии, в то время как в западных странах – хромосомные аномалии или инфекционные заболевания [11–14, 16, 17].
Выявление причины НИВП является сложной диагностической задачей, и успех во многом зависит от лабораторной и инструментальной оснащенности учреждений. В Российской Федерации крупномасштабных исследований по НИВП не проводилось, и, соответственно, алгоритма обследования женщин с данной патологией плода до сих пор нет.
В клинических рекомендациях Канадского общества акушеров-гинекологов (SOGC) представлен алгоритм обследования беременных женщин с НИВП, который, помимо экспертного ультразвукового исследования плода, эхокардиографии плода, также включает инвазивную диагностику посредством амниоцентеза. При этом, в зависимости от лабораторной оснащенности учреждений, проводится обследование на хромосомную патологию, инфекции и заболевания из группы нарушений обмена веществ. Обследование обязательно включает оценку скорости кровотока в средней мозговой артерии плода, усиление которого является специфичным симптомом внутриутробной анемии [18, 19].
Однако и после проведения всех предложенных исследований частота идиопатической НИВП может оставаться достаточно высокой. В исследованиях Bellini C. и соавт. [9] в 2009 и 2015 гг. частота идиопатической НИВП составила 17,8 и 19,8% соответственно. Авторы считают, что данные результаты, возможно, связаны с гиподиагностикой заболеваний из группы нарушений обмена веществ. Так, в 2017 г. во Франции было проведено проспективное исследование, включавшее 6 случаев идиопатической НИВП. Использовался метод секвенирования на панели HydFet для выявления заболеваний из группы нарушений обмена веществ. С использованием данной панели было выявлено 5 заболеваний, приведших к развитию НИВП (болезнь Ниманна-Пика типа С, синдром Барта, дефицит HNF1В, GM1-ганглиозидоз, болезнь Гоше) [20].
Патогенез НИВП описан Im S.и соавт. [21] еще в 1984 г. и зависит от этиологии:
- первичная миокардиальная или сердечная недостаточность, вызванная в большинстве случаев врожденными пороками сердца, аритмией или миокардитом;
- вторичная миокардиальная или сердечная недостаточность, обусловленная тяжелой анемией, атриовентрикулярным шунтом, опухолью плаценты или синдромом фето-фетальной трансфузии;
- падение онкотического давления вследствие уменьшения продукции белков при врожденном циррозе/гепатите или увеличения потери белков, связанного с врожденной нефропатией. Гипопротеинемия приводит к снижению онкотического давления, что определяет вторичное повреждение капилляров и обусловливает дополнительные потери протеинов;
- увеличение проницаемости капилляров, вызванное выраженной гипоксией, инфекцией, тяжелой анемией и др.;
- обструкция или нарушение лимфатического оттока, например, при синдроме Тернера, хилотораксе, хилоперитонеуме;
- обструкция венозного возврата, обусловленная объемными повреждениями, такими как врожденная аденоматозная кистозная мальформация легких или дефект диафрагмы.
Клиническая картина НИВП непатогномонична, однако иногда можно увидеть косвенные признаки, указывающие на основную этиологию. Например, при врожденном хилотораксе выпот в плевральной полости является первичным и доминантным по сравнению с другими признаками НИВП [22].
Остается до конца не ясным, влияет ли топика поражения на исходы. Так, одни исследователи показали, что скопление жидкости в плевральной и перикардиальной полостях плода ассоциировано с низкой выживаемостью, тогда как другие авторы не выявили данной взаимосвязи [23–25]. Эти несоответствия выводов, по всей видимости, основываются на том, что основополагающей является все же причина НИВП, а не затронутая полость.
Тактика ведения беременности при неиммунной водянке плода
В настоящее время отсутствуют российские рекомендации в отношении тактики ведения беременности при НИВП. Согласно клиническим рекомендациям Канадского общества акушеров-гинекологов (SOGC) [18], основополагающим при выборе тактики ведения беременности с неиммунной водянкой плода является кариотип. Диагностика хромосомных аномалий плода является крайне актуальной, так как, по данным Bellini и соавт. [9], именно анеуплоидии являются одной из частых причин НИВП. При выявлении анеуплоидий пациенткам должно быть предложено прерывание беременности. В случае нормального кариотипа и курабельности плода возможно проведение фетальной терапии и/или хирургических вмешательств после 18 недель беременности [18].
Dorsi M. и соавт. сделали вывод, что внутриутробное лечение НИВП является предпочтительным, так как в результате его пролонгируется беременность и купируются проявления НИВП, следовательно, улучшаются перинатальные исходы [26].
Наиболее важной частью внутриутробного лечения является этиопатогенетический подход, который определяется этиологией, вызвавшей НИВП.
В литературе представлены также методы симптоматического воздействия, целью которых является пролонгирование беременности как можно дольше, желательно – до доношенного срока, а этиопатогенетическое лечение проводится в неонатальном периоде. Такая ситуация часто встречается при хирургической патологии [1, 4, 27–32].
В зависимости от этиологии и клинических проявлений НИВП возможно применение следующих методов фетального воздействия:
- этиопатогенетическая терапия: антиаритмическая терапия, внутриутробное переливание эритроцитарной массы, обедненной лейкоцитами и тромбоцитами, альбумина, противовирусная терапия, иммуноглобулинотерапия, антибиотикотерапия;
- симптоматическая терапия: амниоредукция, торакоцентез, лапароцентез, торако-амниотическое шунтирование, введение сердечных гликозидов, введение кортикостероидов.
Внутриутробные фетальные аритмии осложняют течение беременности в 1% случаев. Большинство фетальных аритмий являются доброкачественными интермиттирующими, которые не требуют терапии [33–35]. Устойчивые фетальные тахиаритмии встречаются реже, примерно 1 случай на 1000 беременностей, но именно они значительно ассоциированы с осложнениями и смертностью [36]. В случае отсутствия антиаритмической терапии фетальные тахиаритмии приводят к нарушению гемодинамики плода и развитию НИВП, которая осложняет течение фетальных тахиаритмий практически в половине случаев, а смертность при этом составляет в среднем 9% [34, 37, 38].
В систематическом обзоре и метаанализе, проведенном Alsaied T. и соавт. [39], сравнивали эффективность и безопасность антиаритмических препаратов (дигоксина, соталола, амиодарона и флекаинида) при трансплацентарной терапии фетальных тахиаритмий. Оценивались 537 случаев: 291 женщина получала дигоксин, 137 – флекаинид, 102 – соталол и 7 – амиодарон. При приеме дигоксина наблюдалась более низкая частота восстановления нормального ритма сердца по сравнению с флекаинидом (OR 0,773; 95% ДИ 0,605–0,987; I² = 34%). Не было существенных различий в частоте материнских осложнений между группами дигоксина и флекаинида (OR 1,134; 95%ДИ 0,129–9,935; I²=80,79%). Не было также существенной разницы в гибели плода между группами флекаинида и дигоксина (OR 0,767; 95% ДИ 0,140–4,197; I² = 44%). Таким образом, авторы пришли к выводу, что флекаинид является более эффективным средством лечения, чем дигоксин, и должен применяться в качестве препарата первой линии для терапии наджелудочковой тахикардии у плода. Однако на территории РФ антиаритмический препарат флекаинид не зарегистрирован и не используется в клинической практике.
Согласно данным отечественных авторов [40, 41], антиаритмическая терапия показана при наджелудочковой тахикардии и частой экстрасистолии с симптомами недостаточности кровообращения у плода, при этом препаратом выбора является дигоксин. В случае отсутствия или недостаточности антиаритмического эффекта применяется комбинированная терапия дигоксином и соталолом.
Внутриутробная тяжелая анемия плода может являться первичным этиологическим фактором, приводящим к развитию НИВП (например, при синдроме фето-материнской трансфузии), а также возникать вторично, на фоне инфекции [19]. Патогенетическими механизмами развития НИВП являются увеличение проницаемости капилляров, вызванное выраженной гипоксией, тяжелой анемией, инфекцией, а также вторичная миокардиальная или сердечная недостаточность [21]. При диагностированной внутриутробной анемии у плода патогенетическим является внутриутробное переливание эритроцитарной массы, обедненной лейкоцитами и тромбоцитами. Данная методика является эффективным и безопасным методом лечения внутриутробной тяжелой анемии у плода [19, 42, 43]. Объем трансфузии рассчитывается по калькулятору https://medicinafetalbarcelona.org/calc/ или вручную по формуле:

V – необходимый объем трансфузии; Ht1 – предоперационный гематокрит плода; Ht2 – гематокрит донорской крови; Ht3 – нормальный уровень гематокрита для данного гестационного возраста; ПМП – предполагаемая масса плода, V1 – объем циркулирующей крови плода для данного срока.
Дискутабельным является вопрос о необходимости и эффективности применения противовирусных препаратов при подтвержденной внутриутробной вирусной инфекции. Leruez-Ville M. и соавт. [44] провели исследование, в котором при подтверждении внутриутробной цитомегаловирусной инфекции женщины получали противовирусный препарат – валацикловир 8,0 г в сутки (16 таблеток) до родоразрешения (категория действия на плод по FDA – B). После проведенного лечения 34 из 43 детей не имели клинических признаков цитомегаловирусной инфекции при рождении и оставались бессимптомными в течение всего периода наблюдения (1 год). Исследователи выявили, что на фоне противовирусной терапии валацикловиром вирусная нагрузка в крови плода достоверно снизилась (p=0,01), а количество тромбоцитов достоверно увеличилось (p<0,001). По сравнению с исторической когортой значительно увеличилась доля бессимптомных новорожденных – с 43% без лечения до 82% – с лечением. Стоит отметить хорошую переносимость терапии и отсутствие побочных эффектов, несмотря на высокую дозировку валацикловира [44, 45]. Валацикловир обладает широким спектром противовирусного действия, он также активен в отношении других возбудителей, приводящих к развитию НИВП, – вирусов Herpes simplex типов 1 и 2, Varicella zoster, вируса Эпштейна–Барр, вируса герпеса человека 6 типа.
Welz J. и соавт. [46] также сообщают о снижении вирусной нагрузки в крови беременной женщины и плода на фоне противовирусной терапии валганцикловиром (категория действия на плод по FDA – С). На фоне лечения прогрессирования ультразвуковых признаков цитомегаловирусной инфекции у плода не наблюдалось. Побочных эффектов при применении валганцикловира со стороны матери не отмечено.
При выявлении в крови беременной женщины иммуноглобулина M к парвовирусу В19, Канадское общество акушеров-гинекологов (SOGC) рекомендует проводить ультразвуковое исследование плода каждые 1–2 недели в течение 12 недель для своевременной диагностики осложнений – внутриутробной анемии и водянки плода. При выявлении признаков НИВП и/или внутриутробной тяжелой анемии у плода необходимо направить женщину в учреждение третьего уровня для проведения внутриутробного переливания эритроцитарной массы, обедненной лейкоцитами и тромбоцитами [47].
Не менее важным подходом во внутриутробном лечении является так называемый симптоматический подход, направленный на купирование отдельных симптомов НИВП. Он может являться дополнением к этиопатогенетической терапии или применяться в случае невозможности или низкой эффективности консервативного лечения.
Chon A. и соавт. [22] показали, что установка торако-амниотического шунта у плодов с одно- или двусторонним плевральным выпотом, осложнившимся НИВП, привела к антенатальному разрешению водянки в 17 случаях (58,6%) из 29, а выживаемость составила 21 (72%) из 29.
Abbasi N. и соавт. [32] показали преимущество торако-амниотического шунтирования перед торакоцентезом при плевральном выпоте. Необходимость данных процедур не вызывает сомнений: данные процедуры позволяют пролонгировать беременность, предупредить развитие легочной гипертензии, гипоплазии тканей легких у плода и прогрессирование хронической сердечной недостаточности.
Отек плаценты (определяемый как толщина плаценты 4 см и более во II триместре или 6 см и более в III триместре) и многоводие часто сопутствуют НИВП, однако не являются обязательными критериями определения [18, 48]. Было выявлено, что данные признаки чаще встречались при торакальной аномалии, чем при неторакальной (88,89% против 73,74%, р=0,037). Анализ перинатальной смертности показал, что в группе НИВП с плацентомегалией и/или многоводием внутриутробная гибель плода встречалась значительно реже (11 из 32), чем в группе НИВП без плацентомегалии и/или многоводия (21 из 121; р=0,049). Также было выявлено, что спонтанные преждевременные роды достоверно чаще встречались в группе НИВП с плацентомегалией и/или многоводием (р=0,045). Это может быть связано с тем, что миометрий растягивается в условиях многоводия, что увеличивает риск преждевременного излития околоплодных вод и преждевременных родов. Для предупреждения данных осложнений необходимо проведение амниоредукции – эвакуации околоплодных вод до достижения нормального уровня (максимальный вертикальный карман (МВК) — 80 мм), по данным ультразвукового исследования. Измерение МВК околоплодных вод выполняют 1 раз в 7–10 дней, и при нарастании МВК в динамике показана повторная амниоредукция [48].
НИВП в ряде случаев сопровождается развитием декомпенсации сердечной недостаточности, которая усугубляет течение внутриутробного периода и является прогностически неблагоприятным фактором как в плане выживаемости, так и результатов терапии. В ведущих европейских рекомендациях терапией первой линии сердечной недостаточности у плода является дигоксин, обладающий положительным инотропным эффектом [49]. Схема терапии зависит от основной этиологии, стадии сердечной недостаточности и проводится под контролем ЭКГ, эхокардиографии, уровня дигоксина в крови, который должен находиться в пределах референсных значений (0,3–2,0).
При хирургической патологии, лежащей в основе НИВП, возможно проведение открытых оперативных вмешательств на плоде или применение лазерных и радиочастотных технологий [18].
Внутриутробное разрешение НИВП не только улучшает перинатальные исходы, но и снижает риск материнских осложнений. Одним из тяжелых осложнений НИВП является «зеркальный синдром» у беременной. Клиническая картина «зеркального синдрома» характеризуется наличием в 90% случаев отеков, в 60% – гипертензии, в 40% – протеинурии [18, 50, 51]. «Зеркальный синдром» необходимо дифференцировать от преэклампсии ввиду схожести клинической картины, поэтому распространенность и патогенез данного осложнения не установлены.
Обзор литературы, проведенный Braun T. и соавт. [50], показал, что среди 56 случаев «зеркального синдрома» наиболее частым осложнением был отек легких (21%). Разрешение «зеркального синдрома» происходило вскоре после начала внутриутробного лечения, после прерывания беременности или родоразрешения (в среднем через 8 суток).
Заключение
Таким образом, НИВП является сложной полиэтиологической патологией. Несмотря на достигнутый прогресс в современной перинатологии, смертность при НИВП остается довольно высокой и составляет 55–95%. Важную роль при постановке диагноза НИВП играет своевременный поиск этиологических факторов, выявление которых позволит определить дальнейшую тактику ведения беременности. В случае нормального кариотипа, срока беременности более 18 недель и курабельности необходим комплексный подход к фетальной терапии и/или хирургическим вмешательствам.



