Гипертензивные расстройства во время беременности, включая преэклампсию и эклампсию, являются актуальной медицинской, социальной и экономической проблемой в связи со стабильной частотой развития указанных гестационных осложнений, возможностью неблагоприятных ближайших и отдаленных исходов беременности и родов как для матери, так и для плода, сложностью прогнозирования, отсутствием эффективных мер профилактики и лечения преэклампсии.
По данным мировой литературы и ВОЗ частота гипертензивных расстройств во время беременности составляет 5–10%, преэклампсии – 2–8% [1]. В России гипертензивные нарушения в разные годы стабильно занимали 3–4-е место в структуре материнской смертности [2–4]. По данным Министерства здравоохранения РФ показатель материнской смертности от преэклампсии/эклампсии не имеет тенденции к стабильному снижению: 1,26 на 100 000 родившихся живыми в 2012 г., 1,21 – в 2013 г., 1,8 – в 2014 г. [3]. При этом подавляющее большинство случаев смерти (более 70%) расценены как предотвратимые и условно предотвратимые.
При этом в России отсутствует система прогнозирования преэклампсии, особенно ее ранней и тяжелой формы. По-прежнему имеют место сложности ранней диагностики данного осложнения беременности при появлении какого-либо одного из клинических симптомов.
Доминирующей концепцией возникновения преэклампсии является недостаточность инвазии цитотрофобласта с отсутствием ремоделирования маточно-плацентарных артерий и развитием ишемии плаценты [5–7]. Однако в последние годы с дефектом плацентации, ограниченным ремоделированием и обструктивными поражениями миометральных сегментов спиральных артерий, ассоциируется целый спектр осложнений беременности, объединенных в Great Obstetrical Syndromes (большие акушерские синдромы): преэклампсия, задержка роста плода, преждевременные роды, преждевременный разрыв плодных оболочек, поздний самопроизвольный выкидыш, отслойка плаценты [6, 8–11]. В то же время сходство патофизиологических изменений при указанных осложнениях не может объяснить, почему в одних ситуациях развивается преэклампсия, а в других – плацентарная недостаточность без преэклампсии. По-прежнему не найден фактор, определяющий развитие того или иного осложнения беременности.
В то же время, согласно фактам доказательной медицины, центральным звеном патогенеза преэклампсии считается системное повреждение эндотелия сосудов микроциркуляции с развитием эндотелиальной дисфункции [12–14]. В связи с этим исследовано большое количество биохимических и клеточных маркеров для прогнозирования, ранней диагностики и оценки степени тяжести преэклампсии. Однако ни один из них официально не рекомендован к практическому применению в связи с достаточно низкой чувствительностью и специфичностью для преэклампсии. В то же время определение уровня лишь одного какого-либо маркера не позволяет получить полноценную информацию обо всех функциях эндотелия, нарушенных при преэклампсии в той или иной степени. Таким образом до сих пор продолжается поиск высоко чувствительных и специфичных маркеров, позволяющих прогнозировать преэклампсию, оценивать истинную степень ее тяжести для выбора оптимальной тактики ведения таких беременных.
Учитывая вышеизложенное, целью исследования стала разработка и обоснование предиктивной, превентивной, персонифицированной системы ведения беременных с факторами риска развития преэклампсии на основании исследования ее современных клинико-морфологических особенностей.
Материал и методы исследования
Проведено проспективное когортное исследование 150 беременных группы риска развития преэклампсии. Из них 42 пациентки, у которых в последующем развилась преэклампсия (у 18 – ранняя, с манифестацией симптомов до 34 недель беременности, у 24 – поздняя, после 34 недель), 108 – без преэклампсии. Проведено полное клинико-лабораторное и функциональное обследование в сроки 1-го пренатального скрининга (10–14 недель) и в 18–24 недели (время проведения скринингового УЗИ). В эти сроки оценены наиболее значимые факторы в отношении прогноза преэклампсии:
- анамнез (прекондиционные факторы риска – наследственный, семейный анамнез, течение предыдущих беременностей и др.);
- оценка кровотока в маточных артериях (пульсационный индекс, PI); патологическими параметрами, которые ассоциируются с неадекватной трофобластической инвазией, считаются значения PI ≥95 процентиля и/или наличие ранних билатеральных диастолических выемок;
- суточная динамика АД (суточное мониторирование артериального давления, СМАД);
- маркеры эндотелиальной дисфункции (TNF-α, VCAM, ICAM);
- антиангиогенный фактор sFlt-1 – антагонист VEGF и PIGF, а также соотношение PIGF/sFlt-1;
- маркеры повреждения гематоэнцефалического барьера (ГЭБ) – NSE (нейроспецифическая енолаза, маркер зрелых дифференцированных нейронов) и GFAP (глиофибриллярно-кислый протеин, главный компонент глиальных филаментов дифференцированных астроцитов ЦНС).
Иммунохимическое исследование проводилось в лаборатории нейрохимии отдела фундаментальной и прикладной нейробиологии ФГБУ Федеральный медицинский исследовательский центр психиатрии и наркологии им. В.П. Сербского МЗ РФ (руководитель отдела – академик РАН, д.м.н., профессор В.П. Чехонин), в лаборатории биокатализа ФГБУН Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН (зав. лабораторией – член-корр. РАН, д.х.н., профессор А.Г. Габибов). Маркеры эндотелиальной, плацентарной дисфункции и повреждения ГЭБ (TNF-α, VCAM, ICAM, VEGF, PIGF, sFlt-1, NSE и GFAP) определялись в сыворотке крови пациенток исследуемых групп методом ELISA.
Статистическую обработку полученных данных проводили с помощью программного пакета Statistica 8 for Windows 8.0, а также MS Excel на персональном компьютере с использованием непараметрических методов математической статистики. Для описания количественных признаков был использован перцентильный подход. Для оценки значимости распределения качественного признака между группами применялся χ2 (точный критерий Фишера для малых выборок), для количественных показателей использовался непараметрический U-критерий Манна–Уитни. Для выявления наиболее значимых факторов риска развития и прогрессирования преэклампсии проводился бинарный мультивариационный логистический регрессионный анализ. Построение классификационной функции проводилось на основе дискриминантного анализа. Математическое моделирование проводилось с помощью вычисления λ Уилкса с определением чувствительности, специфичности, точности, положительного и отрицательного прогностического значения модели. Статистически значимыми считали различия при уровне значимости р<0,05.
Результаты исследования и их обсуждение
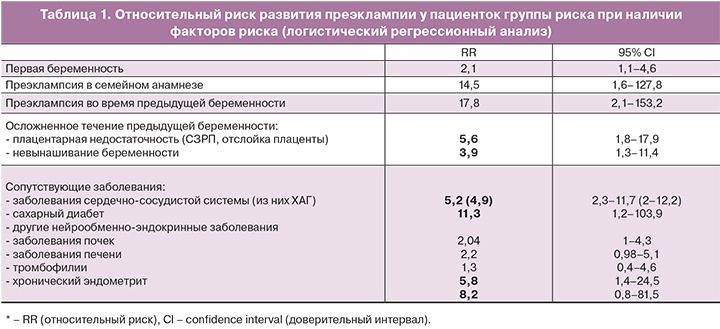
Проведенный многофакторный анализ анамнестических данных позволил выявить наиболее значимые факторы риска развития преэклампсии (табл. 1).
Учитывая, что ведущей концепцией развития преэклампсии является хроническая маточная-плацентарная ишемия, а косвенным ее маркером – показатели кровотока в маточных артериях, мы провели допплерометрическую оценку пульсационного индекса (PI) в этих сосудах у беременных группы риска. В сроки беременности 10–14 недель PI ≥95-го процентиля имел место у 10 (23,8%) женщин: у 2 с поздней преэклампсией, у 8 – с ранней; в сроки беременности 18–24 недели – у 11 (26,2%): у 1 – с поздней преэклампсией, у 10 – с ранней. Наличие ранних билатеральных диастолических выемок в сроки 10–14 недель зарегистрировано у 6 (14,3%) женщин с последующим развитием ранней преэклампсии, в сроки 18–24 недели – у 7 пациенток с развитием ранней преэклампсии и у 3 пациенток – с поздней тяжелой преэклампсией (всего у 10 беременных – 23,8%). Относительный риск (RR) развития преэклампсии при определении PI ≥ 95 процентиля в 10–14 недель составил 3,6 (95% CI 2,4–5,3), в 18–24 недели – 3,2 (95% CI 2,1–4,9). В отношении ранней преэклампсии RR в 10–14 недель составил 9,2 (95% CI 4,5–18,9), в 18–24 недели – 11,3 (95% CI 5,3–24,1).
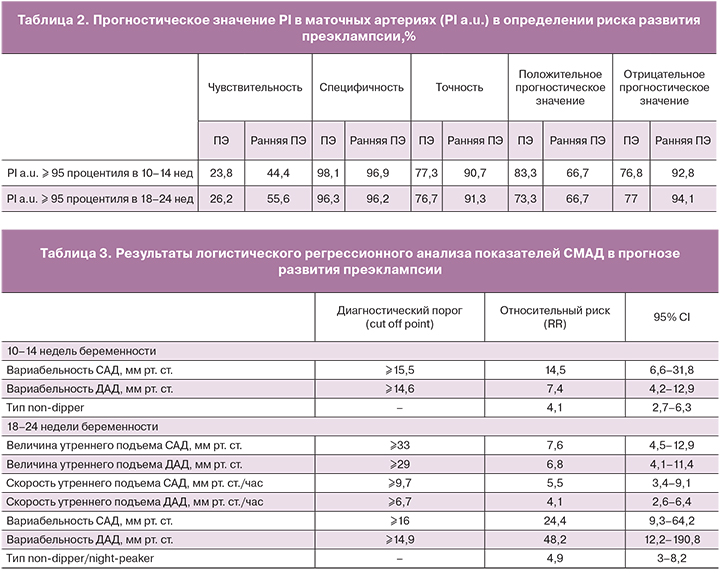
Прогностическое значение допплерометрических параметров кровотока в маточных артериях представлено в табл. 2.
Отмечена достаточно низкая чувствительность изолированного определения патологических допплерометрических параметров для прогноза преэклампсии как в первом (23,8%), так и во втором (26,2%) триместрах беременности. В то же время специфичность составила 98,1% в 1-м и 96,3% во 2-м триместре, что позволяет с большой вероятностью прогнозировать течение беременности без преэклампсии в случае нормальных показателей PI в 1-м и 2-м триместрах. Большее прогностическое значение имеет определение патологических параметров PI в отношении развития ранней преэклампсии: в 1-м триместре чувствительность составила 44,4%, точность 90,7%, во втором – 55,6 и 91,3% соответственно. Полученные результаты позволяют включить оценку кровотока в маточных артериях в модель прогноза преэклампсии.
Научный и практический интерес вызывают нарушения суточного биоритма АД у беременных с преэклампсией, в частности формирование ночного типа суточного ритма (тип non-dipper). Исследования последних десятилетий убедительно доказали прогностическую значимость недостаточного ночного снижения АД в отношении риска возникновения инфаркта миокарда, мозгового инсульта, поражения органов-мишеней при ХАГ, а также смертности от этих осложнений [15].
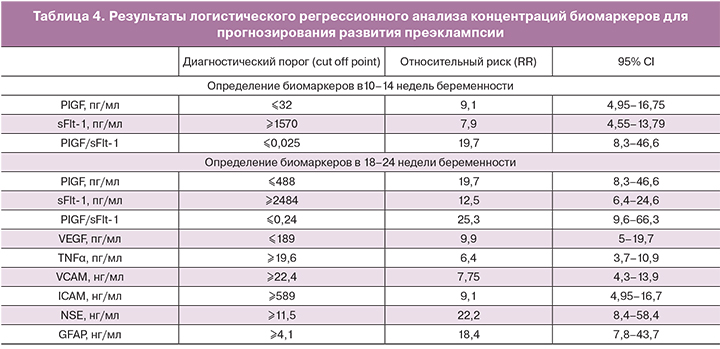
Применительно к прогнозу и ранней диагностике преэклампсии особенности суточного изменения АД, зарегистрированные с помощью СМАД, во многом являются свидетельством наличия или отсутствия эндотелиальной дисфункции на фоне разной степени выраженности повреждения эндотелиоцитов. При проведении СМАД нами использовались стандартные критерии, рекомендованные Всероссийским медицинским обществом по артериальной гипертонии и Всероссийским научным обществом кардиологов (2010) [15]. Результаты логистического регрессионного анализа наиболее значимых параметров СМАД в 1-м и 2-м триместре беременности представлены в табл. 3.
У пациенток группы риска, у которых в дальнейшем развивается преэклампсия, показатели среднесуточного, среднего дневного, среднего ночного АД, гипертонические индексы, величина утреннего подъема АД до появления клинических симптомов преэклампсии в большинстве наблюдений не превышают нормативных значений (при отсутствии ХАГ), однако имеют место следующие особенности:
- к 18–24-й недели отмечается достоверный рост среднесуточного, среднего дневного и ночного АД по сравнению с 1-м триместром (несмотря на то, что показатели пока не выходят за пределы нормы);
- уже со срока 10–14 недель отмечается повышение вариабельности систолического и диастолического АД, особенно выраженное у женщин с ХАГ;
- характерно прогрессивное увеличение ДАД, а также повышение величины и скорости утреннего подъема АД, более выраженное в сроки 18–24 недели;
- в 10–14 недель отмечается недостаточная степень ночного снижения АД (non-dipper) у каждой третьей (35,7%), в 18–24 недели – у половины пациенток без ХАГ (50%);
- пациентки с ХАГ, у которых развивается преэклампсия, в целом имеют более выраженные нарушения суточной динамики АД, отсутствует тенденция к снижению АД к концу 1-го триместра, имеет место достоверный рост суточных и дневных гипертонических индексов к 18–24-й неделе, повышение вариабельности АД, величины и скорости утреннего подъема АД; более часто встречается ночная динамика АД типа non-dipper – в 57,1%.
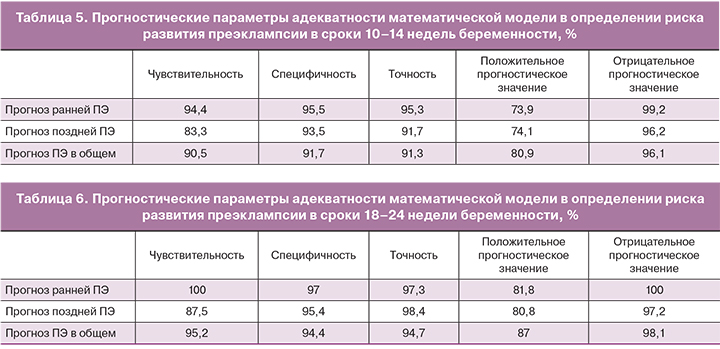
Для повышения точности прогноза преэклампсии, помимо клинических особенностей, необходима оценка факторов, отражающих ключевые звенья патогенеза (хроническая маточно-плацентарная ишемия, эндотелиальная дисфункция, антиангиогенный и провоспалительные дисбаланс). Так, в сроки 10–14 недель наиболее значимые изменения выявлены в отношении PIGF, sFlt-1 и их соотношения. Наибольшей чувствительностью (88,1%) и специфичностью (96,3%) обладает метод определения соотношения PIGF/sFlt-1, который имеет также максимальные точность (94%) и отрицательное прогностическое значение (95,4%). Последнее не менее важно в медицинских исследованиях, так как нормальные показатели PIGF/sFlt-1 у беременных в 10–14 недель с вероятностью 95,4% свидетельствуют об отсутствии риска развития преэклампсии. В связи с полученными результатами для построения математической модели прогнозирования преэклампсии в 1-м триместре была выбрана переменная PIGF/sFlt-1.
В сроки беременности 18–24 недели наибольшей прогностической точностью обладают методы определения PIGF/sFlt-1 (95,3%), а также нейроспецифических белков NSE (92,7%) или GFAP (92,7%), что также обосновывает применение этих биомаркеров для построения модели прогноза преэклампсии. Дополнительное исследование VEGF, VCAM или ICAM дает более широкое представление о глубине патологических процессов у беременных с развивающейся преэклампсией и несколько повышает прогностическую чувствительность и специфичность модели.
Результаты логистического регрессионного анализа концентраций биомаркеров в 1-м и 2-м триместре беременности для прогнозирования преэклампсии представлены в табл. 4.
Таким образом, наибольшую значимость в раннем прогнозировании риска развития преэклампсии имеет определение PIGF/sFlt-1 (RR=19,7 при PIGF/sFlt-1<0,025). Во втором триместре наиболее обосновано определение PIGF/sFlt-1 (RR=25,3 при снижении ≤0,24), NSE (RR=22,2 при повышении ≥11,5 нг/мл) и VEGF (RR=9,9 при снижении ≤189 пг/мл).
Для определения вероятности возникновения преэклампсии у беременных с возможностью оценки вклада в этот процесс нескольких независимых критериев (переменных) нами был использован метод бинарной логистической регрессии. Вероятность (риск) развития преэклампсии (p) рассчитывалась по формуле:
p=1/1+e-z,
где z=b1X1+b2Х2+...+bnXn+a; все коэффициенты (b1…bn) и константа (а) рассчитаны с помощью метода бинарной логистической регрессии, значения независимых переменных (X1…Xn) получены при проведении клинических исследований. Вероятность развития преэклампсии оценивалась как высокая при значениях p>0,5, низкая – при значениях p от 0 до 0,5.
Получены достоверные математические модели прогноза преэклампсии в сроки 10–14 недель и 18–24 недели.
Модель прогноза развития преэклампсии в сроки 10–14 недель можно представить следующим образом:
p=1/1+ e-z,
где z=2,5–139,8×(PIGF/sFlt-1)+34,8×PI a.u; z – значение классификационной функции; PIGF/sFlt-1 – соотношение PIGF и sFlt-1, измеренные в 10–14 недель; PI a.u. – значение пульсационного индекса в маточных артериях ≥95 процентиля в 10–14 нед (1 – есть, 0 – нет).
Модель прогноза преэклампсии в сроки 18–24 недели:
p=1/1+ e-z,
где z = -31,2–20,1×(PIGF/sFlt-1)+2,8×NSE–0,2×VEGF+22,2×PI a.u.; z – значение классификационной функции; PIGF/sFlt-1 – соотношение PIGF и sFlt-1, измеренные в 18-24 недели; NSE – концентрация NSE в 18-24 недели (нг/мл); VEGF – концентрация VEGF в 18-24 недели (пг/мл); PI a.u. – значение пульсационного индекса в маточных артериях ≥95 процентиля в 18–24 нед (1 – есть, 0 – нет).
Прогностическая точность разработанных моделей представлена в табл. 5 и 6, особенно высокие чувствительность и специфичность получены в отношении прогноза ранней, тяжелой преэклампсии.
Обобщив все результаты исследования, мы разработали двухэтапную предиктивную систему определения риска развития преэклампсии:
I этап – 10–14 недель беременности:
1. Оценка клинико-анамнестических факторов:
- ПЭ в семейном анамнезе (мать, сестры),
- ПЭ во время предыдущей беременности,
- осложненное течение предыдущей беременности (преждевременные роды, ЗРП, отслойка плаценты, невынашивание беременности),
- многоплодие (в том числе беременность после ВРТ),
- соматические заболевания (ХАГ, сахарный диабет, заболевания печени, почек, метаболический синдром, врожденные и приобретенные тромбофилии, хронический эндометрит).
2. Допплерометрия (PI≥95 перцентиля в маточных артериях, выявление ранних билатеральных диастолических выемок).
3. СМАД (повышение вариабельности АД, тип non-dipper).
4. Биохимические маркеры (PIGF/sFlt-1).
II этап – 18–24 недели беременности:
1. Оценка клинико-анамнестических факторов (если не проведена в 10–14 недель).
2. Допплерометрия (PI≥95 перцентиля в маточных артериях, ранние билатеральные диастолические выемки).
3. СМАД (повышение вариабельности АД, величины и скорости утреннего подъема АД, тип non-dipper/night-peaker).
4. Оценка ранних клинических предикторов:
- суточная микроальбуминурия, подоцитурия;
- снижение диуреза в динамике (даже если суточный объем мочи в пределах нормы);
- снижение тромбоцитов в динамике, активация внутрисосудистого свертывания крови;
- снижение скорости клубочковой фильтрации и/или клиренса креатинина;
- повышение креатинина, мочевины в динамике (еще не выходящее за пределы референсных значений).
5. Определение биомаркеров (оптимально – динамика PIGF/sFlt-1, VEGF, NSE или GFAP).
Кроме того, согласно публикациям отечественных и зарубежных авторов, уже со сроков 11–13 недель беременности рекомендуется проведение 3D-допплерометрии с определением индекса васкуляризации плаценты и 3D-эхографии с оценкой объема плаценты [16–18].
Заключение
Прогнозирование риска развития преэклампсии наиболее важно именно в ранние сроки беременности, поскольку дает возможность провести комплексное мультидисциплинарное обследование беременной, выявить и компенсировать имеющиеся сопутствующие заболевания, своевременно провести профилактику наиболее опасных осложнений.
С учетом современных представлений о преэклампсии и результатов многолетних собственных исследований можно констатировать следующее: патофизиологические изменения при преэклампсии выявляются уже с первого триместра беременности, что позволяет прогнозировать ее развитие с 10–14 недель гестации на основании анализа анамнестических особенностей (преэклампсия в семейном анамнезе, осложненное течение предыдущей беременности – преэклампсия, плацентарная недостаточность, невынашивание), соматического статуса (ХАГ, сахарный диабет, аутоиммунные заболевания, врожденные и приобретенные тромбофилии), наличия плацентарного дисморфогенеза и дисфункции, ангиогенного дисбаланса и эндотелиальной дисфункции (соотношение PIGF/sFlt-1, пульсационный индекс в маточных артериях, вариабельность АД, степень ночного снижения АД). При учете перечисленных критериев точность прогноза преэклампсии в конце первого триместра беременности составляет 91,3%, чувствительность 90,5%, специфичность 91,7%; для ранней преэклампсии – 95,3%, 94,4%, 95,5% соответственно; для поздней преэклампсии – 91,7%, 83,3%, 93,5% соответственно.



