Аномалии родовой деятельности актуальны в связи с высокой частотой развития, достигающей 16–20% среди осложнений родов. Наиболее значимым из них является слабость родовой деятельности. Причем в последние годы этот показатель не имеет тенденции к снижению и приводит к росту осложнений как у матери, так и у новорожденного [1, 2].
К основным причинам слабости родовой деятельности относят нарушение функции центральной нервной системы, эндокринопатии, нарушение обмена веществ, генитальный инфантилизм и пороки развития матки, а также перерастяжение матки (многоводие, многоплодие, крупный плод), перенашивание и др. [3–6]. Кроме того, слабость родовой деятельности часто может быть ассоциирована с преждевременным излитием околоплодных вод, утомлением роженицы в родах, клинически узким тазом, ригидностью шейки матки и др. [7–9].
Сократительная деятельность матки – это сложный процесс, который контролируется и поддерживается многочисленными факторами, обеспечивающими нормальную функцию. Принципиальное значение в генезе слабости родовой деятельности отводится внутриклеточным событиям, нарушению процессов, обеспечивающих функции отдельных миоцитов. При этом характерными изменениями являются уменьшение объемной плотности миоцитов, их дистрофия, отек и дезорганизация стромы [10, 11].
Некоторые исследователи отмечают наличие наследственной предрасположенности (в среднем 28%) к нарушениям сократительной деятельности матки в родах [12]. В последнее время появились работы, свидетельствующие об увеличении частоты слабости родовой деятельности при наличии у беременной недифференцированной дисплазии соединительной ткани [13, 14]. Принимая во внимание данный факт, интерес представляет изучение морфологческих и иммуногистохимических особнностей миометрия. Кроме того, выявляемые изменения соединительной ткани обусловливают изучение генных полиморфизмов, ассоциированных с нарушением ее развития [15].
Вышеуказанное обусловливает интерес к изучению взаимосвязи слабости родовой деятельности с особенностями строения миометрия и учетом генетической предрасположенности.
Целью исследования стало изучение взаимосвязи морфологических и иммуногистохимических особенностей миометрия у рожениц со слабостью родовой деятельности и выявление молекулярно-генетических предикторов.
Материал и методы исследования
В исследование были включены 112 пациенток, родоразрешенных путем операции кесарева сечения, которые были разделены на 2 группы: I (основная) – со слабостью родовой деятельности (49) и II (группа сравнения) – 63 пациентки без слабости родовой деятельности. Диагноз слабости родовой деятельности устанавливался на основании клинической оценки (кардиомониторный, токографический контроль, ведение партограммы) неэффективности схваток, уменьшения их частоты, низкого тонуса, замедленной динамики процесса родов.
Показанием для оперативного родоразрешения в основной группе была слабость родовой деятельности, неподдающаяся медикаментозной коррекции, в группе сравнения – острая и прогрессирующая гипоксия плода, клинический узкий таз, несвоевременное излитие околоплодных вод у беременной с рубцом на матке после миомэктомии, предлежание плаценты, тазовое предлежание плода при аномалиях костного таза, заключение травматолога (дисфункция лонного сочленения); окулиста (состояние после склеропластики, лазерной коагуляции).
Проводились морфологические и иммуногистохимические исследования миометрия. Материал фиксировался в 10% нейтральном формалине с фосфатным буфером, обрабатывался в аппарате гистологической проводки тканей фирмы «Pool Scientific Instruments» (Швейцария) и заливался в парафин. Затем готовились серийные парафиновые срезы (не менее 22 серийных срезов) толщиной 4–5 микрон. Срезы фиксировали на предметные стекла и инкубировали в термостате при 370С в течение 12 ч. Далее срезы депарафинировали и обезвоживали в батарее из 3 ксилолов, 2 абсолютных спиртов, 2 95% спиртов, 80 и 70% спирта и дистилированной воды. По стеклу от каждого случая окрашивали гематоксилином и эозином и пикрофуксином по Ван Гизону.
Иммуногистохимические реакции проводились на депарафинированных срезах с помощью стандартного микроволнового метода.
В качестве первичных антител использовались моноклональные антитела к COL III, IV типов, ламинину («LabVision», ready-to-use).
Для иммуногистохимических реакций ставили положительный и отрицательный контроль. В качестве отрицательного контроля брали образцы исследуемых срезов, которые подвергались стандартной процедуре иммуногистохимии, но без добавления первичных антител. Положительный контроль для каждого антитела выбирали в соответствии со спецификациями от фирмы производителя. Проводилась полуколичественная и количественная оценка результатов реакций.
В работе были изучены распределение аллелей и генотипов ряда структурных белков, по данным литературы ассоциированных с нарушением развития соединительной ткани, представленные в табл. 1.
Определение замен одиночных нуклеотидов проводили модифицированным методом «примыкающих проб» (adjacent probes, kissing probes), используя коммерческие тест-системы (ООО «НПО ДНК-Технология», Россия). Полимеразную цепную реакцию и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия). Анализ неравновесности сцепления проводился с помощью свободно-распространяемого продукта Haploview версии 4.2.
Статистическая обработка данных проводилась с помощью свободно распространяемого программного продукта WINPEPI версии 9.7. Для определения статистической значимости различий между группами применялись критерии Фишера и Манна–Уитни для несвязанных совокупностей. Отношение шансов (OR) приведено с 95% доверительным интервалом (CI).
Результаты и обсуждение
Все пациентки, включенные в исследование, были сопоставимы по возрасту и соматическому статусу. Возраст беременных колебался от 22 до 45 лет и составил в среднем 30,1±1,2 и 28,9±0,9 года соответственно по группам. Анализ массо-ростовых отношений у обследованных беременных отклонений от популяционных норм не выявил: средняя масса тела составила 60,1±2,14 кг и 62,3±2,15 кг, средний рост 167,2±3,2 см и 165,8±4,6 см соответственно по группам.
Среди заболеваний ЛОР-органов у пациенток основной группы превалировал хронический тонзиллит – 23,3% (OR=2,5; CI=1,7–2,9) и хронический гайморит – 8,9% (OR=2,4; CI=1,1–3,2). Значительный удельный вес в соматическом анамнезе у пациенток основной группы среди заболеваний сердечно-сосудистой системы составили пролапс митрального клапана 19,6% (OR=4,8; CI=1,8–12,8) и вегето-сосудистая дистония 34,2%, (OR=1,3; CI=0,7–2,3), что согласуется с данными литературы [2, 14]. Кроме того, у пациенток данной группы в 4 раза чаще регистрировали варикозную болезнь 37,9% (OR=5,1; CI=2,5–10,4). Среди заболеваний желудочно-кишечного тракта превалировал хронический гастрит 20,8% (OR=2,3; CI=1,0–4,6), гастродуоденит – 9,5% (OR=5,3; CI=1,1–14,9) и дискинезия желчевыводящих путей 13,3% (OR=3,0; CI=1,1–8,3) в основной группе. Среди заболеваний органов мочевыделительной системы у пациенток основной группы чаще диагностировали хронический пиелонефрит – 17,7% (OR=2,9; CI=1,2–7,1), и только в этой группе отмечался нефроптоз – 1,9%. Также установлена высокая частота миопии в основной группе (у каждой 3-й пациентки) с преобладанием миопии средней 18,3% (OR=3,1; CI=1,3–7,4) и высокой степени 7,6% (OR=1,3; CI=1,1–2,9) [13, 14].
Подавляющее большинство пациенток обеих групп ранее наблюдались и лечились по поводу различных заболеваний женских половых органов. При изучении структуры гинекологической заболеваемости была отмечена высокая частота цервицита в I группе – 24,0% (OR=2,42; CI=1,2–4,9) и хронического сальпингоофорита – 16,4% (OR=3,2; CI=1,2–8,1). Также у пациенток данной группы в 3 раза чаще встречалась дисфункция яичников 9,2% (OR=5,3; CI=1,2–23,9).
Течение I триместра у пациенток основной группы чаще осложнялось ранним токсикозом 45,5% (OR=1,2; CI=0,7–2,0), ретрохориальной гематомой 6,9 % (OR=1,8; CI=0,5–6,0). Во II триместре у пациенток данной группы чаще отмечалась угроза прерывания – 35% (OR=1,3; CI=0,7–2,3) и истмико-цервикальная недостаточность – 15% (OR=3,1; CI=1,1–8,6). В III триместре течение беременности у пациенток основной группы чаще осложнялось угрозой преждевременных родов 21,3% (OR=1,2; CI=0,6–2,5), плацентарной недостаточностью, сопровождающейся задержкой развития плода – 16,3% (OR=3,7; CI=0,9–15,0) и анемией 18,8% (OR=1,9; CI=0,8–4,3).
 Все пациентки были родоразрешены путем операции кесарева сечениия. Средний объем кровопотери при этом составил 768,4±43,2 мл и 684,5±38,1 мл по группам соответственно.
Все пациентки были родоразрешены путем операции кесарева сечениия. Средний объем кровопотери при этом составил 768,4±43,2 мл и 684,5±38,1 мл по группам соответственно.
Изучение особенностей течения послеоперационного периода не выявило статистически значимых различий, однако у пациенток основной группы чаще диагностировали субинволюцию матки – 6,2% (OR=1,4; CI=0,3–6,3), также только в основной группе имели место случаи позднего послеродового кровотечения, потребовавшие хирургического лечения.
Нами также изучен исход родов для плода и течение раннего неонатального периода у новорожденных. В раннем неонатальном периоде у новорожденных основной группы чаще отмечалась неонатальная желтуха – 19,5% (OR=1,8; CI=1,3–3,7), гипотрофия – 10,5% (OR=1,8; CI=1,1–3,2), кожно-геморрагический синдром – 17,6% (OR=3,4; CI=2,2–8,7).
Анализ соматического и акушерского анамнеза, течения беременности указывает на ассоциацию слабости родовой деятельности с клиническими проявлениями недифференцированной дисплазии соединительной ткани, что подтверждается в работах других исследователей [6, 7, 13, 14].
Особый интерес представляли морфологическое и иммуногистохимические исследования миометрия при слабости родовой деятельности. Следует отметить, что значимых различий при морфологическом исследовании миометрия получено не было, в основном различия соответствовали изменениям, характеризующим дезорганизацию соединительной ткани [3, 8]. Основные структурные изменения диффузно-очагового характера были обнаружены в экстрацеллюлярном матриксе (ЭЦМ). Имелись очаги мукоидного набухания с феноменом метахромазии при окраске толуидиновым синим, которые располагались как в периваскулярной ткани, так и независимо от близости сосудов. В периваскулярной ткани обнаружены очаговые скопления лимфо-гистиоцитарных элементов. Соединительнотканные волокна определялись в умеренном количестве и при окраске по Ван Гизону имели бледно-розовый цвет, располагались неравномерно и хаотично и имели разрывы. Встречались лейомиоциты с выраженным отеком и развитием гидропической дистрофии вплоть до фибриноидного некроза отдельных гладкомышечных клеток. Сосуды были представлены капиллярами и синусоидами в большом количестве, обнаруживались также венулы с дилатированными просветами, вокруг которых нередко располагались диапедезные кровоизлияния. По периферии кровоизлияний и очагов фибриноидного некроза определялась лимфогистиоцитарная инфильтрация с небольшой примесью лейкоцитов.
В группе сравнения отмечалось упорядоченное расположение гипертрофированных мышечных волокон, отек лейомиоцитов, наличие в строме большого количества соединительнотканных фибрилл, располагавшихся в ЭЦМ вдоль гладкомышечных клеток. Сосудистое русло было представлено в основном сосудами капиллярного и синусоидного типа. Воспалительный инфильтрат отсутствовал.
Учитывая результаты морфологического исследования миометрия, интерес представляло изучение структуры ЭЦМ, в частности, содержания коллагеновых волокон, ламинина и др.
При анализе спектра коллагенов нами было выявлено преобладание коллагена III типа (COL3), являющегося эмбриональным типом коллагена, характерным для рубцовой ткани. Было также обнаружено увеличение содержания коллагена IV типа (COL4) (рис. 1 см. на вклейке) в интерстициальной ткани, являющегося основным коллагеном базальных мембран сосудов. По-видимому, преобладание эмбрионального коллагена является фактором дезорганизации соединительной ткани, что может быть обусловлено как генетическими дефектами коллагенов, так и нарушениями катаболизма белков (ММP, TIMP).
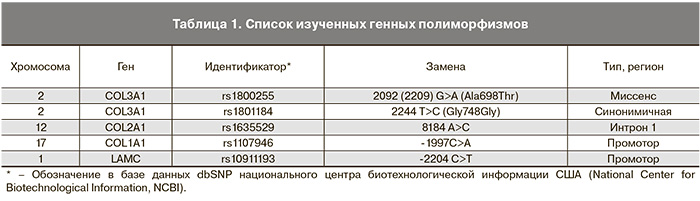
В ранее проведенных работах была изучена патоморфология миометрия при слабости родовой деятельности [4, 11]. При анализе содержания коллагенов нами была установлена ассоциация накопления COL4 в миометрии со слабостью родовой деятельности. У 76% пациенток с нормальным течением родов данный белок не выявлялся при исследовании, а у остальных пациенток данной группы интенсивность окраски соответствовала 1 баллу. При слабости родовой деятельности у всех пациенток было выявлено накопление COL4, при этом у половины интенсивность окраски соответствовала 4 баллам. Таким образом, средняя интенсивность накопления COL4 при слабости родовой деятельности составляла 4 балла по сравнению с 1–2 баллов при нормальной родовой деятельности (рис. 2).
Анализ содержания ламинина не выявил достоверных различий в исследуемых группах, однако отмечена тенденция к большему содержанию при слабости родовой деятельности.
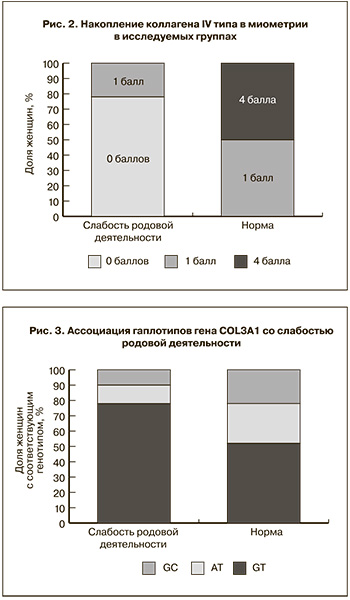
Учитывая результаты морфологического и иммуногистохимического анализа, указывающих на проявления дезорагнизации соединительной ткани, проведено изучение полиморфизмов, ассоциированных с нарушением гомеостаза соединительной ткани при слабости родовой деятельности [12, 15]. Были исследованы два полиморфных локуса гена COL3A1: 2092 (2209) G>A (Ala698Thr) и 2244 T>C (Gly748Gly). Учитывая близкое расположение этих локусов в гене, был проведен анализ сцепления, в результате которого выявлено выраженное неравновесное сцепление D’=1,0 (0,72-1,00), LOD=5,64. Анализ распределения гаплотипов гена COL3A1 показал, что генотипическая частота наиболее распространенного гаплотипа GT составила 77% в группе с нормальным течением родов и в 55% при слабости родовой деятельности (p=0,013) (рис. 3). Различия в частоте встречаемости гаплотипов AT и GC между группами не достигали статистической значимости.
При анализе полиморфизма гена LAMC было установлено, что среди пациенток со слабостью родовой деятельности доля носительниц аллеля T была почти в три раза выше, чем при физиологическом течении (33,3 против 11,8%, р=0,036). Вследствие низкой частоты встречаемости аллеля Т не было выявлено ни одного гомозиготного носителя этого аллеля, тем не менее, даже гетерозиготное носительство ассоциировано со слабостью родовой деятельности (OR=3,72 (1,07–12,94)).
Заключение
Таким образом, проведенное исследование выявило морфологические изменения в ЭЦМ, характеризующие дезорганизацию соединительной ткани. Кроме того, проведение иммуногистохимического исследования установило изменения содержания ламинина и коллагена III и IV типа в миометрии при слабости родовой деятельности, которые можно рассматривать в качестве морфологического субстрата для развития данного осложнения. Полученные данные послужили основой для проведения молекулярно-генетического исследования. Установленные ассоциации между морфологическими, иммуногистохимическими и молекулярно-генетическими данными демонстрируют важную роль структурных белков, участвующих в формировании ЭЦМ при слабости родовой деятельности. Вместе с тем обнаруженные взаимосвязи между генными полиморфизмами позволяют использовать генетические маркеры в качестве неинвазиных предикторов для формирования группы риска и возможного прогнозирования слабости родовой деятельности.



