Преэклампсия (ПЭ) – мультисистемное патологическое состояние, возникающее во второй половине беременности (после 20-й недели), характеризующееся артериальной гипертензией в сочетании с протеинурией (≥0,3 г/л в суточной моче), нередко отеками и проявлениями полиорганной/полисистемной дисфункции/недостаточности [1]. ПЭ является одной из основных причин материнской заболеваемости и смертности в России и в мире [2]. Этиология и патогенез ПЭ до сих пор активно изучаются. Согласно современной теории [3], развитие ПЭ проходит в две стадии. Первая стадия характеризуется нарушением инвазии трофобласта, вторая – эндотелиальной дисфункцией и клиническими проявлениями.
С точки зрения разработки подходов к профилактике и лечению ПЭ важно учитывать существование двух ее различных фенотипических проявлений: ранней (плацентарной) и поздней (материнской) [4].
Имеющиеся данные указывают, что при общих клинических проявлениях имеют место патофизиологические особенности двух вариантов ПЭ. В связи с этим представляет интерес выявление различий в течение беременности, материнских и перинатальных исходов с учетом фенотипической картины данного осложнения.
Большое количество исследований последних лет посвящено выявлению и изучению клинических предикторов и специфических маркеров развития ПЭ, расчету риска ее возникновения у пациентки [5, 6].
З.С. Ходжаева и соавт. (2013) проанализировали демографические и антропометрические параметры матерей и новорожденных, а также изменения маточного и фетоплацентарного кровотока при ранней и поздней ПЭ [7]. X.L. Li соавт. (2015), кроме того, сравнили функцию мочевыделительной системы у пациенток с ранней и поздней ПЭ [8], однако не уделяли внимания изучению перинатальных исходов. В работе Н.Е. Кан и соавт. (2016) был проведен подробный анализ клинико-лабораторных предикторов данного осложнения [5]. В исследовании R. Madazli и соавт. (2014) показано, что пациентки с ранней формой ПЭ значимо чаще имеют аномальный кровоток в маточных артериях (71,4% против 30,1%, p<0,001), у пациенток этой группы чаще отмечался синдром задержки роста плода и маловодие, выше уровень мертворождаемости и неонатальных потерь (p<0,01) [9]. Однако влияние срока манифестации ПЭ на течение периода новорожденности не изучалось.
Таким образом, по-прежнему представляет интерес разностороннее изучение клинических особенностей течения беременности, изменений данных лабораторно-инструментальных исследований, материнских и перинатальных исходов, течения периода новорожденности с учетом фенотипа ПЭ.
В связи с вышеизложенным, целью нашей работы стало комплексное изучение течения беременности, материнских и перинатальных исходов, периода новорожденности у пациенток с ранней и поздней формами ПЭ.
Материал и методы исследования
Исследование выполнялось на базе ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. В проспективное когортное исследование были включены 70 пациенток, из них группу 1 (с ранней ПЭ) составили 40 пациенток, группу 2 (с поздней ПЭ) – 30 пациенток. Сроки манифестации ПЭ составили 21–33 недели 6 дней в группе 1 и 34–39 недель в группе 2.
Критериями включения в исследование были наличие у пациентки ПЭ согласно критериям, представленным в клинических рекомендациях «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» 2013 г. [1, 10–12] и подписанное информированное согласие женщины на проведение исследования. Критериями исключения – онкологические заболевания, трансплантация внутренних органов в анамнезе пациентки.
Все пациентки получали медикаментозную терапию, которая включала профилактику эклампсии с использованием 25% раствора сульфата магния по стандартной схеме. При сроке беременности до 34 недель проводили профилактику респираторного дистресс-синдрома новорожденных глюкокортикоидами. Антигипертензивная терапия включала использование препаратов первой линии: α2-адреномиметиков (метилдопа), блокаторов кальциевых каналов по стандартным схемам лечения.
Статистическую обработку данных выполняли при помощи пакета программ Statistica 10 (USA) и языка программирования R с применением точного теста Фишера для оценки частотных показателей, теста Манна–Уитни для сравнения непараметрических данных, t-теста для сравнения параметрических данных. Мерами ассоциации для сравнения бинарных данных явились относительный риск (ОР) с 95% доверительным интервалом (ДИ). В случае нулевого значения одной из страт рассчитывался приблизительный относительный риск (ОРпр) путем прибавления 0,5 к каждой из страт. Различия считали статистически значимыми при уровне достоверности р<0,05.

Результаты исследования
При оценке клинико-анамнестических характеристик пациенток с ранней и поздней формами ПЭ не было выявлено статистически значимых различий по возрасту (33,2±5,4 и 31,9±4,3 года соответственно, p=0,235) и индексу массы тела (28,0±6,9 кг/м2 и 29,0±3,9 кг/м2, р=0,779).
Тяжелая форма ПЭ была отмечена у трех пациенток группы ранней ПЭ (7,5%) и у одной пациентки группы поздней ПЭ (3,3%, ОР=2,25, p=0,423). HELLP-синдром имел место только у двух пациенток группы ранней ПЭ (5%, p=0,323).
Пациентки с ранней ПЭ чаще страдали хронической артериальной гипертензией – 35,0% в группе 1 и 13,3% в группе 2 (ОР=2,63, p=0,035), а также незначительно чаще имели диагноз гестационной артериальной гипертензии до выявления ПЭ – 10% в группе 1 и 0% в группе 2 (ОРпр=6,81, p=0,100) и имели ПЭ в анамнезе – 17,5% в группе 1 и 3,3% в группе 2 (ОР=5,25, p=0,067).
В группе пациенток с ранней ПЭ артериальная гипертензия манифестировала в среднем на 10 недель раньше, чем у пациенток с поздней ПЭ (27,8±3,9 и 37,0±1,4 недели, p<0,001). В то же время сроки поступления в стационар у пациенток с ранней ПЭ были только на 5 недель меньше (32,0±5,0 и 37,5±1,9 недель, p<0,001).
В табл. 1 представлены особенности течения беременности, характеризующие развитие плода, у женщин сравниваемых групп.
Плацентарная недостаточность (по данным методов функциональной диагностики) отмечена у 35,0% пациенток группы 1 и 3,3% пациенток группы 2 (ОР=10,5, p=0,001), синдром задержки роста плода – у 25,0% и 6,7% (ОР=3,75, p=0,042). Частота выявления маловодия и нарушений состояния плода по данным допплерометрии и/или данным кардиотокографии существенно не различались.
Не было различий в уровне гипертензии при госпитализации пациенток в стационар. Так, систолическое и диастолическое АД на момент поступления составляли в среднем 151±14 и 95±9 мм рт. ст., соответственно, среднее АД – 114±10 мм рт. ст. Уровень суточной протеинурии не различался в сравниваемых группах (1,4±1,3 г/л в группе ранней ПЭ, 1,2±1,3 г/л в группе поздней ПЭ, р=0,581).
Мы отметили более высокий уровень печеночных ферментов (табл. 2) в крови у пациенток с ранней ПЭ, по сравнению с пациентками с поздней ПЭ в пределах референсных значений. При этом только у беременных с HELLP-синдромом уровень ферментов превышал референсные значения.
Уровень гемоглобина составил 117,2±13,7 и 113,0±12,4 г/л (р=0,190), гематокрита – 35,2±3,5 и 35,0±2,6 % (р=0,763) в группах ранней и поздней ПЭ соответственно.
Количество тромбоцитов у беременных группы ранней ПЭ было достоверно ниже и составляло в среднем 193,3x109 (159,3–222,3) в группе с ранним началом и 229,0x109 (168,0–277,0) – с поздним (p=0,048), хотя и оставалось в пределах референсных значений. При этом развитие тромбоцитопении было отмечено только у беременных с HELLP-синдромом.
Показатели почечной функции в сыворотке крови существенно не различались между группами. Уровень мочевины составил 4,1 ммоль/л (3,1–5,1) и 3,9 ммоль/л (2,9–4,5) (р=0,165), креатинина – 71,3 мкмоль/л (64,4–83,8) и 70,2 мкмоль/л (63,7–78,1) (р=0,6), скорость клубочковой фильтрации – 96 мл/мин/1,73м2 (79–109) и 99 мл/мин/1,73 м2 (87–111) (р=0,6).
Профилактика респираторного дистресс-синдрома плода проведена у 57,9% пациенток группы 1 и 10,3% пациенток группы 2 (ОР=5,60, p<0,001). Однако не было различий в объеме проведенной магнезиальной и антигипертензивной терапии.
Продолжительность пролонгирования беременности с момента поступления пациентки в стационар была больше у пациенток с ранней ПЭ, однако различия оказались статистически недостоверными (5,0±6,9 и 3,3±5,5 дней, p=0,101). Сроки беременности на момент родоразрешения были в среднем на 5 недель меньше у пациенток с ранней ПЭ (32,9±4,6 и 37,6±1,7 недель, p<0,001).
Частота родоразрешения путем кесарева сечения в группах различалась несущественно (87,5% в группе ранней ПЭ и 70,0% в группе поздней ПЭ, p=0,066). Пять пациенток из группы ранней ПЭ и девять – из группы поздней ПЭ были родоразрешены через естественные родовые пути. Показания к завершению беременности путем операции кесарева сечения приведены в табл. 3. При ранней ПЭ чаще отмечалось отсутствие эффекта от проводимой терапии, что проявлялось стойкой артериальной гипертензией – 55% в группе 1 и 20% в группе 2 (ОР=2,75, p=0,003) и/или нарастанием протеинурии – 57,5% в группе 1 и 20% в группе 2 (ОР=2,88, p=0,002) и/или ухудшением состояния плода – 30% в группе 1 и 6,7% в группе 2 (ОР=4,5, p=0,015).
Из четырнадцати пациенток, родоразрешенных через естественные родовые пути, в семи наблюдениях имело место спонтанное начало родовой деятельности. В двух наблюдениях группы ранней ПЭ и пяти – поздней ПЭ были проведены подготовка шейки матки и родовозбуждение.
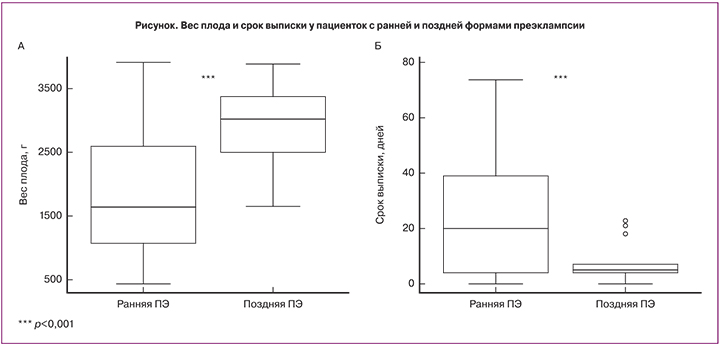
При анализе перинатальных исходов мы выявили, что дети, рожденные пациентками с ранней ПЭ, отставали по массо-ростовым показателям, что коррелирует со сроком манифестации ПЭ.
Дети при рождении имели меньшую массу тела (1895±1018 г против 2890±587 г, p<0,001) (рис. А), рост (42±8 против 49±3 см, p<0,001) и окружность головы (27±5 против 35±4 см, p<0,001). Во всех 10 наблюдениях диагностированный синдром задержки роста плода подтвердился после рождения. Кроме того, дети, рожденные пациентками с ранней ПЭ, имели меньшую оценку по шкале Апгар на 1 (7±1,2 против 7,7±0,7 балла, p<0,001) и 5 (8±1,0 против 8,7±0,5 баллов, p<0,001) минутах жизни.
Перевод в отделение интенсивной терапии новорожденных потребовался 70% детей группы 1, что в 7 раз выше, чем в группе 2 (p<0,001). Продолжительность госпитализации (рис. Б) детей группы 1 была значимо выше, чем детей группы 2 (29,6±33,3 против 6,4±5,4 дня, p<0,001).
В трех наблюдениях нашей серии отмечена постнатальная гибель ребенка на 3-и (сепсис), 5-е (пневмония), 33-и (пневмония, нарушение сердечного ритма) сутки жизни. Все погибшие дети были в группе ранней ПЭ и родились с тяжелыми дыхательными нарушениями на фоне глубокой недоношенности.
Обсуждение
В ходе проведенного исследования мы сравнили материнские и перинатальные исходы у пациенток с ранней и поздней формами ПЭ.
Нами не обнаружено существенных различий в основных демографических показателях между сравниваемыми группами. Однако пациентки с ранней ПЭ достоверно чаще страдали хронической артериальной гипертензией и имели ПЭ в анамнезе, что согласуется с данными о клинико-лабораторных предикторах ПЭ [13].
В то же время тенденция более высокой частоты гестационной артериальной гипертензии в этой группе, по-видимому, свидетельствует о том, что артериальная гипертензия у этих женщин была симптомом развивающейся ПЭ.
Сроки манифестации ПЭ, поступления в стационар и родоразрешения были в среднем меньше у пациенток с ранней ПЭ, что, по всей видимости, связано с ранним развитием ПЭ.
В то же время обращает внимание, что сроки манифестации патологического процесса и сроки госпитализации, свидетельствующие о достижении процессом пика своих проявлений, существенно различались. Так, ранняя ПЭ развивалась на 10 недель раньше, но срок госпитализации отличался только на 5 недель от такового при поздней ПЭ. При этом не было различий в выраженности основных клинических проявлений – артериальной гипертензии и протеинурии.
Несмотря на то, что количество тромбоцитов и уровень печеночных ферментов в периферической крови у большинства пациенток находились в пределах референсных значений, нами обнаружен достоверно более высокий уровень аланинаминотрансферазы, аспартатаминотрансферазы, щелочной фосфатазы и сниженный – тромбоцитов у пациенток с ранней формой ПЭ. Данные различия сохранялись даже после исключения из анализа беременных с HELLP-синдромом, у которых уровни печеночных ферментов и количество тромбоцитов выходили за пределы нормальных значений. Этот факт может быть обусловлен тем, что, несмотря на отсутствие различий в клинических проявлениях, ранняя ПЭ сопровождается более тяжелыми нарушениями метаболических функций и более интенсивным потреблением тромбоцитов. С другой стороны, вышеуказанные нарушения могут быть обусловлены большей продолжительностью течения ПЭ в этой группе.
Об истощении компенсаторных возможностей у женщин с ранней ПЭ свидетельствует более высокая частота отсутствия эффекта от проводимой терапии. Кроме того, у пациенток с ранней ПЭ в 10,5 раза чаще наблюдалась плацентарная недостаточность и ее главные проявления. Эта особенность закономерно коррелирует с продолжительностью течения патологического процесса.
Согласно данным R. Madazli и соавт. (2014), одним из осложнений ранней ПЭ является маловодие, однако в нашем исследовании не было выявлено достоверной связи между формой ПЭ и развитием маловодия [9].
Более раннее развитие ПЭ при отсутствии возможности обеспечить пролонгирование беременности определяет более высокую частоту профилактики респираторного дистресс-синдрома и рождения недоношенных детей, что в свою очередь утяжеляет исходы в этой группе пациенток.
Ранняя манифестация заболевания в совокупности с частым отсутствием эффекта от проводимой терапии и увеличением частоты нарушений состояния плода (в 2,5 раза) привела к увеличению числа операций кесарева сечения (в 1,2 раза) в группе пациенток с ранней ПЭ.
В то же время в нашем исследовании у двух пациенток группы ранней ПЭ и у пяти пациенток группы поздней ПЭ была использована тактика проведения преиндукции родов и программированного родоразрешения через естественные родовые пути. В результате частота кесарева сечения оказалась существенно ниже, чем по данным Ni Yanyan и соавт. (2016) [14], что свидетельствует о возможностях дальнейшего совершенствования тактики ведения женщин этой группы с определением оптимальных сроков и методов родоразрешения.
Вышеизложенные особенности течения беременности находят отражение в перинатальных исходах. Дети пациенток, страдавших ранней формой ПЭ, имели в среднем меньшие массо-ростовые показатели. Оценка по шкале Апгар также была ниже у детей этой группы пациенток. Кроме того, дети пациенток с ранней формой ПЭ в 7 раз чаще потребовали перевода в отделение реанимации и интенсивной терапии новорожденных, а продолжительность госпитализации был достоверно выше, чем у детей пациенток с поздней формой ПЭ. Эти исходы определялись как нарушениями в плацентарной системе, так и высокой частотой недонашивания беременности.
Заключение
Таким образом, изучение особенностей течения беременности, материнских и перинатальных исходов при двух фенотипических вариантах ПЭ показывает, что наиболее важным клиническим отличием является более раннее начало патологического процесса. При этом такие классические клинические проявления данного осложнения как гипертензия и протеинурия не являются определяющими для характеристики тяжести состояния.
Как результат более раннего начала, возможно, в связи с нарушением инвазии трофобласта, длительного течения системного патологического процесса, чаще встречается плацентарная недостаточность, метаболические нарушения и чрезмерная активация гемостаза с потреблением форменных элементов крови, в первую очередь – тромбоцитов.
Более высокая частота неблагоприятных перинатальных исходов при ранней ПЭ также находится в прямой зависимости от сроков развития осложнения, так как определяется частотой плацентарной недостаточности и недонашивания беременности.
Таким образом, для диагностики ранней ПЭ и прогнозирования ее осложнений классический подход, опирающийся на клинические проявления (гипертензия и протеинурия), является недостаточным. Необходимо продолжение изучения особенностей ранней ПЭ и расширение спектра лабораторных и инструментальных методов раннего выявления характерных нарушений гомеостаза, поиска предикторов, методов профилактики и лечения.



