Хронический эндометрит (ХЭ) – персистирующее воспаление эндометрия, диагностируемое в биопсийном материале 3–10% женщин с аномальными маточными кровотечениями [1, 2]. В большинстве случаев ХЭ протекает бессимптомно или с наличием таких неявных симптомов, как тазовая боль и диспареуния, которые могут сочетаться с кровянистыми выделениями или лейкореей [3, 4]. В МКБ-10 ХЭ отнесен к рубрике N 71.1 «хроническая воспалительная болезнь матки», лечение которой не всегда осуществляется с помощью противовоспалительных и антибактериальных средств и отражает ее этиологическое и патогенетическое разнообразие.
Отсутствие выраженных клинических проявлений патологического процесса, тем не менее, во многих случаях сопровождается бесплодием и привычным невынашиванием беременности [5, 6]. ХЭ считают ведущей причиной бесплодия в 12–46% случаев, причиной неудач ЭКО – в 30% случаев, идиопатического первичного бесплодия и идиопатических повторных выкидышей – в 28% [7, 8]. Наряду с этим инвазивные диагностические манипуляции со слизистой оболочкой матки рассматривают как фактор развития ХЭ.
Гистологический диагноз ХЭ основан на выявлении плазматических клеток в стромальном компартменте слизистой оболочки матки [2, 9] наряду с ее другими структурными изменениями, такими как нерегулярность желез, увеличение плотности стромы в сочетании с поверхностным отеком, а также присутствие в клеточном инфильтрате лимфоцитов с трансэпителиальным лейкопедезом [10]. На парафиновых срезах, окрашенных гематоксилином и эозином, плазматические клетки имеют эксцентрично локализованные ядра и светлый перинуклеарный «ободок». При этом выявление плазмоцитов в эндометрии нередко затруднено высокой плотностью мононуклеарных инфильтратов и фенотипической мимикрией ряда стромальных клеток, обусловленной децидуальной трансформацией или гормонотерапией [2]. Поэтому для дифференциальной диагностики ХЭ используют иммуногистохимическое (ИГХ) выявление плазмоцитов по экспрессии биомаркера CD138 [11]. Однако секреторная фаза цикла, значимая с точки зрения «открытия окна имплантации», характеризуется децидуализацией стромального компартмента эндометрия с участием плазмоцитов [12].
В связи с этим требуется большее понимание того, какое число плазмоцитов в эндометрии является отражением физиологического статуса, и какая их численная плотность коррелирует с выраженностью воспалительного процесса и наличием инфекций [2], а также с особенностями гистологической картины хронического эндометрита в «тонком» эндометрии.
Проблема не отвечающего на гормонотерапию «тонкого» эндометрия побуждает к поиску новых лечебных воздействий на эндометрий, например, газового орошения [13]. Предложено также применение интравагинальной пелоидотерапии из арсенала целебных природных факторов [14].
Цель работы – клинико-морфологическое исследование пациенток с ХЭ в зависимости от толщины эндометрия с акцентом на содержании CD138-позитивных плазмоцитов и их предшественников CD20 В-лимфоцитов в пайпель-биоптатах в динамике применения пелоидов озера Карачи.
Материал и методы исследования
Проведено клинико-морфологическое «случай-контроль» и проспективное когортное исследование 240 пациенток в возрасте от 18 до 43 лет (27,0±2,9 года) с диагнозом ХЭ. Диагноз ХЭ устанавливали по клинико-анамнестическим данным, результатам вагинального цитологического и микробиологического исследования, ультразвукового исследования (УЗИ) и комплексного гистологического изучения пайпель-биопсии эндометрия, в том числе в 88 наблюдении – с ИГХ-исследованием на экспрессию CD138-позитивных плазмоцитов.
Критерии включения в исследование: репродуктивный возраст (до 45 лет), наличие нарушений репродуктивной функции (бесплодие, неудачные попытки ЭКО, отягощенный акушерско-гинекологический анамнез) и информированное согласие пациентки на обследование и лечение ХЭ.
Критерии исключения: беременность, острые или хронические заболевания в стадии обострения, инфекции, передающиеся половым путем, гормонотерапия (по крайней мере за 3 месяца до исследования), гиперплазия и полипы эндометрия, наружный генитальный эндометриоз, миома матки, тяжелые соматические заболевания и неопластические процессы.
Исследование выполнено в полном соответствии с положениями Хельсинкской декларации по соблюдению прав человека и одобрено этическим комитетом Новосибирского государственного медицинского университета (протокол № 63 от 27.03.2014).

До лечения пациентки были разделены на две репрезентативные по возрасту и клиническому статусу группы в зависимости от толщины эндометрия, оцениваемой по УЗИ в пролиферативную фазу менструального цикла (на 8–11-й день цикла) [15]: 118 женщин с нормальным (М-эхо >6 мм) и 122 женщины с «тонким» эндометрием (М-эхо ≤6 мм). Комплексное гистологическое изучение эндометрия минимум в 6 клинических наблюдениях каждой группы включало в себя ИГХ-исследование экспрессии лейкоцитарных кластеров дифференцировки CD20 (В-лимфоциты, Clone L26, Code M0755 (Dako), разведение 1:200) и CD138 (плазматические клетки, Clone MI15, Code IS642 (Dako), готовые к использованию).
После комплексного исследования для последующего лечения пациентки были разделены случайным образом: группы 1 и 2 – с нормальным эндометрием, группы 3 и 4 – с тонким эндометрием. Группам 1 и 3 (53 и 55 женщин) проводили стандартную медицинскую реабилитацию согласно приказу МЗ РФ от 24.12.2012 г. № 1502н; группы 2 и 4 (65 и 67 пациенток) пролечены по той же схеме в сочетании с пелоидами озера Карачи.
Первая схема – витамино-минеральная и физиотерапия в течение 14 суток: 470 мг магния лактата, 5 мг пиридоксина, 0,05 мг селена, 7,2 мг цинка, 4,8 мг β-каротина, 31,5 мг витамина Е, 180 мг витамина С, 8 мг α-токоферола ацетата, 400 мкг фолиевой кислоты и 200 мкг калия йодида. В проекции придатков и крестца проводили лекарственный электрофорез с цинком на аппарате «Поток-1». Для нормализации микрофлоры влагалища рекомендовали применять вагинальные таблетки гинофлор э (лиофилизат ацидофильных лактобактерий 50 мг, эстриол 30 мкг) интравагинально на ночь. В качестве местной иммуномодулирующей терапии назначали ректальные суппозитории полиоксидоний (азоксимера бромид 12 мг).
Вторая схема – сочетание указанной витамино-минеральной и физиотерапии и пелоидов озера Карачи (Западно-Сибирская равнина) – природного источника лечебной сульфидно-иловой грязи. Аппликации пелоидов на нижнюю половину туловища и вагинальные тампоны (нагретые до 38–42°С, продолжительность процедуры 15 мин) назначали курсом по 14 процедур в соответствии с Приказом Минздравсоцразвития № 218 от 22.11.2004 г. «Об утверждении стандарта санаторно-курортной помощи больным с болезнями женских тазовых органов, невоспалительными болезнями женских половых органов».
Пайпель-биоптаты фиксировали в 4% параформальдегиде, приготовленном на фосфатном буфере Миллонига (pH=7,2–7,4); парафиновые срезы окрашивали гематоксилином и эозином. Экспрессию кластеров дифференцировки 20 и 138 исследовали на парафиновых срезах толщиной 5 мкм с помощью двухшагового стрептавидин-биотинового ИГХ-метода. Продукты реакции визуализировали диаминобензидином (DAB), срезы докрашивали гематоксилином. Для негативного контроля вместо первичных антител использовали 5% бычью сыворотку, в качестве позитивного контроля – препараты лимфом. Использовали микроскоп Axio Scope.A1 с фотокамерой AxioCam MRc5 (C.Zeiss).
Два независимых патоморфолога при увеличении 400 в 10 неперекрываемых полях зрения при отсутствии нейтрофилов (маркеров обострения ХЭ) применяли полуколичественный метод оценки экспрессии [10, 16, 17]: для CD20 В-лимфоцитов 0 баллов – нет окрашенных клеток, 1 балл – окраска одиночных, 2 – окраска более многочисленных клеток, и 3 балла – наличие лимфоидных агрегатов и фолликулов. Для CD138-позитивных плазматических клеток: 0 баллов – нет экспрессии, 1 балл – от 1 до 3 ИГХ-позитивных клеток, 2 балла – от 4 до 10 клеток, 3 балла – более 10 клеток. Для каждой группы исследовали минимум 6 пайпель-биоптатов, от 42 до 48 полей зрения; каждое измерение ранжировано по баллам, все подсчеты приняты за 100% и распределены по градациям баллов с последующей статистической обработкой результатов.
Проверка данных в выборках на нормальность распределения выполнена с помощью критерия Колмогорова–Смирнова, все выборки не соответствовали нормальному распределению, р<0,05. Для сравнения групп по качественному признаку использовали критерий χ2. Сравнение результатов парных показателей в группах выполнено с помощью критерия Вилкоксона; данные независимых выборок – с помощью критерия Манна–Уитни. Для межгрупповых сравнений микрофлоры использовали регрессионный анализ, для оценки ранговых переменных экспрессии кластеров дифференцировки – многофакторный дисперсионный анализ (ANOVA) с последующим выделением групп со статистически значимыми различиями (апостериорный анализ). Критическое значение уровня значимости принималось равным 0,05. Статистическая обработка выполнена с помощью пакета прикладных программ StatSoft, Inc. (2001) Statistica v.6.
Результаты и их обсуждение
Ведущие проявления ХЭ до и после лечения проанализированы с помощью критерия χ2 при попарном сравнении между группами в зависимости от толщины эндометрия и метода лечения. У пациенток и с нормальной толщиной эндометрия, и с тонким эндометрием болевой синдром, гистероскопические признаки ХЭ, нарушения цикла, аномальные маточные кровотечения и бесплодие встречались достаточно часто во всех 4 группах, сформированных для последующего лечения по двум схемам. Не было отличий и по количеству заболеваний шейки матки как весьма распространенной патологии у женщин репродуктивного возраста с ХЭ. Достоверное отличие (р=0,002) выявлено лишь для бесплодия в группах пациенток с нормальным (11 случаев из 53, 1-я группа) и тонким (30 женщин из 55, 3-я группа) эндометрием, случайным образом выбранных для лечения по стандартной схеме.
При анализе результатов лечения при попарном сравнении 4 групп обращает на себя внимание отсутствие достоверных отличий по всем проявлениям ХЭ у пациенток с нормальным эндометрием, пролеченных двумя различными схемами. Однако для тонкого эндометрия получены достоверные различия по показателю нарушений цикла – более успешные результаты при комплексной терапии (р=0,02, сравнение 3-й и 4-й групп).
Сравнение результатов лечения с помощью двух схем выявило отличия по бесплодию у пациенток и с нормальным (сравнение групп 1 и 3, р=0,0002), и с тонким (сравнение групп 2 и 4, р=0,0006) эндометрием; однако улучшение показателей больше выражено у пациенток с нормальным эндометрием, в том числе и по показателю нарушений цикла (р=0,0003).
В целом, после лечения частота большинства изучаемых клинических проявлений ХЭ во всех 4 группах уменьшилась (табл. 1); при этом наибольшее количество достоверных отличий получено при комбинированном лечении с пелоидами (2-й и 4-й группы), что свидетельствует о более высокой эффективности комплексной терапии пациенток с ХЭ как с нормальным, так и с тонким эндометрием.
 При УЗИ органов малого таза использовали разработанную для ХЭ балльную шкалу оценки данных В-режима и цветового допплеровского картирования в пролиферативную фазу цикла [15]. Суммирование баллов производили с учетом толщины эндометрия менее 6 мм (1 балл), неровности его наружного контура (1 балл) и линии смыкания переднего и заднего листков (1 балл), неравномерности повышения эхогенности эндометрия (1 балл), гиперэхогенных включений в проекции базального слоя (2 балла), неравномерного расширения полости матки (1 балл), синехий в полости матки (2 балла) и расширения вен миометрия более 3 мм (1 балл).
При УЗИ органов малого таза использовали разработанную для ХЭ балльную шкалу оценки данных В-режима и цветового допплеровского картирования в пролиферативную фазу цикла [15]. Суммирование баллов производили с учетом толщины эндометрия менее 6 мм (1 балл), неровности его наружного контура (1 балл) и линии смыкания переднего и заднего листков (1 балл), неравномерности повышения эхогенности эндометрия (1 балл), гиперэхогенных включений в проекции базального слоя (2 балла), неравномерного расширения полости матки (1 балл), синехий в полости матки (2 балла) и расширения вен миометрия более 3 мм (1 балл).
У каждой пациентки сумма баллов до лечения составила 4 и более, что соответствовало диагнозу ХЭ и сопровождалось наличием комплекса гистологических маркеров ХЭ в пайпель-биопсии эндометрия. После лечения диагноз ХЭ по данным УЗИ (сумма баллов ≥4) сохранился у 167 пациенток из 240, в остальных 73 случаях – менее 4 баллов. При сравнении результатов стандартной схемы лечения и дополненной пелоидами, установлено достоверное уменьшение суммы баллов УЗИ у пациенток с нормальной толщиной эндометрия, использовавших пелоиды (р=0,037). Однако у пациенток с «тонким» эндометрием значимых различий сумм баллов после реабилитации не выявлено (р=0,502).
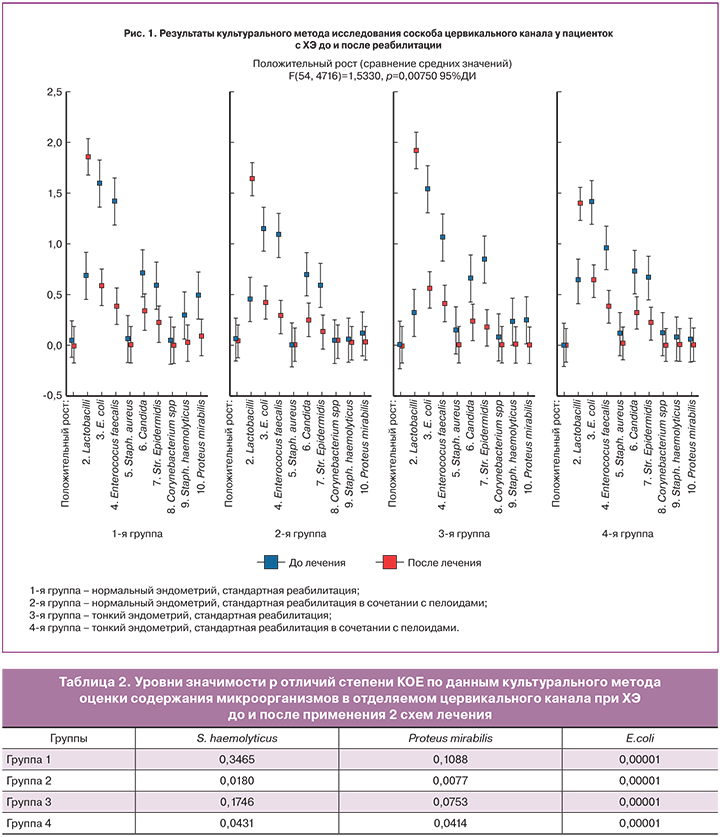
Результаты культурального метода исследования соскоба цервикального канала у пациенток 4 групп до лечения демонстрировали отсутствие клинически значимых показателей для назначения антимикробной терапии. При этом у пациенток и с нормальным, и тонким эндометрием в спектре микроорганизмов обращали на себя внимание широко распространенные бактерии: Escherichia coli, Enterococcus faecalis и Staphylococcus epidermidis, аналогично результатам культурального исследования E. Cicinelli и соавт. [18].
После применения обеих схем медицинской реабилитации исходно небольшой рост большинства микроорганизмов значительно снижен во всех 4 группах, различия статистически достоверны (рис. 1).
При этом как стандартная (в группах 1 и 3), так и комплексная (в группах 2 и 4) терапия не оказала влияния на рост грамположительных бактерий Staphylococcus aureus и Corinebacterium spp. За исключением группы 4, имелись единичные образцы с отсутствием роста. Важно отметить, что использование пелоидов в схеме лечения групп 2 и 4 привело к уменьшению роста гемолитического стрептококка и протея, различия статистически достоверны (табл. 2). В противовес этому, группы 1 и 3, пролеченные по стандартной схеме, не обнаружили значимых различий количества этих микроорганизмов до и после лечения.
Несмотря на противоречивость результатов оценки роста микроорганизмов, персистирующих в слизистой оболочке матки и влагалища в норме и при ХЭ, их роль в патогенезе ХЭ признают большинство исследований. По данным R.-L. Fang и соавт. [19], выполнивших секвенирование образцов эндометрия и влагалища женщин репродуктивного возраста, эндометрий здоровых женщин имеет богатый микробиом, значительно отличающийся от микробиома влагалища. По мнению авторов, патологические эффекты микрофлоры могут относиться к особо вирулентным штаммам или видам, высоким концентрациям бактерий или полимикробному дисбиозу на поверхности эндометрия. Наличие бактерий в полости матки не связано с выраженной воспалительной иммунной реакцией, что указывает на не приводящее к патологии существование небольших количеств бактерий-комменсалов; при этом большинство внутриматочных комменсалов не могут быть исследованы с помощью культурального метода.
Заслуживает внимания положительный рост у пациенток с тонким эндометрием представителя кишечной микрофлоры Escherichia coli и ее торпидность к большинству антибактериальных схем лечения [18]. В нашем исследовании среднее количество КОЕ Escherichia coli после лечения снизилось почти в 3 раза, причем наиболее значительно – в группах 2 и 4, в лечении которых использованы пелоиды в дополнение к стандартной схеме (р<0,0001) (рис. 2). По данным W. Ren [20], Escherichia coli, нередко доминирующая при ХЭ, обладает ингибирующим влиянием на пролиферацию клеток. В связи с этим более резкое уменьшение роста Escherichia coli при использовании пелоидов может быть обусловлено неспецифическим улучшением микроциркуляции и активацией местных иммунных процессов.
Полуколичественный метод оценки экспрессии маркеров CD20 и CD138 в эндометрии с нормальной толщиной М-эха в пролиферативную фазу цикла до лечения продемонстрировал отсутствие достоверных различий в характере распределения образцов эндометрия по балльной шкале. Например, в 23% образцов в 1-й и 2-й группах экспрессия CD20 отсутствовала, экспрессия в 1 балл – в 37 и 36% образцов и 2 балла – 40 и 41% соответственно. По экспрессии CD138 до лечения группы также не различались, более чем в половине образцов наличие плазмоцитов оценивали в 1 балл.
У пациенток с нормальной толщиной эндометрия после лечения по стандартной схеме общая характеристика распределения образцов эндометрия по экспрессии обоих кластеров дифференцировки (% случаев каждой градации) достоверно не изменилась, но вариабельность образцов увеличилась со смещением большего числа образцов в 1-балльную градацию. Однако при использовании комплексной реабилитации процент образцов 2-й градации был резко снижен, что повлияло на снижение стандартного отклонения и достоверность отличий иммунопозитивных В-лимфоцитов и плазмоцитов от показателя до лечения.
Метод оценки распределения по баллам образцов у пациенток с ХЭ и тонким эндометрием до лечения продемонстрировал репрезентативность групп 3 и 4, которые не отличались между собой по экспрессии CD20 и CD138. При этом в отличие от нормального эндометрия, было меньше образцов с отсутствием экспрессии CD20 и наличием образцов с баллами 1, 2 и 3. Кроме того, экспрессия CD138 отличалась высокими и почти равными долями образцов, отнесенных к градациям 1 и 2. Эти особенности нормального и тонкого эндометрия до лечения при использовании метода дисперсионного анализа выявили достоверные отличия (р<0,05).
У пациенток с тонким эндометрием после лечения по стандартной схеме общая характеристика распределения образцов эндометрия по экспрессии обоих кластеров дифференцировки (% случаев каждой градации) изменилась следующим образом. После лечения группы 3 (стандартная схема) по CD20 выявлен тренд смещения оценки образцов в верхние градации: стало больше иммунонегативных образцов, а также случаев с баллами 1 и 2. Однако по сравнению с исходным распределением для группы 4 установлено увеличение доли 2-й градации при резком сокращении 3-й, то есть стало больше образцов с умеренным количеством В-лимфоцитов.
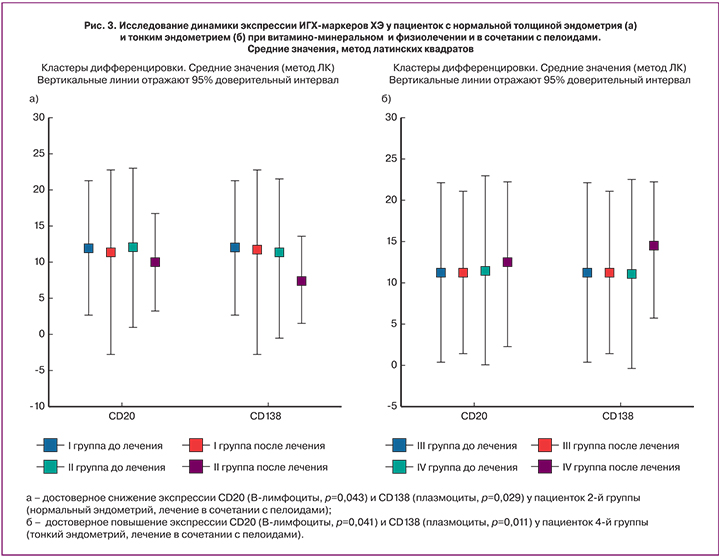
Таким образом, исследование динамики экспрессии ИГХ-маркеров ХЭ у пациенток с нормальной толщиной эндометрия и тонким эндометрием при витамино-минеральном и физиолечении и в сочетании с пелоидами (рис. 3а, б) продемонстрировало достоверное снижение экспрессии CD20 (В-лимфоциты, р=0,043) и CD138 (плазмоциты, р=0,029) у пациенток 2-й группы (нормальный эндометрий) при лечении в сочетании с пелоидами. Однако у пациенток 4-й группы (с тонким эндометрием) при реабилитации в сочетании с пелоидами экспрессия CD20 (В-лимфоциты, р=0,041) и CD138 (плазмоциты, р=0,011) достоверно повысилась, отражая сохранение провоспалительного потенциала слизистой оболочки матки.
Среди женщин репродуктивного возраста с ХЭ возросла доля пациенток с тонким эндометрием, которые торпидны к большинству лечебных воздействий [4, 13, 15]. При этом именно с тонким эндометрием связано большинство случаев первичного и вторичного бесплодия, в том числе при переносе эмбрионов в матку. Позитивный эффект локального повреждения эндометрия на наступление беременности и рождение живого ребенка одним из первых опубликован в 2003 г. [21]. Общее понимание роли локального «повреждения» даже с помощью пайпель-биопсии эндометрия основано на рекрутировании моноцитов, дифференцирующихся в макрофаги и секретирующих ряд цитокинов, хемокинов и факторов роста, с привлечением клеток гуморального иммунитета – плазмоцитов и их предшественников – В-лимфоцитов, что способствует регенерации [22].
Нами [5, 6, 23] выделен новый аспект в морфогенезе патологии эндометрия при привычном невынашивании беременности – эндометриопатия с дистрофией и атрофией эндометрия (с учетом М-эха менее 6 мм), со снижением внутриклеточных регенераторных реакций эпителия. Ультраструктурными эквивалентами снижения рецептивности эндометрия является редукция, или недовоспроизводство белоксинтезирующих ядерных и цитоплазматических органелл в эпителиоцитах, что лежит в основе несоответствия дифференцировки эпителия лютеиновой фазе цикла со снижением секреторной активности и «закрытым окном имплантации» [23].
В состав пелоидов входят фосфоросодержащие органические вещества, биологически активные коллоиды (сульфид железа, гидрат и оксид алюминия) в сочетании с сероводородом и другими компонентами, оказывающими выраженное целебное воздействие – комплексное влияние механических, химических и других биологически активных факторов [24, 25]. По-видимому, лечебный эффект пелоидов на атрофированный тонкий эндометрий у пациенток 4-й группы связан с индукцией клеточной регенерации, которая транзиторно имеет фенотип воспаления с увеличением числа плазмоцитов и их предшественников – В-лимфоцитов.
Заключение
При анализе результатов лечения при попарном сравнении 4 групп, обращает на себя внимание отсутствие достоверных отличий по всем проявлениям ХЭ у пациенток с нормальным эндометрием, пролеченных двумя различными схемами. Однако для тонкого эндометрия получены достоверные различия по показателю нарушений цикла – более успешные результаты при комплексной терапии (р=0,02). Сравнение результатов лечения с помощью двух схем выявило достоверность отличий по бесплодию у пациенток и с нормальным (сравнение групп 1 и 3, р=0,0002), и с тонким (сравнение групп 2 и 4, р=0,0006) эндометрием; однако улучшение показателей больше выражено у пациенток с нормальным эндометрием, в том числе по показателю нарушений цикла (р=0,0003).
При сравнении результатов стандартной схемы лечения и дополненной пелоидами установлено достоверное уменьшение суммы баллов УЗИ у пациенток с нормальной толщиной эндометрия, использовавших пелоиды (р=0,037). Однако у пациенток с тонким эндометрием значимых различий сумм баллов после медицинской реабилитации не выявлено (р=0,502).
В условиях обеих схем лечения исходно небольшой рост большинства микроорганизмов достоверно снижен во всех 4 группах. При этом как стандартная (в группах 1 и 3), так и комплексная (в группах 2 и 4) терапия не оказала влияния на рост грамположительных бактерий Staphylococcus aureus и Corinebacterium spp. Использование пелоидов в схеме лечения групп 2 и 4, в отличие от групп с витамино-минеральным и физиолечением без пелоидов, привело к достоверному уменьшению роста гемолитического стрептококка и протея.
Сравнительное исследование динамики экспрессии ИГХ-маркеров ХЭ у пациенток с нормальной толщиной эндометрия и тонким эндометрием продемонстрировало достоверное снижение экспрессии CD20 (В-лимфоциты, р=0,043) и CD138 (плазмоциты, р=0,029) у пациенток группы 2 (нормальный эндометрий) при лечении в сочетании с пелоидами. Однако у пациенток группы 4 с тонким эндометрием установлено достоверное повышение экспрессии маркеров CD20 (В-лимфоциты, р=0,041) и CD138 (плазмоциты, р=0,011). Эти данные отражают усиление экспрессии маркеров воспаления у пациенток с тонким эндометрием, несмотря на позитивную динамику клинических проявлений, а также результатов ультразвуковых и культуральных исследований. По-видимому, это может отражать индукцию регенерации тонкого эндометрия при ХЭ в динамике применения пелоидов озера Карачи. Индукция регенерации, как правило, имеет аналогичные «воспалительным» структурные и молекулярно-биологические особенности.



