Проблема преждевременных родов (ПР) в современном акушерстве продолжает оставаться актуальной и нерешенной [1–3]. Это обусловлено тем, что ПР остаются ведущей причиной неблагоприятных перинатальных исходов [4]. Несмотря на многочисленные научные и практические исследования в этой области, частота ПР не снижается, а в некоторых странах даже растет [5]. По современным представлениям одной из причин развития ПР инфекционного генеза являются ограниченные возможности иммунной системы беременной к своевременному распознаванию и уничтожению этиологического агента инфекции. Проникновение инфекционных факторов может стать пусковым механизмом развития системного воспалительного ответа (ССВО), при котором локальное повреждение тканей в зоне инокуляции инфекционных патогенных факторов вызывает совокупность системных реакций, одной из которых является дисфункция врожденного и приобретенного иммунного ответа [6, 7]. ССВО определяют как неспецифический системный ответ организма на инфекционные агенты и иммунодефициты. Признаком системного иммунного ответа является изменение соотношения цитокинов в периферической крови. Система цитокинов играет важную роль в течение всей беременности, регулируя процессы инвазии трофобласта, межклеточные взаимоотношения в эндометрии, воспалительные реакции [8]. Нарушение соотношения про и противовоспалительных цитокинов является главной особенностью патогенеза ССВО [9, 10]. Вместе с тем немаловажным в развитии воспалительного ответа имеет взаимосвязь микробиоценоза влагалища, локального и врожденного иммунитета, изучение которых поможет уточнить молекулярно-биологические аспекты патогенеза ПР, и позволит прогнозировать развитие патологических процессов с разработкой системы профилактических мероприятий для улучшения перинатальных исходов.
Цель исследования: разработка тест-системы для прогноза реализации ПР, основанной на профиле экспрессии генов в клетках соскоба из цервикального канала у беременных с угрожающими ПР.
Материал и методы исследования
Обследованы 125 женщин в возрасте от 18 до 40 лет с угрожающими ПР до развития регулярной родовой деятельности.
Критериями включения послужили: одноплодная беременность, угрожающие ПР на сроке гестации с 22 до 36 недель 6 дней, отсутствие регулярной родовой деятельности.
Критериями исключения были: тяжелая экстрагенитальная патология, истмико-цервикальная недостаточность, преждевременное излитие околоплодных вод, многоплодная беременность, пороки развития плода.
Группу 1 составили 46 беременных, родившие в сроках от 22 до 36 недель в течение 7 дней после проведения неинвазивного прогностического теста. Группу 2 – 79 случаев угрожающих ПР с последующим родоразрешением в доношенном сроке беременности.
Взятие биоматериала осуществлялось цитощеткой раздельно из цервикального канала и влагалища. Во избежание деградации мРНК материал помещают в пластиковую пробирку, содержащую 500 мкл среды для стабилизации РНК (лизирующий раствор из комплекта реагентов для выделения ПРОБА-НК (ООО «НПО ДНК-Технология», Россия)).
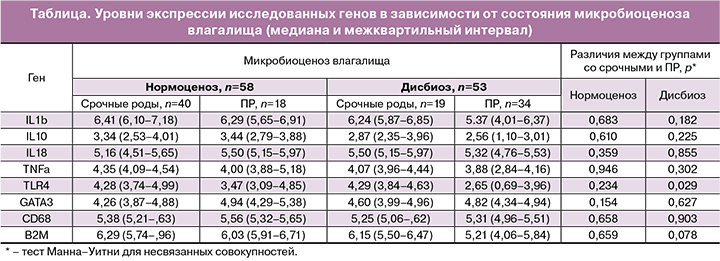
Всем пациенткам было проведено исследование структуры микробиоценоза влагалища методом фемофлор (ООО «НПО ДНК-Технология», Россия) и измерение уровней мРНК генов толл-подобных рецепторов (TLR4), CD68, фактора некроза опухоли (TNFα), GATA3, интерлейкина (IL) 1b, IL10, IL18, в клетках цервикального канала методом количественной полимеразной цепной реакции (ПЦР) в режиме реального времени со стадией обратной транскрипции (ОТ-ПЦР).
Выделение нуклеиновых кислот проводили с использованием комплекта реагентов ПРОБА-НК (ООО «НПО ДНК-Технология», Россия). Метод использует лизис клеток с последующей депротеинизацией и осаждением нуклеиновых кислот. Объем образцов после выделения составил 100 мкл.
Измерение уровней экспрессии проводилось по сравнению с 4 референсными генами B2M, TBP, GUSB, HPRT1 коммерческими реактивами (ООО «НПО ДНК-Технология», Россия) методом количественной ОТ-ПЦР согласно инструкции производителя. Праймеры и зонды для ПЦР были подобраны с учетом структуры генов таким образом, чтобы исключить отжиг на матрице геномной ДНК исследуемых и референсных генов. Это позволило не использовать дополнительный этап обработки нуклеиновых кислот ДНК-азой.
Реакцию ОТ ставили в объеме 40 мкл (для реакции брали 33 мкл образца РНК) в течение 30 минут при температуре 40°С с последующей инактивацией обратной транскриптазы при 95°С в течение 5 минут.
Реакции амплификации целевых и референсных генов ставили в двух повторах. Регистрация и учет результатов амплификации проводится с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия). Регистрация сигнала флуоресценции проводится по каналу FAM, осуществляется прибором автоматически во время амплификации. Для вычисления уровня экспрессии использовались значения пороговых циклов (Cp). Нормировка производилась методом сравнения пороговых циклов (метод ΔΔCq с нормировкой на референсные гены). В качестве меры центральной тенденции всех количественных показателей использовали медиану (Me), в качестве интервальной оценки – нижний (0,25) и верхний (0,75) квартили. Результаты представлены в виде Ме (0,25–0,75).
Анализ данных проводился с помощью программы SPSS Statistics 21.0 (IBM Inc. США). Определение достоверности различий для анализируемых групп выполняли по критерию Манна–Уитни. Расчет вероятности развития преждевременных родов проводился с использованием бинарной логистической регрессии методом обратной селекции. Оценка качества полученной модели проводилась с помощью ROC-анализа. Уровень порогового значения выбирали, исходя из требования максимальной суммарной чувствительности и специфичности.
Результаты исследования
Возраст обследованных женщин варьировал в пределах от 18 до 40 лет и составил в среднем 29,6±4,5 года; в группе 1 средний возраст составил 31,5±5,4, в группе 2 – 27,6±4,4 года. При изучении особенностей соматического и гинекологического анамнеза было выявлено, что среди пациенток группы 1 отмечалось достоверное увеличение частоты нарушения жирового обмена (n=6, 13,9%, OR=1,9 (3,2–22,2), p<0,05), варикозного расширения вен нижних конечностей (n=5, 10,9%, OR=3,9 (3,2–64,7), p<0,05), хронического пиелонефрита (n=6, 13,9%, OR=1,5 (1,5–4,3), p<0,05) и хронического цистита (n=8, 17,4%, OR=1,7 (2,6–5,1), p<0,05). Острый пиелонефрит был диагностирован в одном случае у беременной группы 1 (n=1, 2,2%, OR=5,4 (4,3–90,2), p<0,05).
Как следует из полученных данных, статистически значимыми клиническими факторами в развитии ПР являлись нарушение жирового обмена, варикозное расширение вен нижних конечностей и заболевания органов мочеполовой системы.
Среди гинекологических заболеваний в группе 1 было отмечено достоверное увеличение хронических воспалительных заболеваний органов малого таза (n=5, 10,9%, OR=1,7 (2,5–5,3), p<0,05), миомы матки (n=4, 8,6%, OR=2,36 (1,7–7,6), p<0,05). При анализе инфекционно-воспалительной заболеваемости в основной группе достоверно чаще встречались хроническая рецидивирующая герпетическая инфекция (n=2, 4,4%, OR=4,15 (1,7–21,7), p<0,05) и бактериальный вагиноз (n=7, 15,2%, OR=1,44 (1,3–6,5), p<0,05).
В анализе структуры неблагоприятных исходов беременности аборт (n=16, 34,8%, OR=2,6 (1,5–12,5), p<0,05) и самопроизвольный выкидыш в анамнезе (n=26, 56,5%), (OR=1,1 (1,3–4,7), p<0,05) статистически значимо чаще были у женщин, родивших преждевременно. Частота неразвивающейся беременности статистически не различалась среди пациенток всех групп.
Был проведен анализ акушерских и перинатальных исходов. Течение беременности в I триместре у пациенток группы 1 достоверно чаще осложнялось ранним токсикозом (n=2, 4,3%), (OR=4,61 (1,3–15,2), p<0,05) и ретрохориальной гематомой (по данным ультразвукового исследования) (n=5, 10,9%) (OR=2,2 (0,4–12,1), p<0,05).
Во II триместре у пациенток группы 1 чаще отмечалось формирование истмико-цервикальной недостаточности – в 15,2% случаев (n=7, OR=1,48 (1,4–4,9), p<0,05), потребовавшей проведения хирургической коррекции в 8,6% (OR=21,2 (7,8–57,8), p<0,05), и угрозы прерывания в 56,5% случаев (n=26, OR= 6,6 (1,8–23,7), p<0,05).
Из особенностей течения III триместра беременности следует отметить преобладание в группе 1 задержки роста плода и плацентарной недостаточности (n=4, 8,6%) (OR=4,40 (1,1–16,3), p<0,05).
Результаты изучения исхода родов для плода установили, что у детей группы 1 достоверно чаще диагностировались респираторный дистресс-синдром (n=21, 45,7%, OR=7,13 (2,3–22,1), p<0,05), врожденная пневмония (n=14, 30,4%, OR= 5,5 (1,9–15,4), p<0,05).
При анализе показателей биоценоза нижнего отдела репродуктивного тракта беременных методом ПЦР в режиме реального времени не было выявлено статистически значимых различий между группами.
При изучении профиля экспрессии исследуемых генов в клетках соскобов из цервикального канала только уровень экспрессии гена TLR4 статистически значимо различался между группами со своевременными родами и ПР. При стратификации пациенток по состоянию микробиоценоза влагалища (таблица) эта закономерность сохранялась, однако уровня статистической значимости эти различия достигали при дисбиотическом нарушении микрофлоры влагалища.
В ходе проведения многофакторного анализа была получена математическая модель предсказания ПР на основании уровня экспрессии генов TLR4 и IL10. Учитывая разнонаправленное изменение уровней отдельных мРНК в исследуемых группах, было проанализировано соотношение уровней мРНК этих генов. Важно отметить, что метод определения соотношения уровней экспрессии ключевых генов позволяет не осуществлять нормировку на референсные гены, что существенно упрощает исследование.
На основании полученных клинических данных с учетом угрожающих и произошедших ПР был применен дискриминантный анализ и построена математическая модель, позволяющая вычислить значение канонической линейной дискриминантной функции для каждого клинического образца.
Уравнение канонической линейной дискриминантной функции (КЛДФ) имело вид:
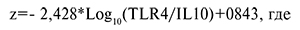
Z – КЛДФ; TLR4/IL10 – соотношение уровней экспрессии мРНК генов TLR4 и IL10;
Вероятность развития ПР рассчитывалась по формуле:

p – вероятность развития ПР; Z – КЛДФ (1).
Прогностическую ценность полученной модели оценивали с помощью ROC-анализа. Площадь под кривой составила 0,822 (0,702–0,942) (р=0,01). Уровень порогового значения выбирали исходя из требования максимальной суммарной чувствительности и специфичности. В точке 15% чувствительность модели составила 100%, специфичность 57%. При вероятности большей или равной 15% ПР развиваются в ближайшие 7 дней.
Заключение
В системе диспансеризации, существующей на сегодняшний день, нет убедительных методов предикции и ранней диагностики ПР, позволяющих осуществлять раннее выявление групп риска и проведение выбора оптимальной тактики ведения данной когорты пациенток.
К основным недостаткам прогнозирования осложнений беременности являются неспецифичность и трудоемкость методов. Опубликованные на сегодняшний день отечественные и зарубежные исследования, посвященные применению тест-систем локальной предикции ПР, позволяют диагностировать данное осложнение в ближайшие несколько дней либо часов. Кроме того, в данных исследованиях отмечают снижение чувствительности методов в зависимости от срока гестации, состояния биоценоза влагалища, подтекания околоплодных вод и др. [11–13]. В связи с вышеизложенным, существующие методы прогнозирования ПР не могут быть использованы у пациенток с начальными признаками угрозы прерывания беременности в связи с их низкой чувствительностью. Это существенно снижает возможность своевременного начала терапии, направленной на пролонгирование беременности. В настоящем исследовании была разработана тест-система для прогнозирования ПР в сроках беременности от 22 недель с чувствительностью и специфичностью 89 и 100% соответственно. Данная тест-система позволяет проводить оценку рисков при угрожающих ПР и прогнозировать их реализацию в ближайшие 7 дней, позволяя своевременно оказать полный комплекс лечебно-профилактических мероприятий у данной когорты пациенток и пролонгировать беременность на срок более 48 ч. В этот временной отрезок возможно проведение полного курса профилактики респираторного дистресс-синдрома плода, что позволит улучшить перинатальные исходы.



