Преэклампсия возникает в 4–10% всех беременностей и представляет собой мультисистемное заболевание, клинически проявляющееся развитием протеинурии и гипертензии после 20 недель беременности, которое в дальнейшем может привести к почечной и печеночной недостаточности, а также отеку легких [1, 2]. В этой связи преэклампсия считается одним из наиболее тяжелых осложнений беременности, приводящих к высокой материнской и перинатальной заболеваемости и смертности [3–5]. Точный патогенез преэклампсии, к сожалению, до конца не установлен. В последнее время ряд авторов подразделяет преэклампсию в зависимости от патогенетических механизмов развития на раннюю (развившуюся до 34 недель беременности) и позднюю (развившуюся после 34 недель беременности) [6–8].
Считается, что ведущую роль в развитии ранней преэклампсии играет нарушение процессов инвазии трофобласта и ремоделирования спиральных артерий [9]. В то же время развитие поздней преэклампсии в большей степени связывают с вторичными изменениями в материнском микроциркуляторном русле, в частности, вызванными длительно существующей артериальной гипертензией, сонным апноэ или отражающими материнскую генетическую предрасположенность [10]. Важным компонентом, регулирующим развитие сосудистой сети плаценты, является фактор роста эндотелия сосудов (VEGF – Vascular Endothelial Growth Factor), действующий через ряд специфических и неспецифических рецепторов. Именно благодаря связыванию VEGF с его специфическим рецептором 2-го типа (VEGFR-2) происходит активация процессов ангиогенеза в физиологических условиях – путем усиления пролиферации и роста эндотелиальных клеток [11]. Однако до настоящего времени недостаточно изучены особенности синтеза и взаимодействия факторов роста и их рецепторов в зависимости от времени дебюта преэклампсии.
Кроме того, последние годы в ряде исследований определенная роль в развитии преэклампсии отводится синдрому сонного апноэ. Сонное апноэ представляет собой повторяющиеся частичные или полные эпизоды обструкции верхних дыхательных путей во время сна. Обструкция приводит к снижению потока воздуха, гипоксемии и периодическим пробуждениям. Расстройства сна и сонное апноэ встречаются у беременных в 2–3 раза чаще, чем у небеременных. При этом чаще (у 14–28%) – в III триместре и, что особенно важно, у 75% женщин с преэклампсией, тогда как у небеременных того же возраста частота сонного апноэ не превышает 4–14% [12, 13].
Целью работы стало изучение особенностей течения родов и изменений плаценты при ранней и поздней преэклампсии у беременных с синдромом сонного апноэ.
Материал и методы исследования
Проведен клинико-морфологический анализ 36 наблюдений беременности, осложненной преэклампсией. 1-ю группу составили 18 пациенток с преэклампсией, развившейся до 34 недель беременности, 2-ю группу – 18 пациенток с преэклампсией, развившейся после 34 недель беременности.
Критерии включения: умеренная и тяжелая преэклампсия, соответствующая критериям МКБ-10, одноплодная беременность и согласие женщины на проведение исследования.
Критерии исключения: другие гипертензивные и метаболические осложнения беременности, генетические нарушения и пороки развития плода, инфекционная патология матери и/или плода, тяжелая соматическая патология матери и многоплодная беременность.
Всем женщинам, включенным в исследование, проводилось полисомнографическое исследование во II и III триместрах беременности для выявления сонного апноэ при помощи портативной полисомнографической системы EmblettaGold (Исландия). В настоящее время для оценки степени тяжести синдрома сонного апноэ используется индекс апноэ/гипопноэ (ИАГ), который рассчитывается путем количественной оценки эпизодов апноэ и гипопноэ за один час сна. Данный синдром диагностируется при ИАГ более 5. Одновременно для оценки состояния плода во время апноэ проводилось кардиотокографическое исследование при помощи фетального монитора MonicaAN24 (Великобритания).
При проведении морфологического исследования плацент была набрана группа контроля с физиологическим течением беременности у женщин без экстрагенитальной патологии. Макроскопическое изучение последов и взятие кусочков для гистологического исследования проводили в соответствии с рекомендациями [14]. Фрагменты ткани из центральной зоны плаценты фиксировали в 10% нейтральном формалине. Гистологическое исследование проводили на парафиновых срезах, окрашенных гематоксилином и эозином.
Иммуногистохимическое исследование проводили по стандартной методике с использованием готовых к употреблению кроличьих поликлональных антител к VEGF, VEGFR-2 (Flk-1) и полимерной системы детекции производства Spring Bioscience (США). Предварительную демаскировку антигена проводили путем кипячения образцов в растворе цитратного буфера с pH=6,0. Блокирование эндогенной пероксидазы осуществляли путем обработки срезов 0,3% раствора перекиси водорода в течение 15 мин. В качестве фонового красителя использовали гематоксилин. Количественную оценку экспрессии изученных маркеров проводили по уровню оптической плотности иммуногистохимической реакции в синцитиотрофобласте (СЦТ), эндотелиоцитах капилляров (ЭК) и мезенхиме (Мез) терминальных ворсин плаценты при помощи системы анализа изображения на базе микроскопа «Аxio Imager M1» с использованием программы «AxioVision» (Carl Zeiss).
Значимость различий определяли путем использования U-критерия Манна–Уитни для несвязанных совокупностей. Различия между сравниваемыми величинами считали значимым при р<0,05 (множественные значения) и р<0,01 (парные значения). Статистическую оценку количественных данных проводили с использованием программного пакета Statistica 6.0 (StatSoft Inc., США).
Результаты исследования
Средний возраст пациенток в группе с ранней и поздней преэклампсией составил 33,05±1,36 года и 33,67±1,18 года, а количество первородящих женщин – 10 и 9 человек соответственно и статистически значимо не отличались (р>0,05). Следует отметить, что в настоящем исследовании, как и по данным литературы [15], раннее развитие преэклампсии характеризовалось более тяжелым течением. Так, в 1-й группе в 61,1% (n=11) наблюдений была диагностирована тяжелая преэклампсия, а в 38,9% (n=7) преэклампсия умеренной степени, в то время как во 2-й группе диагноз «тяжелая преэклампсия» был поставлен в 11,1% (n=2) случаев, а «умеренная преэклампсия» – в 8,9% (n=16, р<0,05). Преэклампсия в предыдущих родах была диагностирована у 4 женщин в 1-й группе и у 1 во 2-й группе. В одном наблюдении в группе с ранней преэклампсией в предыдущих родах произошла антенатальная гибель плода. В группе женщин с ранней преэклампсией не было отмечено соматических заболеваний, тогда как в группе с поздней преэклампсией у 2 пациенток диагностировано варикозное расширение вен нижних конечностей.
Всем пациенткам в обеих группах проводилась терапия преэклампсии, согласно клиническим рекомендациям («Федеральные клинические рекомендации: гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия».), которая включала профилактику судорожной активности с использованием магния сульфата, профилактику респираторного дистресс-синдрома новорожденного при родоразрешении до 34 недель беременности, 2–3-компонентную гипотензивную терапию с использованием α2-адреномиметиков (метилдопа), блокаторов кальциевых каналов (нифедипин) и α-адреноблокаторов (метопролол).
Длительность пролонгирования беременности в группе с ранней преэклампсией составила от 4 до 48 ч и зависела от тяжести преэклампсии, эффективности проводимой антигипертензивной терапии и необходимости досрочного родоразрешения в интересах матери и плода. При этом во 2-й группе чаще наблюдалась умеренная преэклампсия и, с учетом эффективности проводимой антигипертензивной терапии, было возможно более длительное пролонгирование беременности (от нескольких дней до 2–3 недель).
Частота кесарева сечения в 1-й группе составила 100%, что было обусловлено необходимостью досрочного родоразрешения в связи с тяжестью преэклампсии и не готовностью родовых путей; во 2-й группе кесарево сечение было проведено в 70% (n=13) наблюдений (р<0,05).
Средний вес детей при рождении составил 1285,28±87,76 г в 1-й группе и 3083,56±163 г во 2-й. Задержка роста плода (ЗРП) диагностирована в 8 (44%) наблюдениях в 1-й группе и в 3 (16%) наблюдениях во 2-й. Выписка родильниц из стационара производилась на 8–10-е сутки в 1-й и на 4–6-е сутки во 2-й группе.
Основной задачей исследования стало изучение частоты развития и связи ранней и поздней преэклампсии с синдромом обструктивного сонного апноэ (ОСА). Согласно современным исследованиям [16], сонное апноэ усиливается во время беременности. Анатомические и физиологические изменения, возникающие во время беременности, влияют на дыхательную систему и создают условия для увеличения частоты ОСА во время беременности. Во время беременности появляются такие факторы риска ОСА, как высокий индекс массы тела (ИМТ) и снижение функционального остаточного объема легких. Все эти факторы могут приводить к появлению и утяжелению ОСА во время беременности, причем наиболее выраженные нарушения сна происходят в III триместре. В ряде исследований авторы связывают ОСА с такими акушерскими осложнениями, как преэклампсия, ЗРП и антенатальная гибель плода [17]. Примечательно, что ОСА само по себе считается независимым фактором риска развития преэклампсии и других осложнений беременности [18, 19].
Синдром ОСА значимо чаще развивался при поздней преэклампсии – у 16 (88,9%) беременных по сравнению с ранней преэклампсией – у 1 беременной (р<0,05). Среднее значение ИАГ у беременных с апноэ составило 0,44 в 1-й группе и 5,7 во 2-й группе (р<0,05). Максимальный показатель ИАГ в группе с поздней преэклампсией составил 8. Следует подчеркнуть, что в литературе мы не обнаружили данных о влиянии ОСА на развитие преэклампсии в зависимости от времени ее начала.
Средний ИМТ в 1-й группе составил 27,93±1,5, а во 2-й – 33±1,11. Ожирение диагностировано у 14 пациенток 2-й группы с ОСА и у 4 беременных из 1-й группы (у одной – с ОСА). Пациентки с ОСА имели более высокий ИМТ. У 3 детей, родившихся от матерей с ОСА, поставлен диагноз ЗРП, при этом беременность завершилась преждевременными оперативными родами, а в одном наблюдении – рождением ребенка с низкой массой тела. У 12 пациенток с сонным апноэ беременность завершилась своевременными оперативными родами и рождением детей с оценкой по шкале Апгар 6–9 баллов.
На основании полученных данных можно предположить, что преэклампсия, развившаяся после 34 недель беременности, видимо, связана с такими патогенетическими механизмами, как прерывистая ночная гипоксия при сонном апноэ, которая ведет к нарушению эндотелиальной функции, нарушениям в системе системного воспалительного ответа, оксидативному стрессу, а также конституционными особенностями материнского организма и может встречаться при различных экстрагенитальных заболеваниях. Как правило, она характеризуется более благоприятным течением, возможностью более длительного пролонгирования беременности и меньшей выраженностью клинических проявлений.
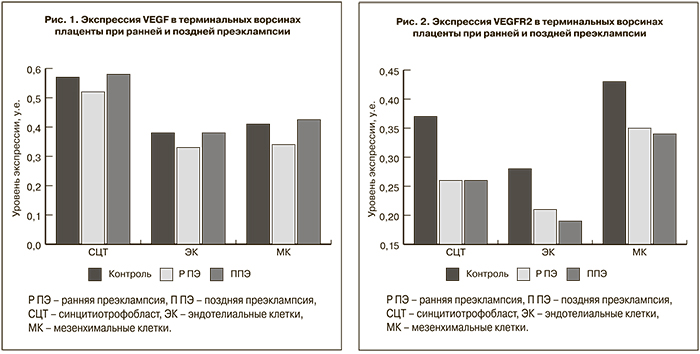
Вторым этапом данной работы было изучение особенностей экспрессии факторов ангиогенеза при ранней и поздней преэклампсии. При иммуногистохимическом анализе препаратов плаценты контрольной группы выявлена цитоплазматическая локализация VEGF во всех клеточных элементах терминальных ворсин. В контрольной группе максимальный уровень экспрессии VEGF отмечался в синцитиотрофобласте терминальных ворсин и значимо превышал показатели эндотелиальных и мезенхимальных клеток – на 52,6 и 41,5% соответственно (p<0,05) (рис. 1).
Более выраженная интенсивность реакции с VEGFR-2 зарегистрирована в МК (на 16,2 и 53,6% больше, чем в СЦТ и ЭК, p<0,05) (рис. 2).
В плацентах у женщин, страдавших ранней преэклампсией, установлены более низкие значения экспрессии VEGF и VEGFR-2, что может указывать на нарушения процесса инвазии трофлобласта. Последнее, в свою очередь, может приводить к нарушениям процесса плацентации, ЗРП и неблагоприятным исходам беременности. Наиболее выраженное и значимое снижение уровня экспрессии VEGF (на 17,1% по сравнению с контрольными показателями, p<0,05) наблюдается в МК, а VEGFR-2 – в СЦТ (на 29,7%, p<0,05). При этом синцитиально-эндотелиальный коэффициент экспрессии VEGF на 6,5% превышает контрольные значения, а для VEGFR-2, наоборот, на 6,1% ниже контрольного уровня (p>0,05).
В ранее проведенных исследованиях было установлено, что в условиях умеренной гипоксии отмечается стереотипная реакция повышения синтеза VEGF. В свою очередь связывание VEGF с его рецептором VEGFR-2 вызывает гиперкапилляризацию зрелых промежуточных и терминальных ворсин по классическому механизму обратной связи, что сопровождается выраженной экспрессией VEGF и VEGFR-2 в эндотелиоцитах сосудов ворсин [20, 21]. Вместе с тем при морфометрическом анализе ткани плаценты нами установлено уменьшение количества и площади поперечного сечения капилляров в терминальных ворсинах хориона в наблюдениях умеренной и тяжелой преэклампсии [22].
Согласно данным литературы, ранняя преэклампсия характеризуется более высокой концентрацией в крови растворимой формы рецептора VEGF первого типа (sVEGFR-1, sFlt-1) [23] и более низкой концентрацией плацентарного фактора роста (PlGF) [24].
В наблюдениях поздней преэклампсии выявленные нами иммуногистохимические показатели экспрессии VEGF в эндотелиальных клетках капилляров терминальных ворсин не отличались от значений контрольной группы, а в СЦТ и МК терминальных ворсин незначимо их превышали (на 1,7 и 2,4% соответственно, p>0,05). Одновременно с этим отмечается снижение уровня экспрессии VEGFR-2, причем более выраженное по сравнению с наблюдениями ранней преэклампсии. Так, интенсивность реакции VEGFR-2 в ЭК меньше контрольного уровня на 32,1% (p<0,05), а в МК – на 20,9% (p<0,05). При этом значения синцитиально-эндотелиального коэффициента экспрессии VEGF незначимо превышают контрольные показатели, но ниже, чем у пациенток с ранней преэклампсией. Соответствующий коэффициент экспрессии VEGFR-2 больше по сравнению с группами контроля и ранней преэклампсией. Исходя из этого, можно сделать вывод, что поздняя преэклампсия, видимо, не связана с нарушением механизмов инвазии и плацентации, что согласуется с данными ряда авторов о том, что ранняя и поздняя форма преэклампсии имеют различные причины развития [15, 25]. Вероятнее всего, преэклампсия, развивающаяся до 34 недель беременности, как раз и связана с недостаточной инвазией трофобласта. Формирование такой ранней преэклампсии обусловлено нарушениями ремоделирования маточно-плацентарных сосудов и характеризуется высокими значениями общего сосудистого сопротивления у беременной. При этом наблюдается более тяжелое течение заболевания, единственно эффективным методом лечения которого является досрочное родоразрешение.
Заключение
Таким образом, деление преэклампсии не только по степени тяжести (умеренная и тяжелая), но и по времени диагностики (ранняя до 34 недель и поздняя после 34 недель беременности) является обоснованным в плане различных звеньев патогенеза, а также возможности лечебных воздействий. В данном исследовании было подтверждены различия ранней и поздней преэклампсии как в клиническом, так и в патогенетическом аспектах. Так, ранняя преэклампсия достоверно отличается от поздней тяжестью течения, лимитированием по времени пролонгирования беременности.
В результате проведенного исследования нами установлено снижение уровня экспрессии VEGF и его рецептора в терминальных ворсинах плаценты, выраженное в большей степени в наблюдениях с ранней преэклампсией, что свидетельствует о роли VEGF в развитии преэклампсии до 34 недель беременности. Выявленные же изменения иммуногистохимического профиля терминальных ворсин свидетельствуют о повреждении плаценты и соответственно лежат в основе нарушений внутриутробного развития плода. Вместе с тем наблюдающиеся различия иммуногистохимического профиля ворсин при ранней и поздней преэклампсии отражают, видимо, различные звенья их патогенеза.
На основании проведенных исследований выявлена связь между развитием поздней преэклампсии и синдромом сонного апноэ. Можно предполагать, что в патогенезе преэклампсии, развившейся после 34 недель, определенную роль играет прерывистая ночная гипоксия при сонном апноэ, ведущая к эндотелиальной дисфункции, системному воспалительному ответу, оксидативному стрессу. Вместе с тем, несомненно, требуется дальнейшее изучение возможных механизмов влияния сонного апноэ на развитие поздней преэклампсии и разработка патогенетических методов лечения.



