Хронический эндометрит (ХЭ) подразумевает продолжающийся, непрерывный патологический воспалительный процесс эндометрия, природа которого лежит в изменении количества воспалительных клеток, присутствующих в ткани [1].
Широкое распространение эмпирических методов лечения, направленных на улучшение восприимчивости эндометрия, свидетельствует о проблемах, с которыми сталкиваются клиницисты, стремясь помочь пациенткам с ХЭ. Диапазон эмпирических методик достаточно широк и в большинстве случаев основан на двух постулатах. Первый – что увеличение маточного кровотока улучшает функцию эндометрия и, следовательно, его рецептивность. Второй – что ХЭ является следствием измененной реакции иммунной системы женщины [2].
В качестве адъювантного препарата предлагалось использовать аспирин в связи с его вазодилатирующим и антикоагулянтным действиями, которые достигаются благодаря необратимому ингибированию тромбоцитарной циклооксигеназы, снижению агрегации тромбоцитов и тромбоксана и блоку опосредованной ими вазоконстрикции. Однако проведенные рандомизированные контролируемые исследования не подтвердили его эффективность [3, 4].
Исследования, посвященные применению различных иммуномодуляторов и кортикостероидов для улучшения структуры и функции эндометрия, достаточно популярны в научных кругах. Биологическая рациональность назначения глюкокортикоидов для улучшения имплантации связана с их иммуномодулирующими свойствами и, в частности, предполагаемой ролью в модуляции популяций маточных естественных киллеров [5]. Было показано, что их количество значительно повышено в ткани эндометрия у пациенток с неудачными попытками экстракорпорального оплодотворения (ЭКО) и при хроническом воспалении [6–8].
Экспрессия глюкокортикоидных рецепторов (ГР) в эндометрии и белка ГР в стромальных, эндотелиальных и NK-клетках эндометрия указывает на то, что введение глюкокортикоидов может непосредственно модулировать показатели рецептивности эндометрия. Недавно было показано, что повышенные уровни маточных NK-клеток в строме связаны с неадекватным биосинтезом кортизола децидуализирующимися клетками, что нарушает процесс имплантации [9]. В метаанализе, включавшем рандомизированные контролируемые исследования, в которых сравнивалась эффективность дополнительного системного введения глюкокортикоидов в периимплантационном периоде с таковой плацебо у женщин в программах ЭКО, было выявлено незначительное повышение частоты наступления беременности при лечении глюкокортикоидами (ОШ 1,50; 95% ДИ 1,05–2,13) [10].
Несмотря на усилия, направленные на понимание молекулярной основы имплантации эмбриона, этот процесс остается биологической загадкой. После оплодотворения образующаяся бластоциста должна сигнализировать о своем присутствии матери, прикрепиться к просветному эпителию эндометрия и внедриться в децидуализированную строму.
Общепризнано, что для достижения успешной беременности необходимы три фактора: компетентный эуплоидный эмбрион, восприимчивый эндометрий и успешный диалог между ними [11].
Цитокины эндометрия оказывают паракринное влияние не только на собственную ткань, но и на эмбриональные структуры, а также действуют в синергии с аутокринными факторами роста и цитокинами, продуцируемыми самим эмбрионом [12]. Дисбаланс в экспрессии данных факторов препятствует нормальному взаимодействию между клетками и нарушает способность постимплантационного развития эмбриона [13]. Восстановление состава и баланса иммунокомпетентных клеток в эндометрии позволяет нормализовать паракринные и аутокринные механизмы клеточного взаимодействия и повысить эффективность терапии [13].
В настоящее время стандартом терапии ХЭ является проведение антибактериального лечения, включающего комбинацию доксициклина с метронидазолом в течение 14 дней. Вторым этапом терапии разными авторами предложено использовать гормональные средства, иммуномодуляторы, физиотерапию. По данным McQueen D.B., после эффективного лечения ХЭ отношение частоты родов к наступлению беременности достигает 56%, а показатель последующего ожидаемого показателя рождаемости достигает 74% [14].
Целью нашего исследования явилось изучение влияния экзогенной цитокинотерапии на процессы ангиогенеза и восстановление репродуктивной функции у пациенток с ХЭ.
Материалы и методы
Для достижения поставленной цели на базе консультативно-диагностического отделения родильного дома при ГКБ №40 Департамента здравоохранения города Москвы в период с 2018 по 2020 гг. было проведено когортное проспективное исследование, включавшее 83 пациентки с ХЭ и бесплодием [1].
Критериями включения были возраст от 25 до 40 лет, диагностированный ХЭ и ассоциированное с ним бесплодие, а также отсутствие значимой соматической и аутоиммунной патологии. Критериями исключения были наличие других причин бесплодия (эндокринных, иммунологических, анатомических, инфекционных), наличие миомы матки, аденомиоза, пороков развития матки, инфекций, передающихся половым путем, и внутриматочных вмешательств в течение предыдущих 3 месяцев [1].
Всем пациенткам в течение 14 дней был проведен стандартный курс антибиотикотерапии с применением доксициклина 100 мг 2 раза в сутки и метронидазола 500 мг 2 раза в сутки. Далее с лечебной целью использовался иммуномодулирующий препарат «Суперлимф» 25 ЕД в свечах, вводимых по 1 свече во влагалище на ночь.
По длительности терапии пациентки были разделены на две подгруппы. В первой подгруппе (n=43) экзогенная цитокинотерапия проводилась в течение 20 дней, во второй подгруппе (n=40) – 40 дней. Всем женщинам до включения в исследование и после окончания терапии проводилась аспирационная биопсия эндометрия на 20–24-й день цикла с использованием стерильного зонда Pipelle de Cornier.
Препарат «Суперлимф» представляет собой комплекс природных противомикробных пептидов и цитокинов (фактор, угнетающий миграцию макрофагов, интерлейкин-1, интерлейкин-6, фактор некроза опухоли, трансформирующий фактор роста). Он оказывает иммуномодулирующее, противовирусное и противомикробное действие и стимулирует функциональную активность клеток фагоцитарного ряда.
Возраст пациенток первой подгруппы был 33,5 (2,7) года, во второй подгруппе – 34,2 (1,6) года. Значимых соматических и гинекологических заболеваний выявлено не было. В структуре гинекологической патологии преобладали эктопия шейки матки (32,5% и 27,5%) и кандидозный вагинит (48,8% и 45%). Внутриматочные вмешательства отмечены у 17/43 (39,5%) женщин в первой и у 17/40 (42,5%) во второй подгруппе. Длительность бесплодия составляла от 1,5 до 9 лет, в среднем 3 (0,7) года. Первичное бесплодие было у 4/43 (9,3%) и 3/40 (7,5%) пациенток первой и второй подгруппы, а вторичное – у 39/43 (90,7%) и 37/40 (92,5%) соответственно. В программах ЭКО ранее принимали участие 8 (20,5%) и 5 (13,5%) женщин соответственно подгруппам.
В подгруппах основной группы физиологические роды имели 17/39 (43,6%) и 14/37 (37,8%) женщин соответственно. Медицинский аборт до 12 недель проводился 6/39 (15,4%) и 7/37 (18,9%) женщинам соответственно подгруппам. Самопроизвольный выкидыш в анамнезе отмечен у 2/39 (5,1%) и 3/37 (8,1%) женщин.
У всех пациенток с первичным бесплодием отмечены внутриматочные вмешательства (полип эндометрия, гиперпластический процесс эндометрия).
Гистологическое и иммуногистохимическое (ИГХ) исследования
Проводились на базе отделения патоморфологии ГБУЗ ГКБ №40 Департамента здравоохранения города Москвы. Ткань эндометрия фиксировали в 10% растворе нейтрального забуференного формалина, далее проведены его спиртовая дегидратация, заливка в парафиновые блоки и приготовление гистологических срезов толщиной 3 мкм. После нанесения первичных антител проводилась стандартная инкубация с последующей промывкой фосфатно-солевым буфером и обработкой 3,3-диаминобензидин тетрахлоридом. При ИГХ в качестве первичных антител применяли мышиные моноклональные антитела к CD34 (клон QBEnd/10, Cell Marque, 1:100), к сосудисто-эндотелиальному фактору роста (VEGF-А, клон C12, Cloud-Clone Corp., 1:100) и кроличьи поликлональные антитела к рецепторам 1 и 2 сосудисто-эндотелиального фактора роста (VEGFR-1 и VEGFR-2, GeneTex, 1:100). Интенсивность ИГХ-реакции мембранного окрашивания для сосудисто-эндотелиального фактора роста и его рецепторов рассчитывалась по среднему арифметическому значению позитивно окрашенных клеток в 10 полях зрения при увеличении 200×.
Статистический анализ
Статистическая обработка результатов проводилась с использованием программного обеспечения Microsoft Excel 2016 и Statistica 6.1. Для описания количественных данных, имеющих нормальное распределение, использовались среднее арифметическое (М) и стандартное отклонение (SD). Корреляционный анализ производился методом Спирмена. Величина уровня значимости р=0,05 принята за критическую при интерпретации результатов статистического анализа.
Результаты
В нашем исследовании до и после терапии была оценена интенсивность процессов ангиогенеза на основании изучения VEGF-A, VEGFR-1 и -2 и CD34. С этой целью случайным способом были отобраны по 15 образцов из первой и второй подгрупп основной группы. Для сравнения было взято 10 образцов неизмененного эндометрия стадии секреции, полученного от здоровых пациенток репродуктивного возраста.
Результаты исследования показали, что в эндометрии при хроническом воспалении экспрессия VEGF-А в 1,7 раза превышает показатели нормы (р<0,05). При этом выявлено снижение как интенсивности реакции, так и количества позитивно-окрашенных клеток, экспрессирующих рецепторы VEGFR-1 (в 2 раза, р=0,047) и VEGFR-2 (в 1,5 раза, р<0,05). Плотность распределения сосудистой сети и количество позитивно окрашенных клеток к CD34 было в 2,3 раза ниже, чем в неизмененной ткани (р<0,05).
Через 20 и 40 дней экзогенной цитокинотерапии были выявлены качественные и количественные изменения в экспрессии изучаемых факторов. Интенсивность реакции и количество позитивно окрашенных клеток к VEGF-А через 20 дней терапии снизилась в 1,2 раза. В подгруппе после 40 дней лечения экспрессия VEGF-A качественно и количественно снизилась в 1,4 раза и достигла показателей нормы. Экспрессия рецепторов к VEGF на фоне ХЭ была значительно снижена. После проведения курса терапии в первой подгруппе (20 дней лечения) суммарная экспрессия рецепторов VEGFR-1 и -2 возросла незначительно (в 1,3 и в 1,1 раза соответственно) (р>0,05). В подгруппе с терапией в течение 40 дней уровень экспрессии рецепторов увеличился в среднем в 1,4 раза и достиг показателей контрольной группы (рисунок).
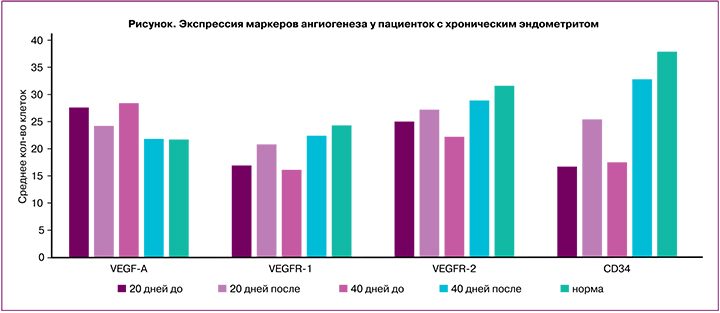
CD34 является маркером недифференцированных эндотелиоцитов, то есть отражает процесс формирования новых сосудов. Мембранная экспрессия CD34 позволяет производить подсчет плотности микрососудов в ткани. В норме увеличение экспрессии CD34 в базальном слое и строме эндометрия отмечается во второй фазе менструального цикла.
На фоне ХЭ было выявлено снижение процессов неоваскуляризации. Среднее количество клеток, экспрессирующих антиген CD34, было снижено в среднем в 2,3 раза. После окончания курса цитокинотерапии у пациенток первой и второй подгрупп отмечено увеличение количества положительно окрашенных клеток с антигеном CD34 в 1,6 и 1,9 раза соответственно.
ХЭ развивается в связи с длительной персистенцией повреждающего фактора, который приводит к дисбалансу клеток иммунной системы, поддерживающей вялотекущее воспаление с преобладанием процессов склерозирования над апоптозом. Порочный круг замыкается недостаточным ростом железистого эпителия в связи со снижением в нем экспрессии рецепторов к эстрогенам, нарушением темпов образования новой сосудистой сети и пролиферативной активности клеток.
Процессы ангиогенеза были нарушены во всех образцах ткани и проявлялись снижением экспрессии рецепторов сосудисто-эндотелиального фактора роста на фоне значимого увеличения концентрации VEGF, что отражает степень выраженности тканевой гипоксии.
После проведения курса терапии было выявлено улучшение процессов ангиогенеза в ткани, отражающееся в повышении плотности распределения трансмембранного белка CD34, который является маркером образования новых сосудов. Проведенный корреляционный анализ связей между количественной экспрессией VEGF-A, VEGFR-1, VEGFR-2 и CD34 установил, что между VEGF-A и CD34 в ткани эндометрия при хроническом воспалении имеется прямая средней силы корреляционная связь (r=0,52; р<0,05). Взаимосвязи между другими исследованными маркерами до лечения отсутствовали.
Через 20 дней терапии были выявлены средней силы прямые связи между количественными показателями уровня экспрессии VEGF-A и VEGFR-2 (r=0,52; р<0,05) и CD34 (r=0,73; р<0,05), а через 40 дней терапии – средней силы корреляций между VEGF-A и VEGFR-2 (r=0,88; р<0,05) и CD34 (r=0,76; р<0,05).
Полученные результаты свидетельствуют о том, что после проведенной терапии на фоне увеличенной экспрессии рецепторов к сосудисто-эндотелиальному фактору роста возрастает плотность микрососудов, оцененная по экспрессии CD34.
Основным показателем эффективности терапии пациенток с ХЭ является восстановление их репродуктивной функции и наступление беременности. В наше исследование были включены 83 пациентки репродуктивного возраста со средней продолжительностью бесплодия около 3 лет. После окончания курсов экзогенной цитокинотерапии в течение 1 года проводился анализ репродуктивных исходов. В таблице 1 представлены данные о частоте наступления беременности у пациенток основной группы.
Суммарная частота наступивших беременностей составила 43/83 (50,6%). После 40 дней цитокинотерапии отмечено большее число беременностей, но разница с первой подгруппой статистически не значима (р=0,36).
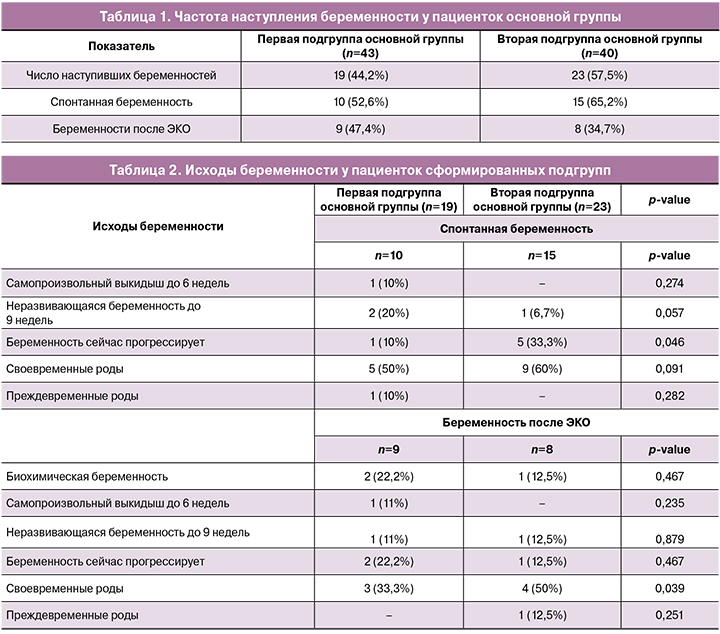
В обеих подгруппах преобладало спонтанное наступление беременности, у 11/25 (44%) в течение первых 3 месяцев после окончания лечения, у 6/25 (24%) – через 6–8 месяцев и у 8/25 (32%) – через 10–11 месяцев. Вспомогательные репродуктивные технологии проводились со следующего цикла после окончания лечения. После первого цикла ЭКО беременность наступила у 2/17 (11,8%) пациенток, у 5/17 (29,4%) во 2-м цикле и у 10/17 (58,8%) в результате 3 и более циклов, предпринятых в течение года.
В таблице 2 представлены исходы наступивших беременностей.
При сравнении между подгруппами было выявлено, что в случае спонтанного наступления беременности частота своевременных родов была практически идентичной в обеих подгруппах, достигнув 5/10 (50%) и 9/15 (60%) соответственно.
При спонтанном зачатии течение гестационного процесса осложнялось невынашиванием беременности у 4/10 (40%) пациенток в первой подгруппе и у 1/15 (6,7%) – во второй подгруппе (р=0,027).
При наступлении беременности после проведения цикла ВРТ получены аналогичные тенденции. Суммарная частота невынашивания беременности у пациенток первой подгруппы составила 4/9 (44%), а во второй подгруппе – 3/8 (38%) (р>0,05). В настоящее время беременность прогрессирует у 9 пациенток: у троих в сроке 28–30 недель, у шестерых – в сроке 34–36 недель.
Расчет частоты наступления беременностей по отношению к родам составил в первой подгруппе 47,4%, а с поправкой на прогрессирующие в настоящее время беременности – 63,2%. Во второй подгруппе показатели оказались статистически значимыми, составив 60,9% с учетом свершившихся родов и 86,9% с учетом ожидаемых в ближайшее время родов (р=0,03).
В таблице 3 представлена специфика течения беременности и родов у пациенток основной группы.
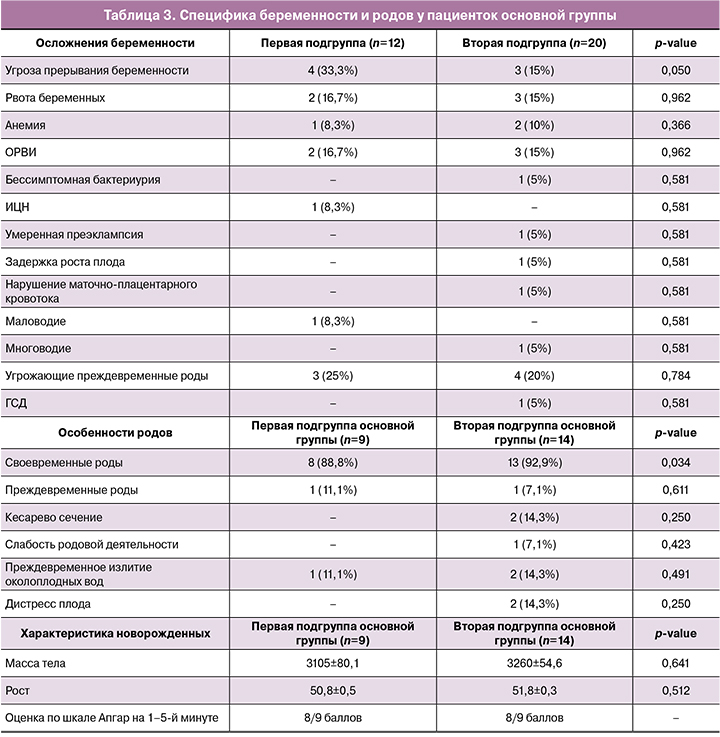
При сравнении между подгруппами значимых различий по характеру течения беременности выявлено не было, за исключением угрозы прерывания беременности, которая чаще диагностировалась в первой подгруппе. Все новорожденные были рождены живыми, со средней оценкой по шкале Апгар 8/9 баллов.
В настоящее время из 41 небеременной пациентки продолжают участвовать в программах ВРТ только 6 (14,6%), 21 (51,2%) пересмотрели свои репродуктивные планы и взяли паузу, а 14 (34%) выбыли из исследования в связи с другими обстоятельствами (расторжение брака, переезд, невозможность связаться с пациенткой).
Обсуждение
Сложные и не до конца изученные молекулярные механизмы регуляции функции эндометрия и ангиогенеза затрудняют разработку универсального метода их восстановления. В настоящее время это направление остается в стадии разработки. Известно, что стимулятором неоангиогенеза в эндометрии является сосудисто-эндотелиальный фактор роста, действующий через свои тканевые тирозинкиназные рецепторы VEGFR-1 (flt-1) и -2 (flk-1/KDR), из которых VEGFR-2 является основным медиатором эффектов VEGF. Недостаточное их количество приводит к неполноценности образования сосудистой сети и нарушению процессов, необходимых для нормальной имплантации. Активация VEGFR-2 приводит к аутофосфорилированию и последующей передаче сигналов и, таким образом, опосредует митогенные, ангиогенные, антиапоптотические и усиливающие сосудистую проницаемость эффекты VEGF [15–17].
По данным опубликованных исследований, на фоне хронического воспаления происходит существенное увеличение экспрессии VEGF [17–19]. Это объясняется стимулирующим эффектом гипоксии. Однако измененный эпителий не в состоянии экспрессировать в достаточном количестве рецепторы к сосудисто-эндотелиальному фактору роста, что не позволяет ему реализовать свои функции в полной мере [19–21].
Результаты нашего исследования показали, что при ХЭ экспрессия VEGF-А в эндометрии в 1,7 раза превышает показатели нормы, в то же время снижается количество клеток с рецепторами VEGFR-1 (в 2 раза) и VEGFR-2 (в 1,5 раза). Плотность распределения сосудистой сети и количество позитивно окрашенных клеток к CD34 также значимо снижены. Результаты свидетельствуют о рассогласовании в системе пара- и аутокринной регуляции, приводящей к нарушению реализации запрограммированных процессов васкуляризации ткани.
После окончания лечения с применением цитокинотерапии через 20 и 40 дней были выявлены изменения. Интенсивность реакции и количество позитивно окрашенных клеток к VEGF-А в первой подгруппе (через 20 дней) снизились в среднем в 1,2 раза. Во второй подгруппе (после 40 дней терапии) количество положительно окрашенных клеток снизилось в 1,4 раза и приблизилось к показателям нормы.
Экспрессия рецепторов к VEGF на фоне ХЭ была значительно снижена. После проведения курса терапии через 20 дней экспрессия рецепторов VEGFR-1 возросла 1,3 раза, а VEGFR-2 — изменилась незначительно, а ведь именно VEGFR-2 считается основным рецептором, позволяющим запускать VEGF-зависимый путь ангиогенеза. В подгруппе с терапией в течение 40 дней уровень экспрессии VEGFR-2 увеличился в 1,4 раза и достигал показателей контрольной группы. Данные изменения нашли отражение и в плотности распределения сосудистой сети, определяемой по количеству позитивно окрашенных CD34. На фоне хронического эндометрита было выявлено снижение процессов неоваскуляризации, среднее количество клеток, экспрессирующих данный антиген, было снижено в 2,3 раза. В ткани эндометрия у пациенток после 20 и 40 дней терапии количество клеток с антигеном CD34 возросло в 1,6 и 1,9 раза соответственно, то есть плотность сосудистой сети значимо увеличилась.
Улучшение показателей васкуляризации ткани позволило повысить репродуктивные показатели. В первой подгруппе отношение частоты наступления беременности к родам оставило 47,4%, а с учетом прогрессирующих в настоящее время беременностей – 63,2%. Во второй подгруппе показатели составили 60,9% с учетом свершившихся родов и 86,9% – с учетом ожидаемых в ближайшее время родов.
По данным McQueen D.B., после лечения ХЭ с применением монотерапии антибиотиками отношение частоты родов к наступлению беременности составляет 56% [14]. По результатам нашего исследования, за счет расширения терапевтических вмешательств и дополнения антибактериальной терапии препаратами с иммуномодулирующим действием отношение частоты родов к наступившим беременностям в среднем достигло 75%.
Заключение
Проведенное исследование демонстрирует возможность и эффективность применения комплексной терапии пациенток с ХЭ с применением на первом этапе антибактериальных средств, а на втором этапе – экзогенной цитокинотерапии. Восстановление состава и баланса иммунокомпетентных клеток в эндометрии позволяет нормализовать паракринные и аутокринные механизмы клеточного взаимодействия и повысить эффективность терапии.



