Преобладание в структуре воспалительных заболеваний урогенитального тракта негонококковых поражений является фактом, с которым соглашаются практически все специалисты [1–6]. Статистические данные Centers for Disease Control and Prevention USA (CDC) свидетельствуют, что удельный вес хламидийной инфекции среди инфекций, передающихся половым путем (ИППП), составляет 30–50%, при этом хламидии выявляются у каждой третьей пациентки с воспалительными заболеваниями органов малого таза. В мире ежегодно регистрируется более 90 млн больных урогенитальным хламидиозом [7, 8]. В 70% случаев хламидии сочетаются с гонококками, гарднереллами, микоплазмами, вирусами, а также с условно-патогенной флорой половых путей [2, 8–10]. Частота микоплазменной инфекции составляет 20–40%, урогенитального трихомониаза 15–27%, бактериального вагиноза 30–60% при различных патологических состояниях [2, 8, 10–12]. Этиологическими агентами бактериального вагиноза наиболее часто являются микроаэрофильные микроорганизмы – Gardnerella vaginalis, Mobiluncus species, Peptostreptococcus species, а также грамотрицательные бактерии (Prevotella spp., Bacteroides spp. и Fusobacterium spp.). При этом, по данным М.Р. Рахматуллиной, G. vaginalis и U. urealyticum одномоментно выявляются у 53,8% [10]. Применение молекулярно-биологических методов исследования показало, что одним из этиологических факторов бактериального вагиноза является Atopobium vaginae [5, 10, 13–15]. Значительная роль в развитии инфекционных поражений влагалища и вульвы принадлежит грибам рода Candida. Вульвовагиниты кандидозной (ВВК) этиологии составляют 10–45% инфекционных поражений вульвы и влагалища [1, 7, 16]. При этом преобладают полимикробные ассоциации, где микроорганизмы взаимодействуют по принципу симбиоза. Одной из особенностей метаморфоза инфекционно-воспалительных заболеваний является склонность к торпидному течению, что в первую очередь сопряжено с низкой реактивностью макроорганизма [3, 4, 17, 18]. Однако неэффективность проводимой терапии часто связана как с поздним обращением за медицинской помощью, так и низкой комплаентностью ряда препаратов, отсутствием приверженности пациентов к лечению. При изобилии лекарственных препаратов безопасность и эффективность многих из них с точки зрения доказательной медицины остается весьма сомнительной [8]. На сегодняшний день препаратами выбора для лечения хламидийной и микоплазменной инфекции являются препараты доксициклина моногидрат, джозамицин, азитромицин. Азитромицин – единственный макролидный антибиотик, включенный в рекомендуемые схемы лечения урогенитальной хламидийной инфекции ведущими мировыми организациями, имеет высочайший уровень убедительности доказательств [8]. Согласно современным руководствам препаратом выбора для лечения урогенитального трихомониаза являются препараты группы 5-нитроимидазола [9, 19]. На основе ядра имидазола созданы препараты с улучшенными фармакокинетическими параметрами (секнидазол, орнидазол и др.). При этом секнидазол является более предпочтительным ввиду длительного сохранения в крови в активных концентрациях, а период полураспада составляет 19 ч (тинидазол – 12 ч, орнидазол – 14 ч). Согласно современным отечественным и зарубежным рекомендациям, терапия бактериального вагиноза может проводиться препаратами группы 5-нитроимидазолов и клиндамицином. Исследованиями последних лет было продемонстрировано, что A. vaginae часто проявляет устойчивость к метронидазолу, при этом демонстрирует убедительную чувствительность к клиндамицину, азитромицину, рифампицину и пенициллину [11–13, 19]. Однако требования ВОЗ не рекомендуют последние два препарата для лечения ИППП. Из широкого спектра антимикотиков, применяемых для лечения ВВК, хорошо зарекомендовали себя препараты класса триазольных соединений и содержащие в своем составе флуконазол. При первичном эпизоде флуконазол применяется однократно в дозе 150 мг [16]. Препарат сафоцид является в своем роде уникальным, так как содержит в одном блистере секнидазол 2,0 г, азитромицин 1,0 г, флуконазол 150 мг, что позволяет воздействовать на все этиологические агенты сразу [3,10]. Одним из лекарственных препаратов, доказавших свою эффективность в терапии различных инфекционных заболеваний урогенитальной системы, является гексикон. Вагинальные суппозитории гексикон – антисептический препарат для локального применения, его активное вещество – хлоргексидина биглюконат. Кроме того, основу препарата составляют полиэтиленоксиды с различной степенью полимеризации, матричная структура которых способствует активной адсорбции экссудата, быстрому проникновению в ткани действующего вещества и подавлению роста микроорганизмов в очаге воспаления.
Цель исследования: изучение клинико-микробиологической эффективности и обоснованности комплексного подхода к терапии воспалительных заболеваний урогенитального тракта негонококковой этиологии у женщин репродуктивного возраста с использованием препаратов сафоцид и гексикон.
Материал и методы исследования
Для решения поставленных задач за период с 2010 по 2012 г. было проведено открытое, краткосрочное, рандомизированное, клинико-микробиологическое исследование 50 женщин репродуктивного возраста. Средний возраст составил 27,3±0,3 года. Случайным методом пациентки были разделены на две группы в зависимости от выбранной терапии. 1-я группа – 20 пациенток, получали базисную терапию, включавшую азитромицин 1 г однократно, метронидазол 500 мг 2 раза в сутки в течение недели, флуконазол 150 мг однократно. 2-я группа – 30 пациенток, которым проводили терапию препаратом сафоцид однократно и гексикон по 1 суппозитории интравагинально 2 раза в сутки в течение 5 дней. Контрольную группу составили 30 здоровых женщин, отобранных при профилактических осмотрах.
Материалом для выявления возбудителей служили соскобы из уретры и цервикального канала. План исследования соответствовал положениям Хельсинской декларации ВМА последнего пересмотра (Вашингтон, октябрь 2002 г.). Критерии включения: наличие клинической картины поражения нижнего отдела урогенитального тракта, длительность заболевания от 2 дней до 1 месяца (по анамнестическим данным), выявление смешанной инфекции, согласие пациенток на участие в исследовании. Критерии исключения: тяжелая соматическая патология, наличие ВИЧ, паппиломавирусной, герпетической и цитомегаловирусной инфекции, беременность, лактация, несогласие пациенток на участие в исследовании.
Лабораторные методы исследования включали: микроскопическое исследование отделяемого уретры, боковых и заднего сводов влагалища, цервикального канала и прямой кишки; идентификацию N. gonorrhoeae, T. vaginalis, условно-патогенных и непатогенных (Lactobacillus spp.) микроорганизмов; исследование методом ПЦР для идентификации Ch. trachomatis и M. genitalium; A. vaginae, G. vaginalis методом ПЦР в режиме реального времени. Диагноз бактериального вагиноза устанавливался в соответствии со следующими критериями: жалобы на вагинальные выделения, дискомфорт в области половых органов; наличие гомогенных вагинальных выделений, адгезированных на стенках влагалища с характерным «рыбным» запахом; обнаружение «ключевых клеток» при микроскопическом исследовании; значение рН вагинального отделяемого более 4,5; положительный результат аминотеста.
В лаборатории производился посев по методу Lindsey (1982). На кровяном, солевом агаре, среде ДИФ определялись стафилококки, энтерококки, коринебактерии. На 5% кровяном агаре и среде Сабуро подсчитывались колонии дрожжеподобных грибов. Диагностическим считался титр 103 КОЕ/мл и выше. Для определения бифидофлоры использовали среду Блаурокка. Посев проводился из разведения 10-2-10-3-10-5-10-6. Идентификация микроорганизмов проводилась на тест-системах Lachema (Брно, Чешская республика), Micro-La-test, STREPTOtest, ENTEROtest 1, 2. Учет результатов проводился на бактериальном анализаторе IEMS.
Результаты лабораторного исследования показали сочетание различных видов возбудителей: у 19 женщин выявлено сочетание Ch. trachomatis, C. аlbicans, U. urealyticum, у 20 пациенток U. urealyticum, бактериальный вагиноз, C. аlbicans, у 11 пациенток – Ch. trachomatis, T. vaginalis, вульвовагинальный кандидоз. Группу сравнения составили 30 практически здоровых женщин, отобранных при профилактических осмотрах, средний возраст 26,8 ±1,2 года.
Полученные результаты исследований были подвергнуты обработке методами вариационной статистики с вычислением средней арифметической и ее стандартной ошибки (М±m). О достоверности различий средних величин судили по критерию Стьюдента (t). Если условия нормальности распределения не выполнялись, применяли непараметрический критерий Манна–Уитни. Цифровой материал обрабатывался методом вариационной статистики с помощью пакета прикладных программ «Statistica for Windows».
Результаты и обсуждение
Клинически остро процесс протекал у 89,0% обследованных пациенток. У 11,0% преобладало подострое течение заболевания. Пациенток с острыми формами урогенитальной инфекции нижнего отдела мочеполового тракта достоверно чаще беспокоили выделения из половых путей, диспареуния, зуд гениталий был умеренной интенсивности, рези при мочеиспускании.
Отмечено, что выделения из половых путей были у всех женщин. Патологические выделения были слизисто-гнойным либо мутным в значительном количестве. У пациенток с преобладанием анаэробной флоры была выражена адгезия отделяемого к стенкам влагалища и отмечался «рыбный» запах различной интенсивности. В 90,4% случаев выявлен острый цервицит, что проявлялось резкой гиперемией, гипертрофией цилиндрического эпителия, обильным слизистым отделяемым. В 61,6% выявлен уретрит: наружное отверстие мочеиспускательного канала было гиперемировано, отечно, при массаже стенка уретры пастозна, достаточно болезненна, выделения мутные, густые, в умеренном количестве, с неприятным запахом. Микробиологическими исследованиями установлен рост условно-патогенной флоры: E. coli, St. aureus, Pseudomonas aeruginosa, Proteus spp., С.albicans, средний титр составлял 105–107 КОЕ/мл.
Клиническая оценка эффективности проводилась через 10 дней после терапии. Жалобы на патологические выделения, зуд гениталий в группе, получавшей базисное лечение, предъявляли 7 пациенток (35%), у 5 (25%) отмечались явления цервицита, у 4 (20,0%) – уретрита, у 3 (13,0%) – вульвовагинита. Во второй группе данные жалобы отметила лишь одна женщина (3,3%), явления цервицита присутствовали у 2 (6,6%).
Критериями клинико-этиологической излеченности, проведенными через месяц, были отрицательные результаты ПЦР-диагностики, восстановление микробиоценоза, разрешение клинических симптомов.
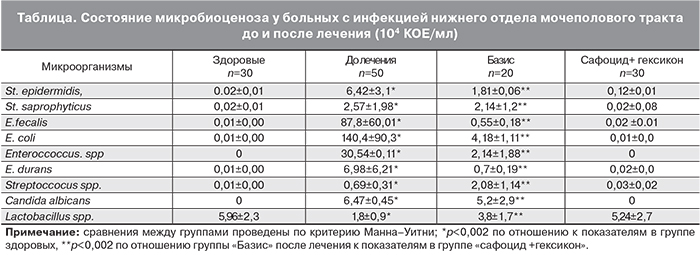
Клинически у 4 (20%) пациенток, лечившихся по базисной схеме, сохранялись жалобы на выделения, умеренный зуд половых органов, у них же выявлен цервицит, а процент элиминации возбудителя составил 85%. Такая низкая эффективность базисной схемы, по нашему мнению, может быть связана с низкой комплаентностью используемых средств и значительной частотой нежелательных побочных эффектов. Эти женщины отмечали тошноту, металлический привкус во рту, диспепсию в 20,0% случаев. В группе пациенток, получавшей комбинированную терапию, лишь у 1 женщины выявлены Ch. trachomatis, эффективность лечения составила 96,7% и побочные эффекты зарегистрированы не были. Анализ микробного пейзажа шейки матки показал, что количество видов микроорганизмов в группе, получавшей базисную терапию, составляло два-три, а у 5 (25,0%) пациенток средний титр бактерий превышал пороговое значение, С. albicans выявлен в титре 105–107 КОЕ/мл у 3 женщин (15%). Лактобактерии выявлялись в титре 103,7 КОЕ/мл.
Среди женщин, использовавших комбинированную терапию, жалобы и признаки цервицита выявлены у одной (3,3%) пациентки. У нее же выявлен рост E. coli и E. durans, в титре составил 103 и 104 КОЕ/мл соответственно. У остальных женщин наблюдаемой группы роста условно-патогенной флоры не выявлено. Данный факт можно объяснить тем, что условно-патогенные микроорганизмы более чувствительны к действию антисептиков, и снижение их количества создает благоприятные условия для восстановления лактобациллярной флоры. Результаты проведенного исследования показали увеличение среднего титра лактобактерий до 105,24 КОЕ/мл у пациенток, применявших комплексную терапию, что соответствовало показателям здоровых женщин.
Данные микробиологического исследования представлены в таблице.
Заключение
Таким образом, сафоцид имеет высокую комплаентность, не обладает угнетающим действием на резидентную флору, отсутствие системных побочных эффектов делает его препаратом выбора при микст-инфекциях генитального тракта. Комплексное применение препаратов сафоцид и гексикон у больных с воспалительными заболеваниями урогенитального тракта негонококковой этиологии позволяет воздействовать одновременно практически на все этиологические факторы и звенья патогенеза, приводит к клиническому и этиологическому выздоровлению в 96,7% случаев.



