Основными критериями оценки результативности эмбриологического этапа программ ЭКО являются наличие и количество эмбрионов хорошего качества, пригодных для переноса. Морфологическая оценка бластоцист является наиболее важным критерием при выборе эмбриона на перенос, так как в значительной степени отражает его жизнеспособность [1, 2]. Наличие цитоплазматических фрагментов в перивителлиновом пространстве эмбриона признано наиболее частой причиной снижения его жизнеспособности и неудовлетворительной морфологической оценки [3]. В ряде случаев, когда по результатам проведения программы ЭКО у пациентки отсутствуют эмбрионы хорошего качества, пригодные для переноса, предпринимаются попытки увеличения жизнеспособности эмбрионов посредством их дефрагментации [4–6]. Дефрагментация представляет собой процедуру микроманипуляционного удаления цитоплазматических фрагментов, остановившихся в развитии бластомеров и грубых грануляций из перивителлинового пространства эмбриона.
Целью данной работы явилась оценка клинических исходов программ ЭКО после переноса бластоцист неудовлетворительного качества, подвергнутых процедуре микрохирургической дефрагментации.
Материалы и методы
Дизайн исследования
В период с 04.2019 г. по 12.2019 г. процедура микрохирургической дефрагментации была проведена на 36 бластоцистах неудовлетворительного качества, полученных от 32 пар, проходящих лечение бесплодия методами вспомогательных репродуктивных технологий в клинике «АльтраВита» (Москва). В данный и последующие периоды были проведены перенос эмбриона (ПЭ) либо криоконсервация и хранение эмбрионов с последующим переносом в криоцикле, оценка наступления беременности и анализ клинических исходов программ ЭКО. До 01.2021 г. удалось получить данные клинических исходов программ по 20 случаям (после переноса 20 бластоцист). Средний возраст женщин, от которых были получены эмбрионы, составил 35,8 года (от 25 до 46 лет). При отборе эмбрионов для дефрагментации причина бесплодия, возраст женщины и способ оплодотворения не учитывались. Эмбрионы, полученные с использованием ооцитов доноров, а также в программах с преимплантационной генетической диагностикой, в исследование не включались.
Критериями включения эмбрионов в экспериментальную группу являлись: отсутствие на 5–6-й день развития бластоцист хорошего качества, пригодных для переноса в полость матки или криоконсервации; наличие на 5–6-й день развития бластоцисты неудовлетворительного качества, трофэктодерма которой была оценена как «С» (по Гарднеру) [1]; объем безъядерных цитоплазматических фрагментов или бластомеров, не включенных в состав трофэктодермы или внутриклеточной массы сформированной бластоцисты, был более 15%, но не превышал 35% от объема эмбриона.
После проведения ПЭ оценивали долю имплантации эмбрионов и частоту наступления клинической и прогрессирующей клинической беременности, а также исход беременности.
Овариальная стимуляция и получение ооцитов
Индукцию суперовуляции проводили по протоколу с применением антагонистов гонадотропин- рилизинг-гормона со 2–3-го дня менструального цикла с использованием рекомбинантных и/или мочевых гонадотропинов в суточной дозе 150–300 МЕ. Овуляцию инициировали введением человеческого хорионического гонадотропина в дозе 10 000 МЕ за 34–36 ч до пункции фолликулов. Ооциты, окруженные слоем клеток кумулюса, получали в результате трансвагинальной пункции фолликулов под ультразвуковым контролем спустя 34–36 ч после введения триггера овуляции.
Оплодотворение
Для оплодотворения полученных ооцитов применяли процедуру интрацитоплазматической инъекции сперматозоида в ооцит или предварительный отбор морфологически нормального сперматозоида с последующей интрацитоплазматической инъекцией в ооцит, в зависимости от параметров спермы.
Культивирование и оценка развития эмбрионов
Культивирование осуществляли в СО2-инкубаторе при 36,7°C в увлажненной атмосфере с 6,0% СО2. Эмбрионы культивировали индивидуально в микрокаплях среды Onestep (Vitromed) с добавлением 5 мг/мл белка (SPS, Sage) под слоем минерального масла. Зиготы и эмбрионы индивидуально оценивали на 1, 3, 5 и 6-й дни развития. Оценка качества бластоцист осуществлялась по Гарднеру [1].
Дефрагментация эмбрионов
Бластоцисты, трофэктодерма которых была оценена как «С», а объем фрагментации был более 15%, но не превышал 35% от объема эмбриона, подвергались процедуре микрохирургической дефрагментации. Все микрохирургические манипуляции были выполнены на инвертированном микроскопе Leitz Fluovert FU (Wild Leitz GmbH, Germany) с использованием системы Хоффмановского модуляционного контраста, оборудованном комплектом микроманипуляторов Narishige (Narishige, Tokyo, Japan). На первом этапе проводился вспомогательный хетчинг с использованием присасывающей микропипетки (Holding Pipette, Cook Medical) и микропипетки для рассечения zona pellucida (ZPD, Origio). Со стороны максимального скопления цитоплазматических фрагментов осуществлялся разрез zona pellucida на ¼–⅓ длины окружности. После выполнения разреза производили удаление цитоплазматических фрагментов, остановившихся в развитии бластомеров и клеточного дебриса из перивителлинового пространства эмбриона при помощи микроинструментов, использовавшихся для вспомогательного хетчинга. В редких случаях при выполнении дефрагментации для большего удобства оператора микропипетка для рассечения zona pellucida могла быть заменена на биопсийную микропипетку (Biopsy Pipette, TPC). Для каждого эмбриона вся процедура дефрагментации занимала 3–5 минут. После проведения дефрагментации бластоцисты культивировали в течение 2 ч, затем повторно морфологически оценивали и использовали для ПЭ (5-й день) или криоконсервации (5–6-й день) с последующим ПЭ в криоцикле.
Перенос эмбриона, оценка наступления и исход беременности
ПЭ осуществляли на 5-й день после пункции фолликулов (в циклах индукции суперовуляции) или после начала терапии прогестероном (в криоциклах). Одна дефрагментированная бластоциста переносилась в полость матки пациентки. Среднее количество эмбрионов на перенос составило 1,0. Клиническую беременность диагностировали по наличию плодного яйца в полости матки и регистрации сердцебиения плода при ультразвуковом исследовании на 4–5-й неделе после ПЭ.
Частота прогрессирующей клинической беременности определялась отношением общего числа клинических беременностей сроком 12 недель и более к общему числу переносов. По окончании гестационного периода оценивалось количество живорождений.
Результаты
Были проанализированы результаты 20 клинических случаев переноса одной дефрагментированной бластоцисты в цикле стимуляции (n=14) или в криоцикле (n=6) с известным клиническим исходом. Через 2 ч после микрохирургической дефрагментации трофэктодерма всех 20 бластоцист была морфологически оценена не ниже категории «В» (рисунок).
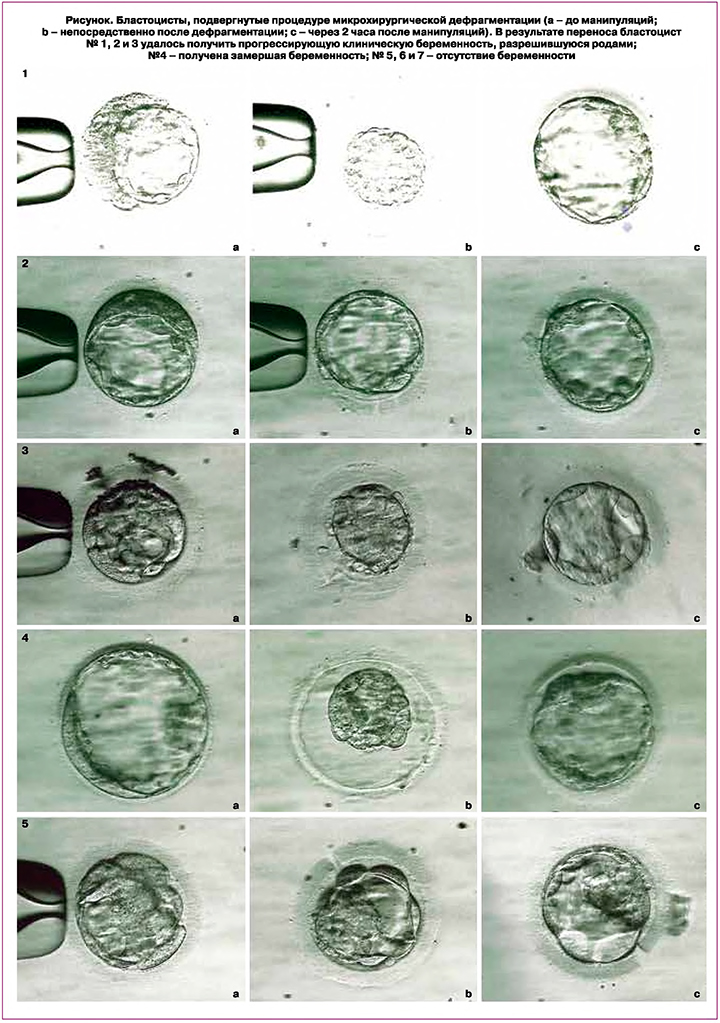

После проведения ПЭ диагностировали: отсутствие беременности в 12 случаях, в том числе в 8 – при ПЭ в цикле стимуляции и в 4 – в криоцикле; клиническая беременность наступила в 8 случаях, замершая беременность – в 2 случаях, в том числе 1 – при ПЭ в цикле стимуляции и 1 – в криоцикле; прогрессирующая клиническая беременность, разрешившаяся родами, – 6 случаев, в том числе 5 – при ПЭ в цикле стимуляции и 1 – в криоцикле. Таким образом, доля получения клинической беременности составила 40% (8/20), а доля прогрессирующей клинической беременности, разрешившейся живорождением, – 75% (6/8). Надо отметить, что кумулятивно за 2019 г. в клинике «АльтраВита» данные показатели составили 34,2 и 65,1% соответственно, при переносе бластоцист качества не ниже «ВВ».
В феврале 2020 г. на 37-й неделе гестации путем кесарева сечения родилась здоровая девочка – первый ребенок, родившийся в результате переноса бластоцисты неудовлетворительного качества, подвергнутой процедуре микрохирургической дефрагментации.
Обсуждение
В практике ЭКО ПЭ на стадии бластоцисты является общепринятым стандартом [7]. Преимущества ПЭ на стадии бластоцисты включают лучшую синхронизацию между эндометрием и эмбрионом и возможность отобрать эмбрион с более высоким потенциалом к имплантации [8].
Gardner D.K. и Schoolcraft W.B. разработали систему оценки бластоцист, в основу которой легли 3 параметра: размер бластоцисты, качество внутренней клеточной массы и качество трофэктодермы [9].При переносе пациенткам в цикле стимуляции двух бластоцист хорошего качества (≥3AA) 5-го дня развития частота имплантации и доля клинических беременностей составили 69,9 и 86,8% соответственно, в то время как при использовании двух бластоцист качества ниже чем 3АА данные показатели составили только 28,1 и 43,8% соответственно. То есть частота имплантации бластоцист худшего качества была более чем в 2 раза ниже, чем бластоцист с качеством ≥3AA [1]. Та же группа исследователей получила похожие данные у пациенток с благополучным прогнозом при переносе одной бластоцисты: доля имплантации эмбрионов и прогрессирующей клинической беременности составила 60,9% [2]. В ретроспективном исследовании 350 циклов ЭКО Balaban B. et al. также обнаружили значительные различия исходов программ ЭКО после переноса бластоцист различного качества [10].
Gray J.E. et al. модифицировали буквенно-цифровую оценочную шкалу Гарднера и Скулкрафта, разработав балльную оценку бластоцист. Согласно их данным, при ПЭ в циклах стимуляции качество внутриклеточной массы и трофэктодермы являлось значимым прогностическим фактором в оценке наступления беременности. При снижении качества внутриклеточной массы от «А» к «С» средняя доля имплантации бластоцист снижалась с 57 до 21%, а в случае со снижением качества трофэктодермы – с 58 до 39% соответственно [11]. Ряд исследований показал, что морфологическая оценка трофэктодермы бластоцист позволяет с большей вероятностью прогнозировать частоту наступления беременности в циклах ЭКО [12, 13].
В ретроспективном исследовании Honnma H. et al. был проанализирован вклад каждого из трех компонентов оценки морфологии бластоцист в клинические исходы программ ЭКО [14]. Было найдено, что качество трофэктодермы статистически значимо связано с долей прогрессирующих клинических беременностей и частотой возникновения выкидышей. При переносе витрифицированных/оттаянных бластоцист с трофэктодермой качества A, B и C доля прогрессирующей клинической беременности составила 46,6, 34,1 и 23,7% соответственно. Напротив, статистически значимого влияния на клинические исходы программ ЭКО ни степень экспансии бластоцист, ни качество внутриклеточной массы не оказали [14].
Неясна причина статистически значимой взаимосвязи качества трофэктодермы с долей получения прогрессирующей клинической беременности и частотой выкидышей. Известно, что клетки трофэктодермы в итоге формируют плаценту, а клетки внутриклеточной массы – плод. По этой причине считается, что при отборе эмбрионов на перенос морфология внутриклеточной массы является более значимым критерием для прогноза исхода беременности, чем морфология трофэктодермы, в связи с мнением, что клетки плода более важны, чем клетки плаценты. Однако ряд исследований показал, что морфология трофэктодермы имеет большее влияние на исход беременности, чем качество ВКМ и степень экспансии бластоцисты [12–14].
Результаты исследований показали, что повышенная фрагментация эмбрионов связана со снижением их потенциала к имплантации [1, 5, 15] и к наступлению беременности [15–17]. Данные свидетельствуют о том, что удаление фрагментов улучшает развитие эмбриона [18], а также увеличивает долю имплантации [5, 15]. Было найдено, что в результате переноса дефрагментированных эмбрионов клинические исходы программ ЭКО были аналогичны [5] либо лучше, чем при переносе эмбрионов из контрольных групп [16].
Анализ научных публикаций показал, что исследования по влиянию дефрагментации на клинические исходы программ проводились преимущественно с использованием эмбрионов на стадии дробления [4], в частности на эмбрионах 2-го [18, 16] и 3-го дня развития [5, 15]. Удалось найти единственное исследование, в котором объектом для проведения дефрагментации были эмбрионы человека на стадии бластоцисты [6]. В этой работе был представлен обзор трех клинических случаев по переносу пациенткам дефрагментированных бластоцист в программах ЭКО с получением трех клинических беременностей. В нашем исследовании мы сообщаем о рождении шестерых детей, полученных в результате переноса 20 бластоцист неудовлетворительного качества, подвергнутых процедуре микрохирургической дефрагментации. Насколько нам известно, это первая работа, в которой сообщается о живорождении с использованием для переноса бластоцист неудовлетворительного качества после процедуры дефрагментации.
Считается, что цитоплазматическая фрагментация является результатом запрограммированной гибели клеток, приводящей к высвобождению токсичных веществ, которые повреждают окружающие клетки или вызывают остановку дробления близлежащих бластомеров [15, 18]. Кроме того, фрагменты могут препятствовать межклеточному взаимодействию, нарушая пространственную ориентацию бластомеров или ограничивая пространство, необходимое для продолжающегося дробления или компактизации эмбриона. Исследования показали, что фрагменты вызывают вторичную дегенерацию близлежащих клеток. С использованием просвечивающей электронной микроскопии было обнаружено, что бластомеры, прилегающие к цитоплазматическим фрагментам, имеют признаки вакуолизации [19, 20]. При удалении данных фрагментов восстанавливается соответствующая пространственная организация бластомеров в эмбрионе, что приводит к более адекватному формированию межклеточных связей [15, 21]. В то же время аспирация фрагментации может улучшить микроокружение бластомеров в эмбрионе за счет исключения токсического воздействия клеточных фрагментов на стадии апоптоза [16].
Основным недостатком настоящего и указанных выше исследований является их нерандомизированный характер. Еще предстоит определить, какой из компонентов процедуры дефрагментации оказывает решающее значение на улучшение клинических исходов программ ЭКО: непосредственно дефрагментация или предшествующие ей манипуляции с zona pellucida, т. е. вспомогательный хетчинг [22, 23]. Несмотря на то что проведение вспомогательного хетчинга или полного удаления zona pellucida у бластоцист хорошего качества не приводит к увеличению результативности программ ЭКО [24], он может оказывать определенное положительное влияние в случае использования эмбрионов с неудовлетворительной морфологической оценкой.
Таким образом, необходимы дальнейшие сравнительные проспективные исследования для оценки роли дефрагментации эмбрионов с целью повышения частоты наступления прогрессирующей клинической беременности у пациенток, проходящих лечение бесплодия методами ЭКО.
Заключение
Дефрагментация бластоцист неудовлетворительного качества позволяет улучшить их морфологическую оценку. Клинические исходы программ ЭКО с использованием дефрагментированных бластоцист сопоставимы с таковыми при переносе бластоцист хорошего качества, в том числе и по показателю живорождения.



