В терапии инфекций нижних отделов женских половых органов в дополнение к антимикробным препаратам используют средства, влияющие на иммунитет, но не проявляющие прямой бактерицидной или бактериостатической активности [1, 2]. В большинстве случаев это иммуностимуляторы, так как считается, что усиление напряженности факторов защиты хозяина способствует элиминации возбудителя. Наряду с этим существует ряд препаратов, содержащих в своем составе глюкокортикоиды, обладающие, как известно, противовоспалительным и иммуносупрессивным действием [3]. Несмотря на это, локальное применение таких комбинированных препаратов известно своей высокой клинической эффективностью [4, 5].
Возникает вопрос: является ли клиническая эффективность применения комбинации антимикробных препаратов и преднизолона (в форме преднизолона натрия фосфата) лишь результатом симптоматического действия глюкокортикоидов или это следствие элиминации этиологического агента? Кроме того, неясно, как влияет вагинальное применение преднизолона (в форме преднизолона натрия фосфата) на микроэкологическое состояние влагалища (мукозальный иммунитет, микрофлору) и не изменяется ли в присутствии глюкокортикоидов чувствительность к антимикробным веществам.
Получение ответов на эти вопросы позволит понять механизмы, обеспечивающие эффективность действия комбинации антимикробных препаратов и преднизолона, что будет способствовать персонализации подходов к терапии инфекции нижних отделов женских половых органов.
Цель – оценить в условиях in vivo и in vitro влияние комбинации антимикробных препаратов и преднизолона (в форме преднизолона натрия фосфата) на состояние мукозального иммунитета, выраженность воспалительной реакции, ростовые свойства и чувствительность к антимикробным веществам микрофлоры нижних отделов женского репродуктивного тракта.
Материалы и методы
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской Декларации, с одобрения ЛЭК ФГБОУ ВО ОрГМУ Минздрава России.
Тип исследования – открытое нерандомизированное наблюдательное. Была сформирована группа из 80 женщин, страдающих вагинитами смешанной этиологии, с учетом критериев включения/исключения. Критерии включения: возраст 20–30 лет, наличие вагинита смешанной этиологии, наличие добровольного информированного согласия. Критерии исключения: наличие суб- или декомпенсированной соматической патологии, нарушение менструального цикла, курение, наличие ИППП, за исключением Trichomonas vaginalis, беременность и лактация, приверженность к интравагинальным гигиеническим практикам, применение антимикробных препаратов или спермицидов ранее чем за месяц до включения в исследование.
Все пациентки с 7–9-го дня менструального цикла получали вагинально в течение 9 дней терапию комбинированным препаратом Эльжина («Вертекс», Россия), содержащим орнидазол – 500 мг, неомицин в форме неомицина сульфата – 65 000 МЕ; преднизолон в форме преднизолона натрия фосфата – 3 мг; эконазол в форме эконазола нитрата – 100 мг.
По завершении терапии на основе совокупности лабораторных и клинических данных все пациентки были разделены на 2 группы: «излеченные» (74 пациентки – 92,5%) и «неизлеченные» (6 пациенток – 7,5%).
До и после курса терапии проводились клиническое, бактериологическое, микроскопическое и иммуноферментное исследования.
Выраженность клинических проявлений оценивали при осмотре и на основании дневников самонаблюдения пациентов по 4-балльной системе, где 0 баллов – отсутствие признаков/симптомов, а 3 балла – тяжелая степень выраженности. Значения вагинального рН определяли с использованием бумажных тест-полосок с ограниченным диапазоном рН.
Оценку состояния микрофлоры проводили по микроскопическим критериям Hay-Ison. Значение лейкоцитарно-эпителиального индекса (ЛЭИ) определяли путем подсчета количества лейкоцитов и эпителиальных клеток в десяти полях зрения.
Численности условно-патогенных микроорганизмов (УПМ) и бактерий рода Lactobacillus определяли путем высева на селективные питательные среды с последующим культивированием в атмосфере с 5% содержанием СО2 в течение 48 ч. Видовую принадлежность микроорганизмов подтверждали с помощью комплекса морфологических, культуральных, биохимических свойств [6]. Для обнаружения T. vaginalis использовали культивирование в среде Kupferberg Trichomonas Broth Base (HiMedia), содержащей 5% лошадиной сыворотки и хлорамфеникол. Наличие трихомонад в среде культивирования подтверждали микроскопически [7].
Вагинальный лаваж получали, омывая стенки влагалища 2 мл стерильного физиологического раствора. Активность протеаз в лаваже ингибировали добавлением фенилметилсульфонилфлюорида до конечной концентрации 5 мкМ/мл. Концентрацию цитокинов (IL-1β, IL-6, IL-8, TNFα), простагландина Е2α (PGE2α), лактоферрина и секреторного иммуноглобулина А (sIgA) определяли методом иммуноферментного анализа (ИФА) с использованием наборов производства ООО «Цитокин» (Россия) и Cloud-Clone Corp. (США).
Оценку влияния преднизолона (в форме преднизолона натрия фосфата) на ростовые свойства вагинальных изолятов S. aureus (5 штаммов), E. coli (6 штаммов), Lactobacillus spp. (17 штаммов) и Candida spp. (7 штаммов) из коллекции ИКВС УрО РАН осуществляли фотометрически (l=540 нм) по изменению оптической плотности биомассы культуры при добавлении преднизолона в разных концентрациях.
Чувствительность тест-штаммов к антибиотикам определяли методом серийных микроразведений, согласно рекомендациям Clinical and Laboratory Standards Institute (CLSI) [8]. Антибиотики использовали в концентрациях от 2 минимальных ингибиторных концентраций (МИК) и ниже с шагом разведения 10% МИК.
Влияние преднизолона (в форме преднизолона натрия фосфата) на чувствительность изучали в 96- луночных полистироловых планшетах, как описано ранее [9]. Наименьшую концентрацию антибиотика, при которой не наблюдалось видимого роста, считали МИК.
Данные представлены в виде частот, или процентного отношения, или среднего значения и стандартного отклонения. Для оценки достоверности различий между группами использовали критерии Манна–Уитни и согласия Пирсона (χ2). Во всех процедурах статистического анализа уровень значимости p принимался равным 0,05.
Результаты
Исходно все пациентки, включенные в исследование, имели клинические и лабораторные признаки вагинита, что подтверждалось значением ЛЭИ (2,76±1,28) и состоянием микрофлоры влагалища (IV тип микробиоценоза по Hay–Ison). У 20% пациенток были обнаружены T. vaginalis, у 27,5% – Candida spp., у 37,5% – УПМ анаэробного спектра, у 47,5% – УПМ аэробного спектра в этиологически значимом количестве.
Клиническая эффективность терапии комбинацией антимикробных препаратов и преднизолона (в форме преднизолона натрия фосфата) составила 97,5%, лабораторная – 92,5% (р=0,68). В результате терапии изменилось соотношение типов микробиоценоза: IV тип был обнаружен у 2,5% пациенток, II тип – у 70,0%, I тип – у 27,5%. После терапии этиологически значимые количества УПМ аэробного и анаэробного спектра были отмечены у 2,5 и 5% пациенток соответственно. Грибы рода Candida высевались в 35% случаев, но их ПМО не превышал 3 lg КОЕ/мл. T. vaginalis была выделена только у 3 пациенток.
Достоверных различий между основными демографическими и антропометрическими показателями излеченных и неизлеченных пациенток обнаружено не было.
При изучении динамики состояния нормальной микрофлоры нижних отделов женского репродуктивного тракта в процессе терапии было отмечено ее полное восстановление только в 27,5% случаев, в остальных – количество лактобацилл возрастало, но не достигало нормальных показателей. Средние показатели микробной обсемененности влагалища лактобациллами возрастали в результате терапии с 2,18±1,03 КОЕ/мл до 3,73±1,42 КОЕ/мл (р=0,012). Изменение в численности нормальной микрофлоры сопровождалось снижением рH c 4,48±0,57 до 4,06±0,34 (р=0,03).
При оценке выраженности воспалительной реакции и показателей мукозального иммунитета нижних отделов женского репродуктивного тракта (факторы естественной резистентности, цитокины, ЛЭИ) в процессе терапии было выявлено изменения всех оцениваемых параметров.
В группе излеченных исходные уровни и лактоферрина, и sIgA были значительно выше, чем у неизлеченных. В результате терапии уровни и лактоферрина, и sIgA в группе излеченных снижались. В группе неизлеченных пациенток исходно низкие уровни лактоферрина и sIgA в результате терапии увеличивались, приближаясь к исходным значениям группы излеченных (рис. 1, А, Б).
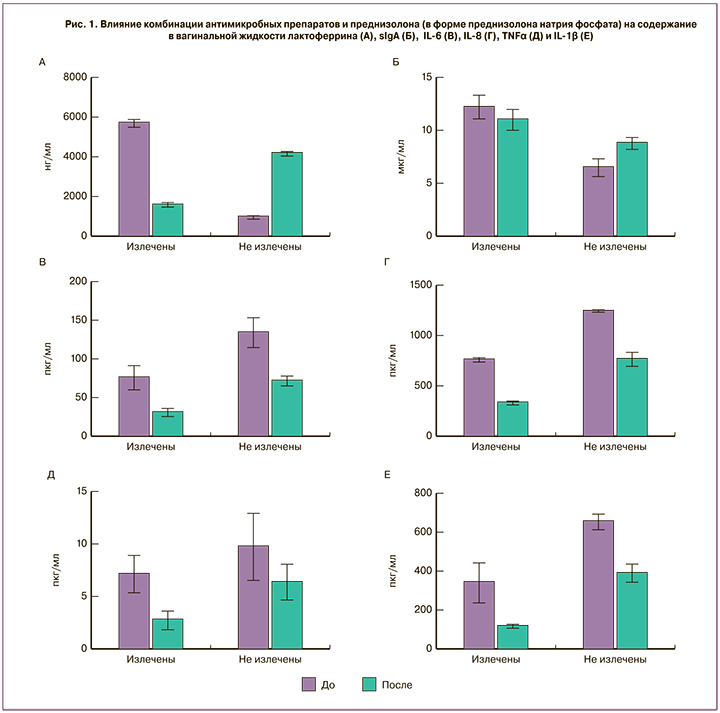
Уровни провоспалительных цитокинов IL-6, IL-8, TNFα и IL-1β в вагинальной жидкости в результате терапии снижались (рис. 1, В–Е).
Обращает на себя внимание, что в группе излеченных исходный уровень провоспалительных цитокинов был достоверно ниже, чем у пациенток, излечить которых не удалось. Как и в случае с лактоферрином и sIgA, в результате терапии уровни цитокинов в группе неизлеченных приближались к исходным значениям излеченных (рис. 1, В–Е). В результате терапии наблюдалось снижение ЛЭИ, вне зависимости от исхода терапии.
Уровень PGE2α в результате терапии снижался в среднем с 9,96±2,16 пг/мл до 6,03±0,81 пг/мл (р<0,01). Нужно отметить, что исходный уровень простагландинов у излеченных пациенток был достоверно ниже (р<0,01), чем у неизлеченных, – 6,49±0,77 и 13,4±1,14 пг/мл соответственно.
Таким образом, было установлено, что исходно высокие значения ЛЭИ, простагландинов и провоспалительных цитокинов и исходно низкие уровни лактоферрина и sIgA препятствуют успешности терапии, а применение комбинации антимикробных препаратов и преднизолона (в форме преднизолона натрия фосфата) позволяет снизить выраженность воспалительной реакции и нормализовать напряженность факторов мукозального иммунитета.
Далее в условиях in vitro оценивали прямое влияние преднизолона (в форме преднизолона натрия фосфата) на ростовые свойства и чувствительность к антибиотикам представителей микрофлоры влагалища.
Было обнаружено, что в концентрациях, предположительно возникающих в вагинальной жидкости в процессе лечения, преднизолон (в форме преднизолона натрия фосфата) стимулировал прирост биомассы условно патогенных S. aureus и E. coli (рис. 2, А, Б), что сопровождалось увеличением их чувствительности к неомицина сульфату. Под влиянием преднизолона мы наблюдали дозозависимое угнетение прироста биомассы Candida spp. и лактобацилл (рис. 2, В, Г). Это сопровождалось снижением чувствительности лактобацилл к орнидазолу, а Candida spp. – к эконазолу.
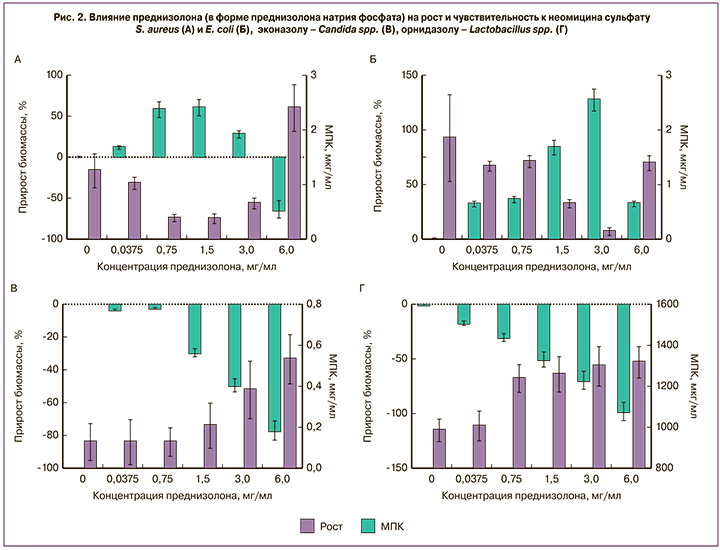
Таким образом, преднизолон (в форме преднизолона натрия фосфата) разнонаправленно действует на ростовые характеристики вагинальной микрофлоры, ускоряя рост условно-патогенных бактерий, делает их более чувствительными к действию антимикробной составляющей препарата, при этом значительно замедляя рост популяции нормальной микрофлоры (лактобацилл), напротив, делает их более устойчивыми к антибиотикам.
Обсуждение
Отсутствие достоверных различий в частоте клинической и лабораторно подтвержденной излеченности свидетельствует о том, что эффективность комбинации антимикробных веществ и преднизолона однозначно обусловлена элиминацией возбудителя.
Вероятно, элиминации возбудителя способствовало наличие в препарате преднизолона (в форме преднизолона натрия фосфата). Как показало исследование, преднизолон способен ускорять рост популяции УПМ, переводя их в фазу экспоненциального роста, в которой они наиболее подвержены повреждающему действию неблагоприятных факторов [10, 11], в том числе и антибиотиков. Таким образом, наличие преднизолона (в форме преднизолона натрия фосфата) в комбинированном препарате создавало предпосылки для успешной реализации антимикробного потенциала антибиотиков, то есть элиминации патогенов.
В отношении лактобацилл преднизолон (в форме преднизолона натрия фосфата) оказывал противоположное действие – замедлял рост популяции, что придает лактобациллам большую устойчивость к действию антибиотиков, обеспечивая выживаемость аутоштаммов. Это же являлось причиной неполного восстановления нормофлоры влагалища к моменту окончания терапии. Этот факт свидетельствует о необходимости дальнейших мероприятий, направленных на восстановление численности лактобацилл, предпочтительно за счет применения средств, стимулирующих жизнедеятельность аутоштаммов.
Анализируя причины неудач терапии, мы отметили, что исходно различия в тяжести клинических проявлений и микробном пейзаже между излеченными и неизлеченными отсутствовали. При этом группы отличались по содержанию в вагинальной жидкости простагландинов, провоспалительных цитокинов, лактоферрина и sIgA, следовательно, именно эти параметры препятствовали излечению, обеспечивая стабильность патоценоза. Ранее было показано [12], что высокие уровни провоспалительных цитокинов стимулируют рост УПМ и угнетают развитие лактобацилл, и наоборот, умеренные уровни провоспалительных цитокинов стимулируют рост нормофлоры и угнетают УПМ. Вместе с тем известно, что высокий уровень лактоферрина стимулирует рост лактобацилл и подавляет УПМ [13].
В группе неизлеченных в результате терапии микробиота не претерпела значимых изменений, и это позволило нам трактовать изменение мукозального иммунитета и эффекторов воспаления как следствие действия комбинации антимикробных веществ и преднизолона (в форме преднизолона натрия фосфата). Наши опасения относительно иммунодепрессивного влияния преднизолона на мукозальный иммунитет влагалища не подтвердились: содержание простагландинов и цитокинов снижалось, а факторов естественной резистентности – увеличивалось.
Таким образом, наличие в составе комплексного препарата преднизолона (в форме преднизолона натрия фосфата) способствует успеху терапии вагинитов:
- преднизолон разнонаправленно действует на ростовые характеристики вагинальной микрофлоры, ускоряя рост УПМ, делает их более чувствительными к действию антимикробной составляющей препарата, при этом значительно замедляя рост популяции нормальной микрофлоры (лактобацилл), делает их более устойчивыми к антибиотикам;
- преднизолон (в форме преднизолона натрия фосфата), нормализуя уровень показателей мукозального иммунитета (лактоферрина и sIGA) и снижая уровень эффекторов воспаления (цитокинов, простагландинов), создает благоприятные условия для жизнедеятельности нормальной микрофлоры и неблагоприятные – для УПМ.
Заключение
В результате исследования в условиях in vivo и in vitro было установлено, что эффективность применения комбинации антимикробных препаратов и преднизолона определяется не только прямой антимикробной активностью, но и влиянием на выраженность воспалительной реакции, состояние мукозального иммунитета и чувствительность микроорганизмов к антибиотикам.



