В последние годы микозы представляют собой серьезную клиническую проблему для отделений реанимации и интенсивной терапии новорожденных (ОРИТН) [1–4]. Это связано со значительным повышением выживаемости глубоко недоношенных детей в связи с развитием современных технологий реанимационно-интенсивной помощи. В процессе выхаживания детей с очень низкой и экстремально низкой массой тела при рождении (ОНМТ и ЭНМТ) возникает необходимость применения различных инвазивных методов лечения, таких как искусственная вентиляция легких (ИВЛ), длительное по времени парентеральное питание, пролонгированная катетеризация центральных вен, которые приводят к грибковой колонизации и образованию биопленок как резервуара для системного распространения грибов [2–4]. Инвазивный кандидоз может проявляться как кандидемией, так и грибковым поражением по сути любого органа и ткани организма. Синдром, который является особенно уникальным для недоношенных детей – это гематогенный кандидозный менингоэнцефалит, при котором грибы рода Candida проникают в центральную нервную систему. Он может способствовать увеличению смертности среди новорожденных и формированию отсроченных патологий развития нервной системы [5].
Инвазивные микозы у пациентов с тяжелыми заболеваниями, находящихся в ОРИТН, являются поводом для совершенствования методов ранней диагностики и проведения адекватной профилактической противогрибковой терапии. Подобная необходимость определяется не только частотой встречаемости инвазивных микозов в данной популяции пациентов, но и высокими показателями смертности и экономическими затратами на лечение таких больных [6].
Возбудители микозов у новорожденных
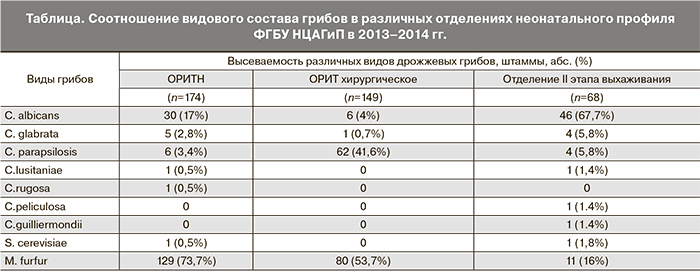
Среди огромного числа грибов, способных выступать в качестве этиологических агентов микозов у человека, в современной перинатальной медицине дрожжевые грибы (в первую очередь род Candida) наиболее значимы. В последние 20 лет мы наблюдаем значительное изменение этиологии кандидозов у новорожденных. Так, если до конца XX века преобладающий вид был Candida albicans, то с начала XXI века и по сей день наблюдается устойчивая тенденция к доминированию Candida non-albicans видов и дрожжей других родов [7]. Этот процесс напрямую связан с внедрением в повседневную практику неонатальной реанимации и хирургии высоких медицинских технологий, увеличивающих шансы на выживание у детей с критическими состояниями, ранее не совместимыми с жизнью. В связи с этим степень тяжести пациентов, а значит и профиль неонатального отделения играет важную роль в этиологии микозов. Так, по данным нашего Центра, в отделениях второго этапа выхаживания доминирующими видами являются Candida albicans, в то время как в отделениях реанимации новорожденных, соотношение частоты встречаемости различных видов дрожжевых грибов иное (таблица).
Следует обратить внимание на значительную трансформацию видового состава грибов, отмечающуюся в последние годы. Так, на сегодняшний день существенную роль в развитии инфекционного процесса у новорожденных, в особенности с ОНМТ и ЭНМТ при рождении, получающих липиды в составе длительного полного парентерального питания, стали вносить такие казуистически ранее редко встречавшиеся возбудители, как Malassezia furfur.
Частота встречаемости инвазивного кандидоза у новорожденных варьирует в широких пределах и возрастает по мере уменьшения гестационного возраста и массы тела пациентов. К категории максимального риска относятся новорожденные с ЭНМТ, родившиеся ранее 28 недель беременности, у которых инвазивный кандидоз встречается более чем в 10% случаев [8].
Колонизация грибами рода Candida часто приводит к развитию инвазивного кандидоза. Термин «кандидоколонизация» подразумевает заселение грибами кожи и слизистых оболочек, представляет собой определенный этап на пути инвазии грибов в слизистый и подслизистый слои [9, 10]. Термин «кандидоносительство» подразумевает наличие в естественных локусах грибов в значительной концентрации (более 1000–10 000) без клинических проявлений [11, 12]. Мониторинг посевов отделяемого из зева, кала, трахеобронхиального аспирата, раневого отделяемого позволяет судить о возникновении грибковой колонизации пациента. Колонизация нестерильных локусов в ряде случаев предшествует инвазии гриба и его проникновению в кровоток, а также позволяет предположить возможную этиологию кандидемии, так как часто (до 90%) возбудители при колонизации и последующей кандидемии совпадают [13].
Факторы риска распространения грибковой колонизации
У здоровых доношенных детей имеется естественная резистентность организма к грибковой инфекции, обусловленная защитными свойствами поверхности тела ребенка, вступающей в контакт с возбудителем, а также высокой фагоцитарной активностью и другими факторами неспецифического и специфического иммунитета. У недоношенных новорожденных отмечается относительная незрелость всех перечисленных механизмов антиинфекционной защиты, что в критическом состоянии делает их особо уязвимыми к грибковой инфекции.
В госпитальных условиях большую роль в распространении и инфицировании пациентов грибами рода Candida играет медицинский персонал. В особенности это касается Candida non-albicans, таких как С. parapsilosis, C. glabrata, C. krusei, C. lusitaniae [1, 2, 4, 9, 10, 14]. Также по различным данным почти у 40% здорового персонала хирургических ОРИТ с рук выделяют различные штаммы грибов Candida spp. [2]. Длительное парентеральное питание связано с высоким риском инфицирования C. parapsilosis. Именно этот вид грибов обладает особым сродством к глюкозосодержащим растворам и способностью к адгезии на пластиковом материале сосудистых катетеров с образованием биопленок. Отсутствие энтерального кормления недоношенных новорожденных молозивом с момента рождения и задержка с введением в их рацион питания нативного материнского молока в дальнейшем создает предпосылки для развития инвазивных микозов у детей данной группы. В повседневной неонатологической практике дифференциальный диагноз между кандидоколонизацией и инвазивным кандидозом вызывает определенные трудности.
Инвазивные микозы
Инвазивный кандидоз новорожденных – это тяжелая грибковая инфекция, чаще встречающаяся у недоношенных детей. Инвазивный кандидоз может проявляться кандидемией с возможным вовлечением в процесс любых органов и тканей организма [5].
Факторами риска инвазивного кандидоза являются [5]:
- Недоношенность (малый вес при рождении и малый гестационный возраст – менее 1000 г и менее 27 недель соответственно);
- Наличие у пациента центрального венозного катетера;
- Проведение терапии антибактериальными препаратами широкого спектра действия, в особенности, цефалоспоринами третьего поколения и карбапенемами;
- Проведение полного парентерального питания;
- Операции на органах брюшной полости у пациента;
- Течение некротизирующего энтероколита;
- Интубация трахеи, проведение пролонгированной ИВЛ;
- Наличие дренажей (плевральный, перитонеальный и др.) и инвазивных устройств у пациента;
- Использование в терапии антацидов и Н2-блокаторов;
- Наличие кандидозной инфекции у матери во время настоящей беременности и родов.
Инвазивный кандидоз характеризуется высокой летальностью. Так, при остром диссеминированном кандидозе у новорожденных с ОНМТ и ЭНМТ при рождении летальность достигает 60–80% в целом и 32–40% – на фоне относительно своевременно начатой противогрибковой терапии [17, 18]. Основной причиной высокой летальности является позднее начало целенаправленной противогрибковой терапии. Пути снижения летальности при инвазивном кандидозе заключаются в проведении своевременной диагностики грибковой инфекции, раннем начале целенаправленной антимикотической терапии и присутствии у врача соответствующей «микологической настороженности».
Диагностика инвазивных микозов
Современная диагностика инвазивных микозов включает в себя лабораторные и инструментальные методы. Показанием к проведению обследования может являться необъяснимое нарастание признаков инфекционного токсикоза у ребенка на фоне проводимой антибактериальной терапии в отсутствие признаков течения вирусной инфекции. Появление или распространение в динамике грибковой колонизации также может быть поводом для обследования новорожденных на инвазивные микозы.
Лабораторные методы диагностики:
1. Микробиологические методы (посев крови, ликвора, аспирата из трахеи, кала и др.) с последующей видовой идентификацией грибов при помощи биохимических тест-наборов, полуавтоматических, автоматических бактериологических анализаторов или методом MALDI-TOF-MS анализа.
Использование селективных питательных сред, таких как агар Сабуро, позволяет без особых технических трудностей обнаруживать дрожжевые грибы в биологическом материале. Исключение составляют некоторые виды грибов, такие как Malassezia furfur, для культивирования которых более целесообразно использовать специальные селективные питательные среды по прописи Диксон.
Существует большое разнообразие способов видовой идентификации дрожжевых грибов до вида. Современные методы микробиологии на основе масс-спектрометрии, приобретают все большую и большую практическую значимость за счет быстроты выполнения исследования, высокой чувствительности и специфичности получаемых результатов. Метод MALDI–TOF–MS анализа признан сегодня наиболее эффективным и достоверным способом видовой идентификации дрожжевых грибов [7].
Молекулярно-генетические методы (полимеразная цепная реакция в режиме реального времени, секвенирование 18(26)S pРНК) – предполагают детекцию возбудителя напрямую в биологическом материале или проведение видовой идентификации выделенных культур грибов. В настоящее время широко используется метод количественной ПЦР для выявления в клиническом материале грибов C. albicans и Candida spp. Стандартизованные коммерческие тест-системы на основе ПЦР для одномоментной детекции различных видов грибов пока находятся в стадии разработки.
Наиболее оптимальным методом диагностики инвазивного кандидоза является исследование культуры крови с последующей идентификацией грибов до вида, однако данный метод не является методом ранней диагностики. Основной проблемой в клинической практике является необходимость взятия больших объемов крови у новорожденных для выполнения исследования. Проведение посева крови при подозрении на инвазивный кандидоз предполагает взятие проб последовательно в течение одного дня из 2–4 интактных вен с интервалом в 30 минут, что в реальных условиях сопряжено с большими техническими трудностями. В особенности это относится к глубоконедоношенным детям массой менее 1000 граммов, учитывая, что объем циркулирующей крови новорожденного в среднем составляет 80-90 мл/кг. Необходимый для исследования объем крови при одной пункции у детей массой 2-12 кг – 6 мл и до 2 кг – 2–4 мл. По рекомендации ESCMID 2012 необходимо ежедневное выполнение посевов крови в течение 3 дней подряд [5]. Взятие крови из центральных венозных катетеров в клинической практике не рекомендуется, в связи с частой контаминацией катетеров.
Эмпирическая традиционная терапия антимикотиками все чаще демонстрирует свою неэффективность, в связи, с чем определение чувствительности грибов in vitro становится насущной потребностью в клинической практике. Наиболее распространены микробиологические методики с определением минимальных ингибирующих концентраций (МИК) к антимикотикам. Однако чувствительность и специфичность этого метода во многом зависит от производителя тест-системы, способа постановки теста (ручная и автоматическая) и способа считывания результатов (автоматически или субъективно). В настоящее время критерии интерпретации результатов разработаны для оценки чувствительности некоторых дрожжевых грибов (в основном рода Candida) и не для всех антимикотиков. Определение чувствительности к эхинокандинам по сей день представляет собой не до конца решенную задачу. К тому же часто имеет место несовпадение чувствительности in vitro с клинической эффективностью препарата. Использование нестандартизованных методов, а также дисков, импрегнированных антимикотиком, имеют низкую достоверность результатов, в связи с чем применение их в рутинной практике может стать причиной диагностических ошибок и тяжелых осложнений вследствие неадекватного выбора противогрибкового препарата.
Таким образом, на данный момент, наиболее предпочтительными способами определения чувствительности к антимикотикам являются измерение уровня МИК на автоматических или полуавтоматических бактериологических анализаторах.
2. Серологические методы (ранние диагностические тесты) включают в себя:
- Определение в сыворотке крови галактоманнана – на 5–8 дней опережает клинические проявления инвазивного аспергиллеза [15, 19].
- Определение в сыворотке крови маннана и антиманнановых антител – чувствительность и специфичность метода составляют в среднем 80 и 85% [4, 18].
При одновременном их выполнении – обладают высокой отрицательной прогностической значимостью при диагностике инвазивного кандидоза.
3. Обнаружение в крови основного компонента клеточной стенки грибов 1,3-b-D-глюкана сегодня является наиболее перспективным ранним диагностическим тестом при подозрении на развитие инвазивного микоза. В настоящее время существует две тест-системы Fungitec – G test (Seikagaku Corp., Tokyo, Japan) и Fungitell assay (CapeCod Assoc., East Falmouth, MA). Метод в настоящее время проходит регистрацию в Российской Федерации. Недостаток этих тест-систем – неспособность дифференцировать различные виды грибов, так как 1,3-b-D-глюкан – компонент клеточной стенки грибов разных родов: Candida, Aspergillus, Trichosporon, Fusarium, Saccharomyces. Кроме того, ложноположительные результаты могут быть у больных, контактирующих с другими источниками 1,3-b-D-глюкана, такими как диализные мембраны, фильтры, губки, применяющиеся в хирургии, некоторые лекарственные препараты [15].
Для диагностики инвазивного кандидоза используют также определение D-арабинитола. Это пятиуглеродный спирт, продуцируемый разными видами грибов рода Candida, кроме C. krusei и C. glabrata. Выявляется двумя методами: ферментативным и газовой хроматографией. Некоторые исследования показали, что D-арабинитол в образце крови можно определить раньше, чем сами грибы [16].
Инструментальная диагностика инвазивных микозов
Инструментальные методы диагностики инвазивного кандидоза служат для обнаружения возможных очагов его диссеминации. Диссеминация может происходить в легкие, почки, головной мозг, сетчатку глаза, брюшную полость, сердце, печень, частота ее достигает 30–40%. Методы включают в себя: выполнение ультразвукового исследования (УЗИ) внутренних органов, эхокардиографию, рентгенографию, компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ), обязательное проведение офтальмоскопии. Однако зачастую обнаруживаемые признаки являются малоспецифичными.
Среди методов инструментальной диагностики нет единого универсального метода верификации грибов. Особое значение для диагностики имеет МРТ. Особой чувствительностью к данному исследованию обладают головной мозг и кости. Так при грибковой инфекции, вызванной Aspergillus, характерно утолщение мозговых оболочек, с очагами кровоизлияний и инфарктов. Для грибов рода Candida характерными признаками являются гранулемы или единичные растущие очаги поражения (солидные), которые чаще всего локализуются в подкорковых ядрах. Таким образом, сегодня МРТ является методом выбора для ранней диагностики грибкового поражения центральной нервной системы. Напротив, при заболеваниях легких даже на ранних стадиях наиболее эффективными методами считается рентгенография и КТ. Для визуализации повреждения органов брюшной полости применяется УЗИ как наиболее доступный и безопасный метод, который позволяет зафиксировать наличие патологического процесса.
Раннему выявлению инвазивного кандидоза способствуют:
- «Микологическая настороженность» в отношении больных с факторами риска инвазивного кандидоза на фоне проведения антибиотикотерапии;
- Правильная методика взятия для посева крови и других стерильных в норме субстратов;
- Использование ранних диагностических тестов.
Современные методы лабораторной диагностики и создание системы быстрого информирования о полученных результатах, хороший уровень коммуникации врачей-клиницистов с врачами диагностических лабораторий [16].
Таким образом, диагноз инвазивного кандидоза ставится на основании специфических данных клинической картины у новорожденного ребенка, положительных результатов ранних диагностических тестов и непосредственной визуализации грибов при проведении вспомогательных инструментальных методов обследования.
Общие принципы терапии инвазивного кандидоза
Многие из общих принципов, имеющих отношение к лечению инвазивного кандидоза у детей и новорожденных, являются производными от аналогичных рекомендаций у взрослых.
- Антимикотическая терапия должна быть начата в первые 12 ч от момента выявления возбудителя в крови;
- Антимикотическая терапия должна носить целенаправленный характер;
- Необходимо проведение замены всех сосудистых катетеров, эндотрахеальной трубки и любых видов дренажей у новорожденных с момента постановки диагноза инвазивного кандидоза;
- Проведение офтальмологического осмотра необходимо во всех случаях кандидемии [5].
В процессе принятия решения о выборе антимикотического препарата должны быть приняты во внимание в первую очередь данные клинических исследований у определенной группы пациентов по конкретному препарату наряду с данными проводимого в стационаре микробиологического мониторинга чувствительности циркулирующих отдельных штаммов грибов. Однако отсутствие критериев интерпретации результатов микробиологических исследований ведет к эмпирическому назначению антимикотических препаратов. Согласование терапии инвазивных микозов должно проводиться с клиническим фармакологом стационара и позволяет в кратчайшие сроки выбрать оптимальный для конкретного пациента антимикотик, а также осуществить коррекцию проводимой терапии [17].
В настоящее время нет единых рекомендаций по сочетанию противогрибковых препаратов, но этот вопрос может быть рассмотрен индивидуально в некоторых ситуациях, таких как: тяжелая грибковая инфекция, угрожающая жизни пациента, случаи инфекции центральной нервной системы, остеомиелит, осложненные инфекции мочевыводящих путей и осложненные внутрибрюшные инфекции.
Препараты, используемые для лечения инвазивного кандидоза
Амфотерицин В дезоксихолат 1 мг/кг/день может быть использован для лечения инвазивного кандидоза у новорожденных. В настоящее время имеются ограниченные клинические данные о его использовании в целях терапии инвазивного кандидоза и гематогенного кандидозного менингоэнцефалита (ГКМЭ) у новорожденных в связи с его высокой токсичностью.
Липосомальный амфотерицин В в дозе 2,5–7 мг/кг/сут может быть использован для терапии инвазивного кандидоза у новорожденных и является безопасным. В настоящее время отсутствует конкретная клиническая информация относительно оптимального режима его дозирования при ГКМЭ. Липосомальный амфотерицин В проникает в центральную нервную систему и имеет противогрибковую активность в головном мозге [5]. Амфотерицин В-липидный комплекс (ABLC) в дозе 2,5–5 мг/кг/день внутривенно является альтернативным препаратом для новорожденных.
При инфекциях у новорожденных, вызванных C. albicans, препаратом выбора для проведения целенаправленной терапии является флуконазол в диапазоне доз от 8 до 12 мг/кг/сут внутривенно в ежедневном режиме, при этом в случае кандидемии предпочительно использование дозы 12 мг/кг/сут.
Нет данных доклинических или клинических исследований по его применению при лечении ГКМЭ. Ограничениями к применению флуконазола в терапии инвазивного кандидоза считаются достаточно узкий спектр противогрибковой активности в отношении госпитальных штаммов грибов и фунгистатическое противогрибковое действие [5, 17].
Препаратом выбора при грибковой инфекции у новорожденных, вызванной Candida non-albicans, должен являться препарат группы эхинокандинов. Среди эхинокандинов, зарегистрированных в России, при наличии соответствующих показаний для лечения грибковой инфекции целесообразно использовать у новорожденных микафунгин (микамин), так как это единственный препарат из группы эхинокандинов, разрешенный к применению в неонатальном периоде. Стандартная доза препарата микамин при лечении инвазивного кандидоза у новорожденных составляет 2 мг/кг/сут, при отсутствии положительной клинической динамики или персистенции возбудителя доза может быть увеличена до 4 мг/кг/сут. В комплексе терапии ГКМЭ микамин используется в дозе до 10 мг/кг/сут внутривенно связи с дозозависимым проникновением микафунгина в центральную нервную систему [5, 18]. Каспофунгин в дозе 25 мг/м2/сутки также может быть использован для лечения инвазивного кандидоза у детей. В настоящее время нет доказательств того, что данная дозировка является адекватной для лечения детей с ГКМЭ.
Оптимальная длительность терапии различных форм инвазивного кандидоза должна составлять не менее 14 дней от момента получения первого стерильного (отрицательного) микробиологического посева крови при условии, что нет данных за течение глубокой грибковой инфекции и/или тяжелого стойкого иммунологического дефицита. При поражении центральной нервной системы лечение инвазивного кандидоза должно продолжаться еще в течение 4 недель после ликвидации симптомов инфекции [14].
Профилактика инвазивного кандидоза
- Лечение вагинального кандидоза беременных;
- Соблюдение мер инфекционного контроля в реанимационных отделениях для новорожденных;
- Рациональная антибактериальная терапия у новорожденных;
- Системная противогрибковая терапия с профилактической целью.
Рекомендуемая дозировка флуконазола 3–6 мг/кг (внутривенно или перорально) дважды в неделю приводит к уменьшению колонизации грибами рода Candida и в 91% к снижению инвазивного кандидоза у новорожденных массой менее 1000 г [5, 14, 19]. Следует отметить, что исследования по изучению профилактики флуконазолом проводились в отделениях интенсивной терапии новорожденных с высокой заболеваемостью инвазивного кандидоза (>12%). В большинстве отделений интенсивной терапии новорожденных заболеваемость инвазивным кандидозом составляет 2–5% для новорожденных массой менее 1000 г. Решение об использовании флуконазола с профилактической целью в ОРИТН с частотой инвазивного кандидоза <2% может быть принято в каждом конкретном случае индивидуально с учетом имеющихся у пациента факторов риска [6, 20].
Таким образом, в качестве антимикотической профилактики необходимо использовать флуконазол в дозах 3–6 мг/кг/сут 2 раза в неделю внутривенно или перорально у всех новорожденных массой при рождении менее 1000 г в отделениях интенсивной терапии новорожденных с высокой частотой инвазивного кандидоза. В отделениях с более низкой частотой инвазивного кандидоза (то есть <2%) у новорожденных массой менее 1000 г решение об использовании флуконазола в дозах от 3 до 6 мг/кг/сут 2 раза в неделю внутривенно или перорально принимается только при наличии у них соответствующих факторов риска [3, 6, 20, 21].
5. Пероральное применение пробиотиков, лактобактерий и лактоферрина.
Пероральное введение Lactobacillus casei подвида rhamnosus предназначено для предотвращения создания микробиологической ниши для Candida spp. в кишечнике. Применение лактоферрина в дозе 100 мг/сут самостоятельно или в комбинации с Lactobacillus rhamnosus GG, значительно снижает заболеваемость поздним сепсисом у новорожденных с ОНМТ при рождении (<1500 г). Бычий лактоферрин не влияет на колонизацию грибами рода Candida, но снижает частоту инвазивного кандидоза в группе новорожденных с ОНМТ [3, 6, 21].
Заключение
Таким образом, соблюдение указанных выше мер профилактики инвазивного кандидоза может вести к дальнейшему снижению его частоты в ОРИТН, способствовать повышению выживаемости в группе новорожденных с ОНМТ и ЭНМТ при рождении и уменьшению фармако-экономических затрат на их лечение.



