Преждевременные роды (ПР) с преждевременным разрывом плодных оболочек (ПРПО) являются актуальной проблемой в области акушерства и неонатологии – каждый десятый ребенок в мире рождается раньше срока [1]. Около миллиона преждевременно рожденных ежегодно умирают от осложнений (смертность до 28%); у 8–10% выживших детей развивается детский церебральный паралич (ДЦП), у 5–8% – умственная отсталость, у 3–5% –декомпенсированная гидроцефалия, у 2–3% – эпилепсия, у 3% – слепота, у 1% –тугоухость. В среднем, инвалидизация составляет около 44% [2]. Тяжесть осложнений, связанных с недоношенностью, обратно пропорциональна гестационному сроку при рождении [3]. Около 30–40% случаев ПР обусловлены инфекцией, каждая третья пациентка с ПРПО при недоношенной беременности имеет положительные результаты посевов содержимого из генитального тракта [4]. Роль инфекции при ПР с ПРПО снижается с увеличением срока: в 22–27 недель лидирует инфекционный фактор и врожденная патология, в 28–33 недели инфекция обнаруживается в 50% случаев, с 34-х недель ПР с ПРПО не связанны с инфекцией более чем в половине случаев [5]. Плацентарный барьер является мощной преградой на пути проникновения инфекции от матери к плоду [6] – инфицированные женщины и женщины носительницы условно-патогенной флоры нередко рожают детей без признаков внутриутробной инфекции (ВУИ). В то же время, ПРПО часто ассоциировано с осложнениями – манифестацией инфекции с клиникой хориоамнионита, септицемии, эндометрита, преждевременной отслойки нормально расположенной плаценты (ПОНРП), послеродовой гипотонии матки у матери, способствует компрессии пуповины, легочной гипоплазии у плода, рождению новорожденного с респираторным дистресс-синдромом, неонатальным сепсисом, а также приводит к контрактурам суставов и деформации костей в антенатальном периоде жизни новорожденного [7]. Скрытое течение наиболее значимых перинатальных инфекций определяет приоритетность ранней диагностики ВУИ, оценки риска ВУИ плода и новорожденного при ПР с ПРПО в акушерской практике, поскольку позволяет выбрать адекватную программу ведения и лечения беременной. Однако, абсолютно достоверных способов диагностики и прогноза ВУИ не существует, несмотря на активные поиски различных методов и биомаркеров [8–10]. Инфицирование при беременности не всегда завершается развитием инфекционного процесса. В то же время, легкая и бессимптомная инфекция у беременной может вызвать тяжелое поражение и гибель плода. В этой связи крайне актуальным является поиск факторов и маркеров, позволяющих принять правильное решение о тактике ведения беременности с ПРПО и времени родоразрешения в сроке 24–33 недели беременности. Выбор оптимальной тактики ведения пациенток с ПРПО, прогнозирование реализации ВУИ плода позволит снизить перинатальную заболеваемость и смертность.
Функциональная супрессия адаптивного иммунитета на фоне физиологически протекающей беременности повышает значимость неспецифических компонентов иммунной системы. К неспецифическим белковым факторам защиты организма матери и плода от инфекции относятся белки, обладающие иммуномодуляторными свойствами. В их числе – лактоферрин (ЛФ) и альфа-2-макроглобулин (а2-МГ).
Данные белки играют существенную роль не только в первичной защите организма беременной и плода от внедрения возбудителей, но и в развитии воспаления при распространении инфекции, если первичная защита была неэффективна [11].
Известно, что ЛФ обладает мощным антибактериальным и противовирусным потенциалом, а2-МГ и альфа-1-антитрипсин (а1-АТ) активно участвуют в распознавании и нейтрализации инфекционных агентов и все три белка модулируют синтез цитокинов [6, 11, 12]. При этом ЛФ локально синтезируется эпителием, а также экскретируется из нейтрофилов при воспалении (позитивный реактант); а2-МГ, альбумин и а1-АТ синтезируются печенью (а2-МГ и альбумин – негативные реактанты воспаления, а1-АТ – позитивный).
Цель исследования – оценка содержания ЛФ, а2-МГ, а1-АТ и альбумина в крови беременных при ПРПО в прогнозе состояния новорожденных.
Материалы и методы
Исследование проводили на базе Клинического родильного дома ГАУЗ Кемеровской области «Новокузнецкий перинатальный центр» и женской консультации №1 ГБУЗ Кемеровской области «Городская клиническая больница №2».
В исследовании участвовали 120 беременных, разделенных на 4 группы: 1-я – 27 здоровых женщин, обследованных при сроке беременности 24–33 недели, с физиологически протекавшей беременностью, родивших здорового доношенного ребенка (контроль); 2-я – 35 женщин с ПРПО при сроке беременности 24–33 недели, в момент спонтанного излития околоплодных вод, родивших недоношенных детей без признаков ВУИ; 3-я – 30 женщин с ПРПО при сроке беременности 24–33 недели, в момент спонтанного излития околоплодных вод, родивших недоношенных детей с легким течением ВУИ (локальные формы: конъюнктивит (n=24), лимфаденит (n=2), пиодермия (n=4); 4-я – 28 женщин с ПРПО при сроке беременности 24–33 недели, в момент спонтанного излития околоплодных вод, родивших недоношенных детей с тяжелым течением ВУИ (генерализованные формы: ранний неонатальный сепсис (n=11), разлитая герпетическая (n=2), хламидийная (n=1) и кандидозная (n=3) инфекции, а также пневмония (n=9) и менингит (n=2).
Во всех случаях роды происходили через естественные родовые пути.
Исследование соответствовало этическим стандартам, разработанным в соответствии с Хельсинкской декларацией ВМА; у всех женщин, участвовавших в исследовании, было получено информированное согласие. Критерии исключения: наличие онкологических, аутоиммунных и хронических воспалительных заболеваний органов малого таза, а также онкопролиферации в анамнезе, острых воспалительных заболеваний на момент обследования, декомпенсированной сердечно-сосудистой, дыхательной, печеночной либо почечной недостаточности, беременности с АВО- и резус-изосенсибилизацией или ВИЧ.
Содержание ЛФ в сыворотке венозной крови определяли методом твердофазного иммуноферментного анализа, уровни а2-МГ и а1-АТ – методом количественного ракетного иммуноэлектрофореза с использованием исследовательских тест-систем, разработанных под руководством профессора Зорина Н.А. и коммерческих стандартов, альбумина – стандартным биохимическим методом.
После проверки нормальности распределения использовали непараметрические методы статистической обработки результатов исследования. В качестве описательных статистик применяли медиану и интерквартильный размах – Ме(Q1;Q3). Сравнение концентраций ЛФ, а2-МГ и а1-АТ в сыворотке венозной крови между группами исследования (группа контроля, ПРПО без ВУИ, ПРПО ВУИ – легкое течение, ПРПО-ВУИ – тяжелое течение) проводили критерием Краскела–Уоллиса с апостериорными тестами Коновера–Инмана. Для построения решающих правил прогноза наличия и степени тяжести ВУИ у новорожденного при ПРПО (группирующий признак имеет 3 градации: отсутствие ВУИ, ВУИ – легкое течение, ВУИ – тяжелое течение) по уровню иммунорегуляторных и транспортных белков в сыворотке крови матери применялся дискриминантный анализ с пошаговым отбором переменных на основе значения критерия F (включение при F>3,84). С целью соблюдения условия применения дискриминантного анализа исходные данные были преобразованы трансформацией Бокса–Кокса (параметр для МГ λ=0,32, для АТ λ=0,037), с последующим обратным преобразованием полученных результатов. Различия считали статистически значимыми при p<0,05.
Все вычисления проводили в свободной программной среде статистических расчетов с открытым исходным кодом Rv.3.5.2.
Результаты и обсуждение
Установлено, что в сыворотке венозной крови женщин при ПРПО в сроке 24–33 недели, независимо от состояния ребенка, повышен уровень ЛФ и снижен уровень альбумина, в сравнении с контрольной группой здоровых беременных в аналогичном сроке (табл. 1). Известно, что ЛФ блокирует жизнедеятельность бактерий путем связывания железа в их микроокружении. Высокое сродство к ионам металлов, с изоляцией иона за счет конформационной перестройки молекулы при связывании эффективно снижает инвазию, хотя и не блокирует ее полностью [11]. Являясь компонентом врожденного иммунитета, ЛФ также способен, прямо или опосредовано, оказывать воздействие на адаптивный иммунный ответ, регулируя пролиферацию, дифференциацию и активацию иммунокомпетентных клеток. Показано, что ЛФ способствует дифференциации моноцитов в дендритные клетки, активирующие в свою очередь Тh1- лимфоциты, снабжая Т-клетки железом, белок индуцирует их пролиферацию. Помимо этого, белок может активировать В-клетки, способствовать увеличению количества NK-клеток, а также усиливать фагоцитоз, хемотаксис нейтрофилов, модулировать миелопоэз, стимулировать гиперчувствительность и взаимодействовать с кератиноцитами [11].
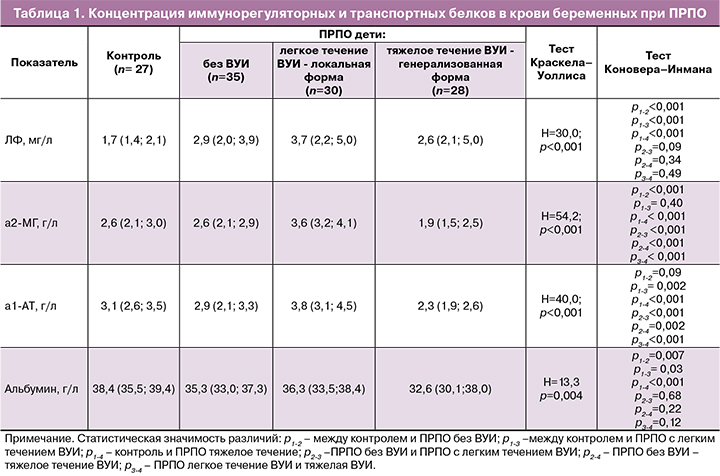
Обнаруженные нами повышенные концентрации ЛФ в крови беременных при ПРПО, по всей вероятности, являются следствием активного высвобождения депонированного в нейтрофилах белка, свидетельствуют о наличии воспалительной реакции на фоне носительства возбудителей персистирующих инфекций и способствующей развитию преждевременных родов с ПРПО. Однако, подобный выброс может стимулировать адаптивный иммунитет и, при сохранении барьерных функций плаценты, преждевременные роды заканчиваются рождением детей без признаков ВУИ или с легким ее течением (локальные формы: конъюнктивит и т.д.). Выявленное нами повышенное содержание ЛФ при ПРПО коррелирует с повышением содержания маркера воспаления – С-реактивного белка, обнаруженное при преждевременных родах другими авторами [13], что подтверждает воспалительную природу повышения ЛФ. Сниженная концентрация транспортного белка альбумина (отрицательного реактанта воспаления) в крови беременных при ПРПО – дополнительное доказательство воспалительной реакции при данной патологии беременности.
Уровень а2-МГ в крови беременных при ПРПО и рождении недоношенных детей без признаков ВУИ в раннем неонатальном периоде (2-я группа, табл. 1) не отличался от показателей здоровых беременных в аналогичном сроке, был существенно выше нормы при рождении детей с легкими формами ВУИ (на 38%, 3-я группа) и, напротив, резко снижен в случаях рождения детей с тяжелой инфекцией (на 27%, 4-я группа). Способность ингибировать ферменты–гидролазы бактерий является основным защитным механизмом, реализуемым а2-МГ [11]. Повышение уровня а2-МГ в крови беременных при рождении детей с признаками локальных форм ВУИ может быть ассоциировано с накоплением поврежденных свободными радикалами комплексов а2-МГ с иммунорегуляторными факторами, что оказывает негативное влияние на обменные процессы, но не связано с нарушениями проницаемости плацентарного барьера. О накоплении белка в циркуляции в результате его повреждения супероксидными радикалами при воспалительной реакции у женщин с носительством возбудителей персистирущих инфекций, при хронических инфекциях сообщается и другими авторами [11]. Резко сниженная концентрация а2-МГ в крови беременных женщин с ПРПО при рождении детей с тяжелыми формами ВУИ связана не только с активным расходованием пула данного ингибитора протеиназ при наличии распространенной персистирующей инфекции, но и с возможным подавлением его синтеза инфекционными агентами, а также с врожденным дефектом синтеза а2-МГ, изначально способствующим хронизации инфекционного процесса, нарушению плацентарного барьера и развитию тяжелых форм ВУИ у плода и новорожденного. Ранее установлено, что бактериальные гидролазы успешно атакуют клетки организма хозяина только в условиях локального дефицита их ингибиторов и, в первую очередь, серпинов (а1-АТ) и а2-МГ [11, 12].
О наличии врожденных дефектов синтеза перечисленных выше ингибиторов протеиназ свидетельствуют и результаты нашего изучения концентрации а1-АТ. Как показало исследование, изменения сывороточных концентраций а1-АТ были аналогичны вышеописанным для а2-МГ: неизменный уровень в крови беременных при ПРПО и рождении ребенка без признаков ВУИ в раннем неонатальном периоде, высокий – при локальных формах с легкой степенью течения ВУИ и резко сниженный при тяжелых ВУИ, в сравнении с показателями данного белка в крови беременных женщин контрольной группы, родивших здоровых детей. Альфа1-АТ является позитивным реактантом воспаления, обладающим иммуномодуляторными, противовоспалительными, противоинфекционными свойствами и способствующим восстановлению тканей [12]. Концентрация а1-АТ при беременности повышается [14], существенно выше нормы значения данного белка при патологической беременности [15, 16], его дефицит также ассоциирован с различными осложнениями беременности, в частности с преждевременными родами [17]. На клетках амниона при ПРПО увеличивается количество окисленных инактивированных форм а1-АТ что, по мнению авторов, снижает защиту в местах воспаления и способствует развитию хорионамнионита [18].
Таким образом, врожденный или функциональный дефицит а2-МГ и а1-АТ, связывающих протеиназы патогенов, участвующих в презентации иммунокомпетентных клеток и регулирующих цитокиновую сеть, способствуют распространению инфекции, повреждению плацентарного барьера, а также развитию тяжелых ВУИ.
Для построения решающих правил прогноза наличия и степени тяжести ВУИ у новорожденного при ПРПО по уровню иммунорегуляторных и транспортных белков в сыворотке крови матери применялся дискриминантный анализ (табл. 2). В результате было выявлено, что степень тяжести ВУИ при ПРПО непосредственно связана только с показателем а2-МГ (F=61,5, p<0,001), связь c а1-АТ опосредована его корреляцией с а2-МГ (rs=0,89, p=0,001), непосредственной связи а1-АТ и тяжести ВУИ не выявлено (F=0,2, p=0,82).
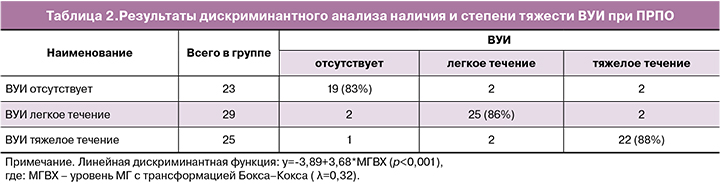
В группе случаев ПРПО с отсутствием ВУИ процент правильно классифицированных составил 83% (19/23), в группе с легким течением ВУИ – 86% (25/29), в группе с тяжелым течением ВУИ – 88% (22/25). Общая точность классификации составила 86% (66/77). В результате анализа линейных дискриминантных функций Фишера, путем составления соответствующих неравенств, решения их относительно показателя а2-МГ и проведения обратной трансформации Бокса–Кокса, были найдены критические значения а2-МГ для каждой рассматриваемой группы. При концентрации в крови беременных а2-МГ ≤2,2 г/л в 86% (22/26) при ПРПО прогнозируется высокая вероятность рождения ребенка с тяжелой степенью ВУИ, при уровне а2-МГ ≥3,0 г/л в 85% (25/29) при ПРПО прогнозируется рождение ребенка с легкой степенью инфекции в виде локальных форм, а при уровне а2-МГ в диапазоне от 2,2 до 3,0 г/л при ПРПО вероятность рождения ребенка без признаков инфекции составляет 86% (19/22).
Валидация построенного решающего правила была проведена на 8 беременных женщинах с ПРПО, у которых после излития вод был измерен уровень а2-МГ в сыворотке венозной крови.
У 4 женщин уровень а2-МГ лежал в диапазоне от 2,2 до 3,0 г/л (прогнозируется отсутствие ВУИ), у 2 – <2,2 г/л (прогнозируется тяжелая степень ВУИ) и 2 – 3,0 г/л (прогнозируется легкая степень ВУИ). Прогноз совпал у всех женщин с легкой и тяжелой степенью ВУИ, и у 3/4 женщин без ВУИ (в одном случае было зарегистрировано легкое течение ВУИ вместо его отсутствия). Таким образом, точность классификации на валидационном множестве составила 87% (7/8).
Заключение
Таким образом, выявленное повышение содержания ЛФ, а2-МГ и а1-АТ и сниженное – транспортного белка альбумина в сыворотке крови беременных при ПРПО в сроке 24–33 недели, свидетельствует о развитии системной воспалительной реакции, активации реакции кислородного взрыва в ответ на инфекцию, с сопутствующим накоплением окисленных форм ингибиторов протеиназ, но без критического повреждения барьерной функции плаценты. Повышенное содержание ЛФ, сопровождающееся врожденным либо функциональным дефицитом уровня ингибиторов протеиназ (а2-МГ и а1-АТ), по всей вероятности, приводит к нарушению защитных свойств плацентарного барьера и значительно увеличивает риск развития тяжелой, генерализованной ВУИ у плода и новорожденного. Использование многофакторного дискриминантного анализа позволило установить, что наиболее чувствительным прогностическим маркером в оценке состояния плода и новорожденного является уровень а2-МГ в крови беременной при ПРПО. При концентрации а2-МГ 2,2–3,0 г/л в 86% прогнозируется рождение ребенка без ВУИ, при уровне а2-МГ >3,0 в 85% случаев – легкое течение ВУИ, а при показателе белка <2,2 г/л с вероятностью 86% прогнозируется рождение ребенка с тяжелым течением ВУИ в виде генерализованных форм. Эти изменения необходимо учитывать при выборе тактики ведения беременных с ПРПО: в случаях нормальной или повышенной сывороточной концентрации а2-МГ и а1-АТ – наблюдение и пролонгирование беременности, а при резко сниженных показателях данных белков – срочное родоразрешение на базе акушерского стационара III уровня с целью своевременного лечения тяжелых форм ВУИ у новорожденного и снижения перинатальной смертности.



