Профилактика врожденных пороков развития (ВПР) только фолатами не всегда эффективна, так как фолаты – далеко не единственный микронутриент, необходимый для поддержания клеточного гомеостаза [1]. ВПР возникают как результат нарушения процессов размножения, миграции, дифференциации и апоптоза клеток во время роста эмбриона. Инозитолы (витамин В8), в т.ч. миоинозитол (МИ) и D-хироинозитол (ДХИ), оказывают существенное воздействие на функционирование клеток и тканей всего организма посредством участия во внутриклеточной передаче сигнала от рецепторов инсулина, катехоламинов и других нейромедиаторов, факторов роста, в расщеплении жиров и снижении уровня холестерина в крови и др. [2].
МИ и ДХИ также важны для профилактики макросомии плода (масса тела ребенка более 4000 г или превышение 90-го перцентиля по размерам), которая ассоциирована с повышенным риском мертворождения [3]. Факторы риска макросомии включают повышенный уровень глюкозы и триглицеридов в крови матери, ожирение у матери, нарушения менструального цикла, раннее или позднее менархе, ранние потери беременности [4]. Использование комбинации МИ+ДХИ способствует восстановлению овуляторного менструального цикла, повышению качества ооцитов, снижению избыточной массы тела у женщин репродуктивного возраста, профилактике гестационного диабета у беременных [5]. В целом инозитолзависимые белки вовлечены в поддержку функционирования сердечно-сосудистой системы, иммунитета, структуры соединительной ткани, функционирования центральной нервной системы и в процессы роста и развития эмбриона.
МИ и ДХИ отличаются по биологическим свойствам и фармакологическим эффектам. Важным отличием ДХИ от МИ является наличие ДХИ в составе инозитоловых фосфогликанов, опосредующих действие инсулина на клетки. ДХИ более эффективен, чем МИ, в снижении риска фолатрезистентных дефектов нервной трубки [5]. Хемореактомный анализ взаимодействия стереоизомеров инозитола с белками протеома человека указал на различные профили фармакологического действия МИ и ДХИ, включая отличия в воздействии на процессы метаболизма аминокислот с разветвленной цепью, метаболизм фолатов, витаминов РР, В5 и магния, активацию рецептора инсулиноподобного фактора роста-1 (ИФР-1), ингибирование провоспалительных эффектов интерлейкина-1 [6].
Однако фармакологические эффекты лекарств и нутрицевтиков зависят не только от воздействия на активность белков протеома, но и от их влияния на процессы транскрипции генов, т.е. на транскриптом (совокупность всех мРНК транскриптов, синтезируемых в ходе экспрессии генома). Транскриптомные исследования важны для расширения понимания временны́х рамок действия лекарств и нутрицевтиков: ведь воздействие на транскрипцию генов обуславливает более долговременные эффекты веществ (несколько суток) [7].
Хотя транскриптомные исследования молекул in vitro требуют комплекса специального оборудования для анализа экспрессии генов, с использованием новейших методов искусственного интеллекта для анализа «сверхбольших данных» (big data) в Институте фармакоинформатики при ФИЦ ИУ РАН был разработан метод хемотранскриптомного анализа эффектов молекул, основанный на современных методах машинного обучения [8–10].
В настоящей работе представлены результаты хемотранскриптомного исследования дозозависимых эффектов воздействия МИ и ДХИ на транскрипцию 12 716 аннотированных генов человека в эндотелиальных клетках пупочной вены человека (линия HUVEC, стимуляция клеток МИ/ДХИ в 6 различных концентрациях в течение 24 ч). Клетки линии HUVEC – модельная система изучения функции эндотелия, который составляет внутреннюю клеточную выстилку артерий, вен и капилляров и поэтому находится в непосредственном контакте с компонентами и клетками крови. Заметим, что эндотелий является не только барьером между кровью и тканями, но и эндокринным органом. Настоящее исследование позволило установить индивидуальный паттерн транскриптомного действия ДХИ и МИ и выделить молекулярные механизмы синергизма эти двух форм инозитолов.
Материалы и методы
Исходные данные. Результаты транскриптомных экспериментов (например, в базе данных Gene Expression Omnibus, https://www.ncbi.nlm.nih.gov/geo/) представлены в виде таблиц, столбцам которых соответствуют гены, а строкам – соответствующие воздействия на клетку (например, те или иные молекулы). Элементами таблицы являются изменения экспрессии гена при соответствующем воздействии. Каждой такой «таблице транскриптомного эксперимента» соответствуют (1) тип клеток, для которых изучались изменения экспрессии, (2) интенсивность воздействия (прежде всего концентрации воздействующих молекул) и (3) время воздействия (6, 12, 24 ч и др.). Изменения экспрессии оцениваются относительно контроля (как правило, диметилсульфоксид).
Метод хемотранскриптомного анализа таких таблиц, основанный на топологической теории хемографов и позволяющий получать высокоточные алгоритмы для оценки изменений транскрипции, был детальнейшим образом описан ранее и протестирован более чем на 1 млн молекул в работах [8–10]. В цикле работ по хемотранскриптомному анализу были описаны все применяемые методики получения и обработки материалов.
Статистическая значимость повышения/снижения экспрессии генов оценивалась посредством непараметрических тестов Колмогорова–Смирнова так, что значимым считались значение P<0,05.
Биоинформационный анализ. В результате применения методологии хемотранскриптомного анализа к конкретной молекуле получается список генов, для которых показано достоверное повышение экспрессии («Список+»), и список генов со сниженной экспрессией («Список-»). К двум полученным спискам генов применяются методы системно-биологического анализа методом функционального связывания. Анализ проводится с использованием аннотации генов в соответствии с международной номенклатурой Gene Ontology (GO), описывающей физиологические функции генов и соответствующих белков [7].
Результаты и обсуждение
Действие МИ на эндотелиальные клетки пупочной вены HUVEC было связано с достоверными изменениями транскрипции (более 5% на 1 мкмоль вещества, коэффициент корреляции более 0,40) для 6516 генов: экспрессия 4085 генов повысилась, а 2431 генов – снизилась. Для ДХИ достоверные изменения транскрипции установлены для 6087 генов (экспрессия 4364 генов повысилась, 1723 генов – снизилась).
Транскрипционные эффекты МИ и ДХИ количественно оценивались как доля изменения транскрипции на 1 мкмоль вещества (например, «0,1» соответствует 10% изменению). Совместный анализ этих эффектов для молекул МИ и ДХИ (рис. 1) позволил выделить 6 классов транскриптомного синергизма МИ и ДХИ: (I) гены, экспрессия которых увеличивается под воздействием и МИ, и ДХИ (n=1809), (II) гены, экспрессия которых снижается под воздействием и МИ, и ДХИ (n=626), (III) гены, экспрессию которых ДХИ существенно усиливает по сравнению с МИ (n=2113), (IV) гены, экспрессию которых ДХИ существенно снижает по сравнению с МИ (n=830), (V) гены, снижение экспрессии которых под воздействием МИ нивелирует ДХИ (n=302), (VI) гены, повышение экспрессии которых под воздействием МИ нивелирует ДХИ (n=200).

Собственно синергизм между МИ и ДХИ описывается группами генов в кластерах III–VI, так как гены в кластерах I и II описывают транскрипционные эффекты, общие для МИ и ДХИ. При воздействии обеих молекул достоверно увеличивается экспрессия генов, вовлеченных в активацию дифференцировки клеток, регуляцию секреции инсулина и артериального давления, морфогенез плода, сигнальные пути ряда нейропептидов. Экспрессия была достоверно снижена для генов, белки которых вовлечены в дегрануляцию нейтрофилов, хемотаксис, торможение ангиогенеза, апоптоз нейронов, сплайсинг РНК и репарацию ДНК, метаболизм триглицеридов, торможение трансляции (т.е. синтеза белков). В целом экспрессия генов, участвующих в поддержке сердечно-сосудистой системы, нервной системы, роста и дифференцировки клеток и углеводного метаболизма повышается с возрастанием концентрации МИ и ДХИ (рис. 2).

Интересно отметить, что и МИ, и ДХИ изменяли экспрессию генов, вовлеченных в отклик организма на 49 препаратов; отдельные примеры приведены в таблице 1. МИ/ДХИ повышали экспрессию генов, опосредующих эффекты анксиолитиков, антидепрессантов, седативных средств. Повышение экспрессии соответствующих генов может повышать эффективность терапии этими препаратами на фоне приема МИ/ДХИ.
При рассмотрении синергизма МИ и ДХИ очевидно, что кластеры генов I и II (в которых МИ и ДХИ проявляют сопоставимые эффекты на транскрипцию) могут использоваться в качестве групп сравнения для кластеров III–VI, что позволяет рассчитать общий балл синергизма для каждой рассматриваемой функциональной категории. Результаты расчетов баллов синергизма для всех анализированных функциональных категорий генов показали, что, несмотря на большое количество рассмотренных функциональных категорий генов (более 1000), только первые 40–50 категорий характеризовались существенно более высокими значениями балла «транскриптомного синергизма» между МИ и ДХИ. К этим «синергидным» категориям относились гены, связанные с морфогенезом (морфогенез костно-мышечной системы, эмбриональный морфогенез конечностей, морфогенез артерий, морфогенез волосяного фолликула, дифференцировка миобластов, регуляция аксоногенеза, пролиферация нейробластов, активность рецептора галанина, регуляция дифференцировки Т-клеток, сигналы mTOR), в т.ч. апоптозом (внутренний апоптотический сигнальный путь медиатора класса p53, негативная регуляция апоптотического сигнального пути), липидным обменом (активность белка-переносчика липидов, синтез липопротеинов высокой плотности, позитивная регуляция этерификации холестерина, бета-окисление жирных кислот с использованием ацил-КоА-дегидрогеназы) и др.
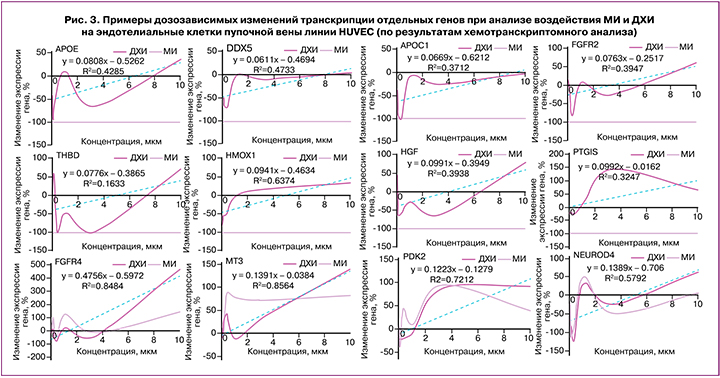
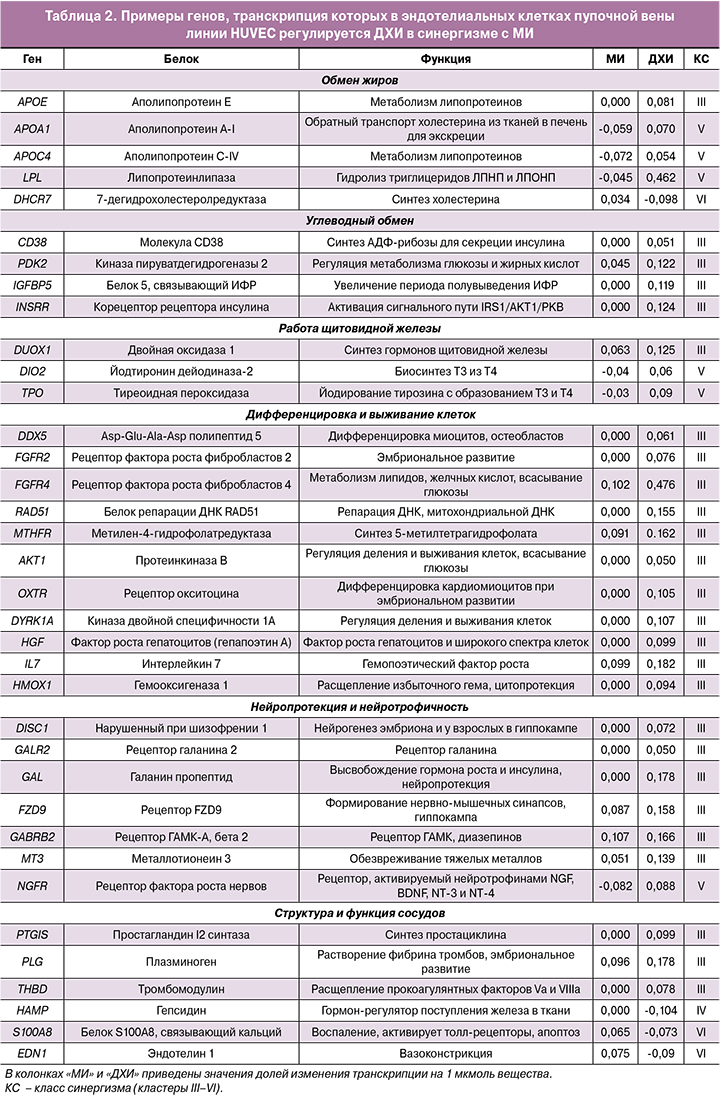
В таблице 2 и на рисунке 3 приведены примеры генов, транскрипция которых регулируется ДХИ в синергизме с МИ. Эти гены относятся к 6 функциональным группам: обмен жиров, углеводный обмен, работа щитовидной железы, дифференцировка и выживание клеток, нейропротекция и нейротрофичность, структура и функция сосудов. Большинство генов относится к классам синергизма III (гены, экспрессию которых ДХИ существенно усиливает по сравнению с МИ) и V (гены, снижение экспрессии которых под воздействием МИ нивелируется молекулой ДХИ). Далее последовательно рассмотрены отдельные примеры этих генов.
Транскриптомный синергизм МИ и ДХИ в нормализации жирового обмена
С нуклеотидными дефектами гена APOE ассоциирована гиперлипопротеинемия 3-го типа (характеризующаяся накоплением липопротеинов промежуточной плотности, богатых холестерином, ксантомами, атеросклерозом) [11]. Аполипопротеин C1 (ген APOC1) ингибирует связывание липопротеинов с рецепторами липопротеинов низкой и очень низкой плотности (ЛПНП и ЛПОНП), связывает свободные жирные кислоты и уменьшает их внутриклеточную этерификацию [12]. Рецептор липопротеинов (ген LSR) осуществляет клиренс липопротеинов, богатых триглицеридами, из крови. Повышение экспрессии генов APOE, APOC1, LSR посредством ДХИ будет способствовать улучшению липидного профиля. ДХИ, по сравнению с МИ, существенно усиливал экспрессию аполипопротеинов Е, С1 и рецептора липопротеинов LSR (класс синергизма III). Аполипопротеин Е (ген APOE) опосредует связывание, интернализацию и катаболизм липопротеиновых частиц, является лигандом рецептора ЛПНП и рецептора APOE в тканях печени.
Аполипопротеины А-II (ген APOA2) и C-IV (ген APOС4) стабилизируют структуру ЛПВП и влияют на метаболизм ЛПВП. Липопротеинлипаза (ген LPL) гидролизует триглицериды ЛПНП и ЛПОНП, устраняя их из кровеносного русла. Иначе говоря, именно ДХИ важен для повышения экспрессии генов APOA1, APOA2, APOС4 и LPL.
МИ снижал экспрессию аполипопротеинов А-I, II, С-IV и липопротеинлипазы, а ДХИ нивелировал эти эффекты МИ (класс синергизма V). Аполипопротеин А-I (ген APOA1) участвует в экскреции холестерина, способствуя транспорту холестерина из тканей в печень и выступая в качестве кофактора для лецитин-холестерин-ацилтрансферазы. Нуклеотидные дефекты гена APOA1 ассоциированы с преждевременной ишемической болезнью сердца, снижением оттока внутриклеточного холестерина из клеток, периферической невропатией и амилоидной нефропатией [13].
Транскриптомный синергизм МИ и ДХИ в поддержании углеводного обмена
Имеются данные о позитивном воздействии МИ и ДХИ на обмен жиров и углеводов. Прием МИ и ДХИ (в соотношении 5:1, в составе средства «Дикироген») в течение 180±3 дней пациентками 23–37 лет с нерегулярным менструальным циклом приводил к уменьшению окружности талии, выраженности акне, снизилось количество баллов по шкале Гамильтона и опроснику SF36 [14]. Прием Дикирогена не только способствовал нормализации абнормально длинного менструального цикла, но и сопровождался снижением массы тела (-3 кг), уменьшением окружности талии (-2,5 см), снижением уровня глюкозы, свободного тестостерона, увеличением уровня фолликулостимулирующего гормона и снижением уровня лютеинизирующего гормона в сыворотке крови [15].
В настоящем исследовании ДХИ, в отличие от МИ, существенно повышал экспрессию ряда генов, влияющих на эффекты инсулина и метаболизм глюкозы (класс синергизма III). Молекула CD38 (кодируемая геном CD38) синтезирует вторичные мессенджеры-молекулы (циклическую АДФ-рибозу, никотинат-адениндинуклеотидфосфат) для секреции инсулина под воздействием глюкозы. Киназа пируватдегидрогеназы 2 (ген PDK2) регулирует метаболизм глюкозы и жирных кислот и повышение ее экспрессии под воздействием ДХИ, ускоряет цикл Кребса, улучшает клеточные реакции на инсулин, способствуя поддержанию нормального уровня глюкозы в сыворотке крови и предотвращению накопления кетоновых производных [16]. Белок-5, связывающий инсулиноподобный фактор роста (ИФР), ген IGFBP5, связывает ИФР и продлевает его период полувыведения. Корецептор рецептора инсулина (ген INSRR) активируется повышением внеклеточного рН, включает сигнальный путь IRS1/AKT1/PKB [17]. Описанные эффекты указывают на транскриптомные воздействия ДХИ, существенно дополняющие эффекты МИ на углеводный обмен.
Транскриптомный синергизм МИ и ДХИ в поддержании функции щитовидной железы
Тиреоидная пероксидаза (ген TPO) йодирует тирозин с образованием гормонов щитовидной железы Т3 и Т4. Йодтиронин дейодиназа-2 (ген DIO2) осуществляет дейодирование Т4 (3,5,3’,5’-тетрайодтиронина) в Т3 (3,5,3’-трийодтиронина) и необходима для обеспечения мозга достаточными уровнями Т3 на протяжении всего периода развития плода. Таким образом, ДХИ стимулирует транскрипцию генов, вовлеченных в синтез тиреоидных гормонов. ДХИ существенно усиливал экспрессию двойной оксидазы 1 (ген DUOX1), необходимой для активности тиреопероксидазы, участвующей в синтезе гормонов щитовидной железы [18]. ДХИ нивелировал снижение экспрессии генов TPO и DIO2, происходящее под воздействием МИ (класс V синергизма).
Транскриптомный синергизм МИ и ДХИ в процессах дифференцировки и выживания клеток
Практически все гены в этой группе (табл. 2) относились к классу синергизма III (гены, экспрессию которых ДХИ существенно усиливает по сравнению с МИ). ДХИ способствует повышению экспрессии генов, кодирующих рецепторы факторов роста фибробластов (ФРФ). Рецептор-2 ФРФ (ген FGFR2) регулирует деление, дифференцировку, миграцию и апоптоз клеток, необходим для нормального формирования эмбриона, функции трофобласта, развития зачатков конечностей, морфогенеза легких, костей и кожи [19]. С нуклеотидными дефектами гена FGFR2 ассоциирован синдром Крузона. Рецептор-4 ФРФ (ген FGFR4) регулирует деление, дифференцировку, миграцию клеток, метаболизм липидов, биосинтез желчных кислот, всасывание глюкозы, метаболизм витамина D и фосфатов через сигнальные пути RAS, MAPK1/ERK2, MAPK3/ERK1, AKT1 [20]. ДХИ также нивелировал снижение экспрессии рецептора ФРФ-1 (ген FGFR1), необходимого для нормального формирования мезодермального паттерна и правильной осевой организации, скелетогенеза и нейрогенеза во время эмбрионального развития, секреции гонадотропин-рилизинг-гормона через участие в сигнальных каскадах GRB2, PIK3R1, RAS, MAPK1/ERK2, MAPK3/ERK1, AKT1, CREB1 [21].
ДХИ позитивно влиял на экспрессию и других генов, участвующих в гомеостазе ростовых факторов: HGF, IL7, OXTR. ДХИ (но не МИ), повышал экспрессию фактора роста гепатоцитов (гепапоэтин А, ген HGF) – митогена зрелых гепатоцитов и ряда других типов клеток [22]. С нуклеотидными дефектами гена HGF ассоциирована прелингвальная нейросенсорная тугоухость-9. Интерлейкин-7 (ген IL7) – гемопоэтический фактор роста, стимулирующий деление лимфоидных клеток-предшественников и созревание В-клеток. Окситоциновый рецептор (ген OXTR) осуществляет эффекты окситоцина, не только стимулирующего выделение молока при лактации, но и содействующего дифференцировке кардиомиоцитов при эмбриональном развитии, улучшая регенерацию мышц [23].
Повышение экспрессии протеинкиназы B (ген AKT1) под воздействием ДХИ важно для регулирования метаболизма, деления и выживания клеток, роста тканей и ангиогенеза. AKT1 регулирует всасывание глюкозы, опосредуя индуцированную инсулином транслокацию транспортера глюкозы SLC2A4/GLUT4 на клеточную мембрану, регулирует хранение глюкозы в форме гликогена путем фосфорилирования киназ гликогенсинтетазы GSK3A и GSK3B.
Проведенный анализ позволил сформулировать еще один механизм синергизма между инозитолами и фолатами в профилактике ВПР. Так, ДХИ повышал экспрессию метилентетрагидрофолатредуктазы (ген MTHFR), трансформирующей 5,10-метилентетрагидрофолат в биологически активную форму 5-метилтетрагидрофолат для превращения гомоцистеина в метионин.
Антиоксидантные эффекты ДХИ могут быть связаны с повышением экспрессии гена гемоксигеназы-1 (HMOX1). Активность гемоксигеназы-1 наиболее высока в селезенке, где происходят секвестрация и разрушение стареющих эритроцитов. С нуклеотидными дефектами гена HMOX1 ассоциированы нарушения кроветворения при стрессе, фрагментация эритроцитов, внутрисосудистый гемолиз, нарушения коагуляции, повреждения эндотелия и отложения железа в тканях почек и печени, задержка роста ребенка и гепатомегалия [24]. Можно предположить, что ДХИ способствует улучшению кроветворения и нормализации процессов роста тканей плода.
Транскриптомный синергизм МИ и ДХИ в осуществлении нейропротекторного и нейротрофического действия инозитолов
Отметим, что описанный ниже потенциальный нейропротекторный и нейротрофический синергизм МИ и ДХИ, установленный в настоящем исследовании с использованием хемотранскриптомики клеток эндотелия вены пуповины, целесообразно подтвердить в соответствующих анализах нейрональных клеток-предшественников. Тем не менее известно, что инозитолы действительно проявляют выраженное нейропротекторное действие. Например, в модели глутаматного стресса на зернистых нейронах мозжечка МИ повышал выживание нейронов на +17%, что существенно выше эффектов других средств, которые обычно используются для нейропротекции (пептидные экстракты: +10%, холиновые препараты: +3%) [25]. Нейропротекторное действие инозитолов указывает на важность их использования с целью нейропротекции головного мозга плода во время беременности для профилактики пороков его развития. Нейропротекторное действие ДХИ также может осуществляться через повышение экспрессии рецептора ГАМК-А и потенциалзависимого калиевого канала «шейкер-1» (ген KCNA1), который предотвращает гипервозбудимость нейронов [26], рецептора-2 галанина (ген GALR2) и самого галанина (ген GAL) [27] и рецептора фактора роста нервов (ген NGFR) – рецептора, активируемого нейротрофинами NGF, BDNF, NT-3 и NT-4 [28].
Еще одним важным механизмом транскриптомного синергизма МИ и ДХИ является повышение экспрессии генов, вовлеченных в сигнальный каскад Wnt/AKT1/GSK3B/mTOR, играющий важнейшую роль в выживании нейрональных клеток-предшественников, позиционировании нейронов, формировании цитоархитектоники коры, развитии дендритов и образовании синапсов [29]. Уточнение нейропротекторных и нейротрофических эффектов ДХИ требует проведения отдельного хемотранскриптомного исследования на нейроцитах.
Транскриптомный синергизм МИ и ДХИ в поддержании структуры и функции сосудов
Ранние потери беременности и поздние гестационные осложнения беременности зачастую связаны с эндотелиальной дисфункцией и тромбофилией. Эндотелий, являясь комплексным регулятором сосудистой функции, влияет на все три компонента триады Вирхова (повреждение сосудистой стенки, гиперкоагуляция, вазоконстрикция). ДХИ, по сравнению с МИ, существенно повышал экспрессию противовоспалительной простациклинсинтетазы (ген PTGIS) и антикоагулянтных плазминогена и тромбомодулина. Плазминоген (ген PLG) растворяет фибрин тромбов и действует как протеолитический фактор при эмбриональном развитии, также расщепляя фибрин, тромбоспондин и фактор фон Виллебранда [30]. Тромбомодулин (ген THBD) – рецептор эндотелиальных клеток, образующий комплекс с тромбином и активирующий протеин С, который расщепляет прокоагулянтные факторы Va и VIIIa, тем самым уменьшая количество активированного тромбина [31].
Кроме того, ДХИ способствовал снижению экспрессии генов, связанных с обменом железа и вазоконстрикцией. ДХИ снижал экспрессию гена HAMP, кодирующего гепсидин – негативный гормон-регулятор всасывания железа в тканях, который стимулирует эндоцитоз и деградацию ферропортина. Последнее приводит к распаду ферропортина в лизосомах, к задержке железа в экспортирующих железо клетках и к снижению поступления железа в плазму крови. В энтероцитах гепсидин предотвращает поступление железа в портальную систему печени, тем самым снижая всасывание железа с пищей, поэтому избыточная активность гепсидина может приводить к железодефицитной анемии. С нуклеотидными дефектами гена HAMP ассоциирован гемохроматоз [32]. Таким образом, ДХИ участвует в усвоении железа и может способствовать профилактике железодефицитной анемии.
ДХИ способствует снижению экспрессии генов провоспалительного белка S100A8 и вазоконстриктора эндотелина-1. Белок S100A8, связывающий кальций (ген S100A8), активирует воспалительные процессы, индуцируя хемотаксис и адгезию нейтрофилов. Внутриклеточные функции включают перенос и метаболизм арахидоновой кислоты лейкоцитами, активацию нейтрофильной НАДФН-оксидазы. Внеклеточные функции включают активацию лейкоцитов, стимулирование продукции цитокинов и хемокинов, регуляцию адгезии и миграции лейкоцитов, активацию толл-рецепторов TLR4 и рецепторов конечных продуктов усиленного гликирования AGER, активацию сигнальных путей NF-kB. S100A8 может вызывать гибель клеток посредством аутофагии и апоптоза через генерацию активных форм кислорода [33].
Эндотелин-1 (ген EDN1) – вазоконстрикторный пептид эндотелиального происхождения. Также активность эндотелина важна для морфогенеза. С дефектами гена EDN1 ассоциирована аномалия строения ушей, характеризующаяся расщелиной между мочкой и нижней частью завитка, иногда сопровождающаяся выступающей или недостаточно выраженной верхней частью завитка, синдромом черепно-лицевой мальформации, в т.ч. аномалиями строения нижней челюсти, анкилозом височно-нижнечелюстного сустава, расщелиной неба [34].
Таким образом, хемотранскриптомный анализ МИ и ДХИ указал на характерные изменения транскрипции генов, способствующих нормализации обмена жиров, углеводного обмена, работы щитовидной железы, дифференцировки и выживания клеток, нейропротекции и нейротрофичности, структуры и функции сосудов. Проведенный анализ также позволил выделить механизмы «транскриптомного» синергизма МИ и ДХИ.
Заключение
Исследование транскриптомных эффектов фармакологически значимых молекул представляет собой «передовой фронт» современной молекулярной фармакологии. Транскриптомные исследования позволяют установить механизмы действия молекул и детально очертить спектр нарушений, на которые может благоприятно воздействовать исследуемая молекула. Поэтому в постгеномной фармакологии учитывается воздействие веществ не только на таргетные белки, но и на транскрипцию генов.
Настоящее исследование позволило получить значительный массив феноменологических данных о влиянии МИ и ДХИ на транскрипцию. Исследование показало, что комбинированное применение МИ и ДХИ важно для тонкой настройки процессов генной транскрипции. В частности, были выделены группы генов, вовлеченных в осуществление транскриптомного синергизма между МИ и ДХИ в обмене жиров и углеводов, поддержке функции щитовидной железы, морфогенезе плода, нейропротекторных, нейротрофических, ангиопротекторных эффектах. Полученные результаты позволяют ожидать, что нутрицевтическая поддержка беременных с инсулинорезистентностью, дислипидемией, избыточной массой тела будет более эффективной именно при совместном использовании дотаций МИ и ДХИ. Такие дотации, как правило, осуществляются посредством приема средств с определенным соотношением МИ и ДХИ.
В целом, проведенный анализ указывает на перспективы сочетанного применения МИ и ДХИ для нутрицевтической поддержки беременных, в т.ч. для снижения риска инсулинорезистентности и связанных с ней осложнений, макросомии и аномалий развития плода.



