Препараты на основе многоатомных спиртов инозитолов (стереоизомеров циклогексан-1,2,3,4,5,6-гексола) используются для компенсации инсулинорезистентности, особенно у пациенток с нарушениями менструального цикла и функции яичников. Попадая в клетку, стереоизомеры инозитолов фосфорилируются с образованием специфических производных – инозитолфосфатов [1, 2]. Характеризуясь уникальными ролями во внутриклеточной передаче сигнала, инозитолфосфаты принципиально необходимы для обеспечения адекватного уровня чувствительности клеток к различным гормонам (инсулину, фолликулостимулирующему гормону (ФСГ), лютеинизирующему гормону (ЛГ) и др.), факторам роста и нейротрансмиттерам. Известно, что резистентность клеток яичников к инсулину, ЛГ, ФСГ ассоциирована с нарушениями менструального цикла [1].
Систематический анализ молекулярно-физиологических эффектов инозитолов показал, что миоинозитол (МИ) гораздо более изучен, чем D-хироинозитол (ДХИ) и другие формы инозитолов. Известно более 200 инозитолфосфат-зависимых белков, необходимых для передачи внутриклеточных сигналов [3, 4]. Инозитолфосфат-зависимые белки вовлечены в поддержку функционирования репродуктивной системы, менструального цикла, сигнального каскада инсулина, почек, печени, центральной нервной системы и соединительной ткани. МИ принципиально важен для профилактики фолат-резистентных врожденных пороков развития плода (ВПР) [1].
В препаратах используется, как правило, только один стереоизомер – МИ. Систематический анализ биологических ролей и фармакологических свойств ДХИ показал, что ДХИ входит в состав инозитоловых фосфогликанов, являющихся медиаторами действия инсулина. Обмен ДХИ и МИ нарушается на фоне инсулинорезистентности, в т.ч. у пациенток с синдромом поликистоза яичников и гиперандрогенией. Хемореактомный анализ стереоизомеров инозитола указал на существенно различные профили фармакологического действия МИ и ДХИ [5]. Дотации ДХИ и МИ способствуют повышению чувствительности клеток к инсулину, нормализации метаболизма андрогенов и повышению эффективности метформина. Дополнение комбинации МИ+ДХИ фолиевой кислотой (ФК) и пироглутаматом марганца (ПМ) может повысить эффективность лечения инсулинорезистентности и профилактики ВПР [6]. Пироглутамат-анион, в частности, может проявлять дополнительные нейропротекторные, антигипертензивные, седативные и антидепрессивные свойства [7].
Инозитолы, фолаты и ПМ также могут проявлять пребиотические свойства, способствуя росту полезной микробиоты желудочно-кишечного тракта (ЖКТ). Хемомикробиомные скрининги препаратов, проводимые на основе современных информационных технологий анализа больших данных [8, 9], позволяют оценивать эффекты веществ на различные типы бактерий-комменсалов человека и на различные штаммы бактериальных патогенов [10–12]. Учет воздействия на микробиоту ЖКТ важен для оценки баланса «эффективность-безопасность» средств, принимаемых per os, особенно длительными курсами (месяцы). Оценка воздействия рассматриваемых микронутриентов на микробиоту человека также является важной составляющей действия этих молекул.
Цель настоящей работы: сравнительный хемомикробиомный анализ МИ, ДХИ, ФК и ПМ.
Материалы и методы
Химические структуры исследованных молекул приведены на рисунке 1. Хемомикробиомный анализ основан на хемоинформационном подходе [10], теории анализа размеченных графов, теории метрического анализа данных [8], комбинаторной теории разрешимости, топологической теории анализа плохоформализованных задач и новейших методов прогнозирования значений числовых переменных [9].
Для каждой из исследованных молекул были получены оценки значений площади под кривой роста (AUC) для репрезентативной выборки микробиоты человека, включившей 38 бактерий-комменсалов (в т.ч. различные виды бифидо- и лактобактерий) и более 152 бактериальных патогенов, которые более подробно описаны в работах [10–13].
Выборка микробиома включает 21 род бактерий и представляет 78% микробиома ЖКТ. Большинство исследованных штаммов были комменсалами, обнаруженными при относительной численности 1% или более и распространенности не менее 50% в пробах фекалий от здоровых добровольцев с трех континентов. На этой выборке штаммов микробиома для всех молекул, представленных на рисунке 1, были оценены значения AUC, значения стандартных отклонений значений AUC и значения Р статистической достоверности отличий AUC от контроля (стандартная среда выращивания бактерий). На основании информации в базах данных Human Microbiome Project [14], iHMP [15], PubChem [16] оценивались значения минимальных ингибирующих концентраций (MIC) для 152 штаммов патогенных бактерий.
Результаты и обсуждение
Проведенный в настоящей работе хемомикробиомный анализ включил оценки: (1) накопления исследуемых молекул в различных тканях; (2) влияния на площадь под кривой роста бактерий комменсалов (AUC); (3) воздействия на различные метаболические пути нормофизиологической микробиоты; (4) степени переработки исследуемых веществ бактериями микробиома (на бактериях в культуре и у добровольцев с различными профилями микробиома); (5) воздействия на рост штаммов патогенных бактерий.
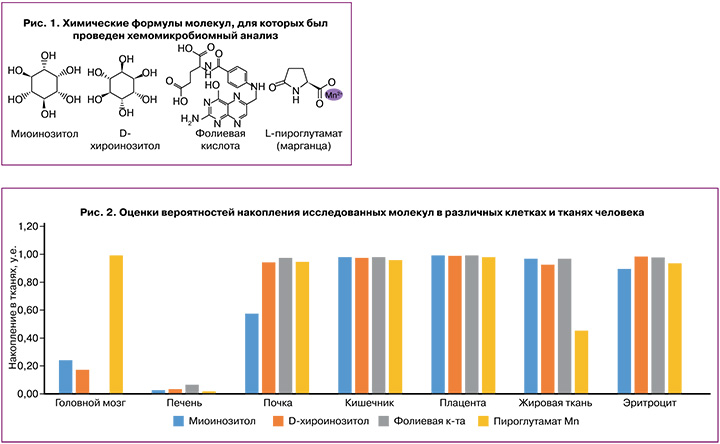
Анализ показал, что исследованные молекулы отличались по накоплению в различных тканях/органах человека. При поступлении в организм все исследованные молекулы практически не накапливаются в печени (оценки вероятности накопления 0,01–0,06. у.е.) и достаточно слабо – в головном мозге (0–0,24 у.е., за исключением ПМ – 0,99 у.е.). В то же время все исследованные молекулы могут хорошо всасываться и накапливаться в эпителиоцитах кишечника, поступая оттуда в эритроциты крови и в почки (0,89–0,98 у.е.) (рис. 2).
В результате проведенного нами хемомикробиомного анализа были получены оценки значений площади под кривой роста бактерий-комменсалов (AUC). Для дальнейшего анализа были отобраны только те данные, которые соответствовали значениям AUC, статистически достоверно отличающимся от контрольных экспериментов (p<0,05 при сравнении со стандартной средой выращивания бактерий, рис. 3А) и со значениями стандартных отклонений значений AUC, не превышающими погрешность метода (в среднем 0,08 у.е. площади под кривой). В среднем по этой выборке нормобиоты человека наибольший вклад в поддержку полезной микробиоты вносил МИ (AUC=0,74±0,17 у.е.), за ним следовали ДХИ и ФК (AUC=0,68–0,71 у.е.). Наименьший вклад вносил ПМ (AUC=0,40±0,32 у.е.).
Из результатов на рисунке 3А очевидно, что оба изомера инозитола и ФК характеризовались схожими профилями воздействия на здоровую полезную микрофлору человека, а профиль микробиомного действия ПМ существенно отличался. В наибольшей степени (AUC=0,8 и более) все исследуемые молекулы поддерживали рост Eggerthella lenta (нормофлора ЖКТ, деконъюгирует желчные кислоты), Bacteroides fragilis (представитель микробиома ЖКТ, участвует в газообразовании), Bacteroides caccae, Coprococcus comes (представители здорового микробиома ЖКТ) и Streptococcus parasanguinis (колонизирует поверхности зубов, представитель микробиома полости рта).
Исследованные молекулы в меньшей степени (значения AUC=0,36–0,45) поддерживали рост бактерий Eubacterium eligens (метаболизируют углеводы и пептоны с накоплением короткоцепочечных жирных кислот – масляной, уксусной, муравьиной), Roseburia intestinalis (снижены при ожирении, глюкозотолерантности), и бактерий, участвующих в гидролизе сложных сахаров – амилозы, пуллулана, мальтоолигосахаридов и др. (Prevotella copri, Collinsella aerofaciens, Bacteroides thetaiotaomicron).
Хемомикробиомный анализ указал на возможное взаимодополняющее действие четырех исследованных веществ. Например, оба изомера инозитола практически не поддерживают рост бактерий Bacteroides thetaiotaomicron (гидролизуют амилозу, амилопектин, мальтоолигосахариды и поддерживают барьерную функцию слизистой кишечника, AUC=0,03–0,04). В то же время рост Bacteroides thetaiotaomicron гораздо сильнее поддерживается ФК (AUC=0,59) и, в еще большей степени, ПМ (AUC=0,79).
Другой пример: МИ достаточно слабо поддерживает рост Eubacterium rectale (микробиота толстой кишки, основной продуцент масляной кислоты, переработка клетчатки, AUC=0,47), а ДХИ поддерживает рост Eubacterium rectale в существенно большей степени (AUC=0,80). С другой стороны, ПМ практически не поддерживает (AUC=0,05–0,1) рост Roseburia intestinalis (продуцируют масляную кислоту, снижены при ожирении, глюкозотолерантности, болезни Паркинсона) и Roseburia hominis (регулируют иммунитет, продуцируя антимикробные пептиды, поддерживая барьерную функцию слизистых и регулируя Т-лимфоциты), в то время как МИ и ДХИ более эффективно поддерживают рост этих бактерий (AUC=0,63–0,68).
Хемомикробиомные оценки воздействий на различные метаболические пути нормофизиологической микробиоты (рис. 3Б) показали, что исследованные вещества могут способствовать повышению биосинтеза убихинона в бактериях микробиома (0,06–0,14 у.е.), снижению активности бактериальной транспортной системы инозитолов (-0,20–-0,67 у.е.) и метаногенеза в ЖКТ (-0,25–-0,72 у.е.). Метаболомные эффекты исследованных веществ (обусловленные, в т.ч., улучшением состояния микробиоты кишечника) также включают потенциальное снижение свободного холестерина плазмы крови (-0,36–-0,81 у.е.), общего холестерина (-0,17–-0,57 у.е.) и триглицеридов плазмы крови (-0,09–-0,34 у.е.) (рис. 3Б). Нормализация липидного профиля крови приводит к снижению эндотелиальной дисфункции сосудов.
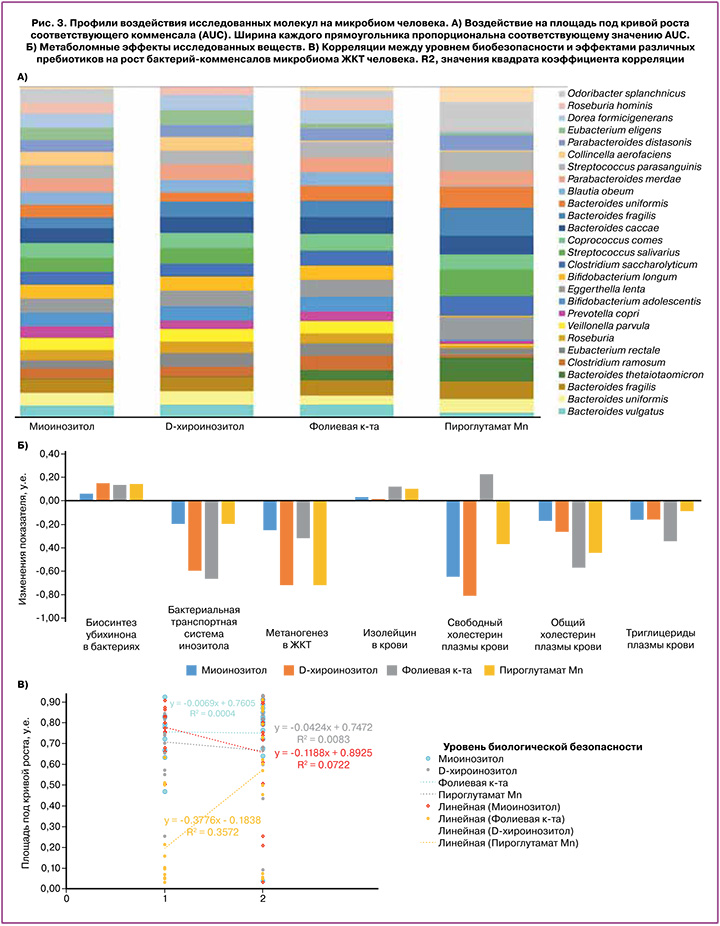
При дальнейшем рассмотрении результатов хемомикробиомного анализа мы использовали значения «уровня биобезопасности» (УББ), которые известны для всех исследованных штаммов микроорганизмов. Значения УББ приблизительно соответствуют различию между «патогенными» и «непатогенными» штаммами с практической точки зрения – необходимым мерам безопасности при проведении экспериментов с данным штаммом.
Так, УББ-1 присущ микроорганизмам, которые не вызывают заболевания у здоровых людей и не требуют специальных правил безопасности работы в лаборатории. УББ-2 соответствует микроорганизмам с умеренной потенциальной опасностью (например, вызывают легкие заболевания у людей, но слабо переносятся воздушно-капельным путем). При работе с этими возбудителями обязательно использование защитной маски, халата, перчаток; рекомендуется использование боксов биологической безопасности [15098644].
Диаграмма на рисунке 3В демонстрирует отличия между воздействием ПМ и других рассмотренных молекул на исследованные штаммы микробиома. В среднем по бактериям МИ, ДХИ и ФК соответствовала меньшая степень поддержки роста бактерий уровня УББ-2, чем бактерий уровня УББ-1 (отрицательные значения наклона корреляционных прямых). В то же время значение наклона корреляционной прямой было существенно выше нуля для ПМ (k=0,38), что соответствует в большей степени поддержке роста бактерий-комменсалов уровня УББ-2.
Хемомикробиомные оценки процента переработки исследуемых веществ микробиомом были получены для бактерий в культуре и для добровольцев с различными профилями микробиома. Оценки для бактерий в культуре (рис. 4А,Б) показали, что в среднем по микробиому наиболее активно перерабатываются ФК (процент переработки=19,3±10,5%) и ДХИ (15,3±11,5%). Несколько менее активно перерабатываются МИ (13,7±7,7%) и ПМ (13,2±11,3%). Наиболее активными бактериями-метаболизаторами исследованных веществ были:
- Bacteroides fragilis (участвует в газообразовании, ATCC43859 –34,1±10,7%, DS-208– 30,5±12,4%, NCTC9343 – 28,6±5,4%);
- Bacteroides thetaiotaomicron 7330 (гидролизует амилозу, амилопектин, мальтоолигосахариды, 26,4±5,4%);
- Clostridium spp. (переработка сахаров, 26,1±4,1%);
- Bacteroides cellulosilyticus DSM14838 (переработка целлюлозы в ацетат, пропионат, сукцинат, 24,2±6,7%).
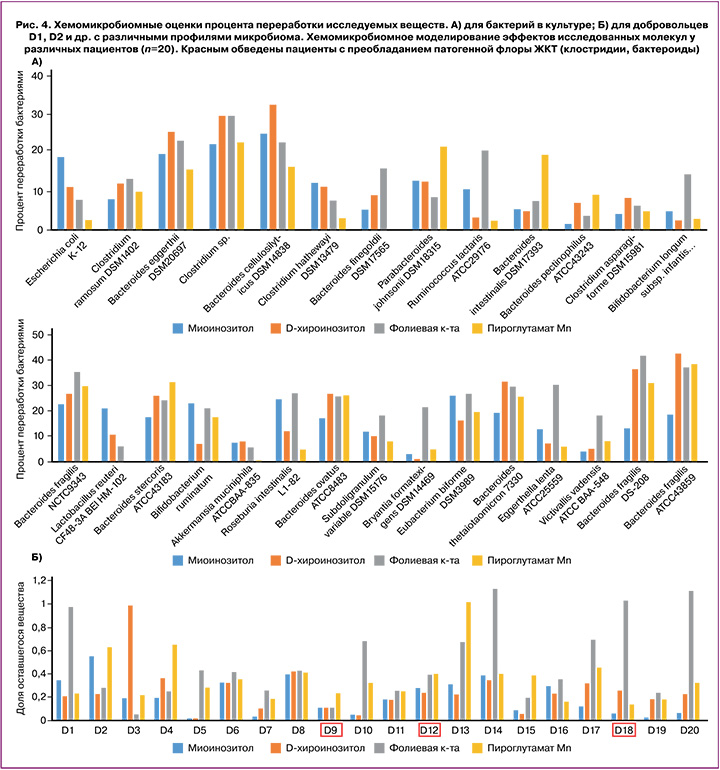
Наименее активными метаболизаторами МИ, ДХИ, ФК и ПМ были пектинолитическая бактерия Bacteroides pectinophilus ATCC43243 (5,3±3,4%) и муцин-разлагающая бактерия Akkermansia muciniphila ATCCBAA-835 (5,3±3,4%).
Результаты хемомикробиомного анализа исследованных молекул у добровольцев с различными профилями микробиома подтвердили, что МИ, ДХИ, ФК не способствуют росту патогенной флоры. В среднем для добровольцев с дисбиозами (преобладание Clostridium perfringens и патогенных бактероидов) не было найдено достоверных отличий в значениях долей не переработанного микробиотой вещества (рис. 4Б) по сравнению с добровольцами со здоровой микробиотой (p>0,21).
О влиянии микробиоты человека, поддерживаемой исследуемыми молекулами, на инсулинорезистентность и углеводный обмен
Крупномасштабные геномные исследования микробиоты человека показали, что определенные нарушения в составе кишечной микробиоты ассоциированы с инсулинорезистентностью и повышенным риском развития сахарного диабета (СД), как 1-го (СД1), так и 2-го (СД2) типа. Например, анализ группы пациенток с гестационным сахарным диабетом (ГСД) показал значительное снижение уровня бактерий-комменсалов, продуцирующих короткоцепочечные жирные кислоты (Faecalibacterium, Prevotella, Streptococcus), а также таких видов, как Bacteroides coprophilus, Eubacterium siraeum, Faecalibacterium prausnitzii, Prevotella copri, Prevotella stercorea при ГСД по сравнению с контролем. На фоне ГСД также чрезмерно возрастают уровни провоспалительных бактерий Alistipes shahii, Alistipes putredinis, Ruminococcus gnavus, Ruminococcus callidus [17].
Анализ состава фекальной микробиоты пациентов с СД2 (n=1039) по сравнению со здоровыми контролями (n=872) указал на снижение уровня Bacteroides uniformis при СД2 [18]. Генотипы высокого риска СД1 (n=73), представленные генотипами DR3, DR4, DR9 человеческого лейкоцитарного антигена (HLA), связаны с дисбалансом кишечного микробиома. Микробиота кишечника этих генетически предрасположенных пациентов характеризуется пониженным содержанием Parabacteroides distasonis [19]. У женщин с микрососудистыми осложнениями СД2 уровни Prevotella и Lactobacillus отрицательно коррелировали с уровнями HbA1c (p<0,05; r=-0,489), Roseburia inulinivorans и Lactobacillus отрицательно коррелировали с уровнем глюкозы в сыворотке крови натощак (p<0,05; r=-0,564) [20].
Индекс массы тела (ИМТ) и микробиота кишечника также демонстрируют значимую взаимосвязь. Анализ образцов фекалий участников с нормальной массой тела (n=24), избыточной массой тела (n=24), ожирением (n=11) и СД2 (n=8) показал, что уровень Streptococcus spp. значительно снижен у пациентов с ожирением и у пациентов, страдающих СД2, по сравнению с субъектами с нормальной массой тела; была выявлена тесная связь между уровнем Streptococcus spp., особенно Streptococcus salivarius, и ИМТ [21].
Подчеркнем, что нарушения микробиоты характерны не только для пациентов с СД2, но и для пациентов с СД1. В частности, в группе пациентов с СД1 (n=35) было обнаружено снижение численности комменсала Streptococcus salivarius в полости рта и в кишечнике и повышение содержания энтеробактерий, которые были связаны с воспалением кишечника у пациентов с СД1 [22]. Показана связь между обилием Prevotella copri в кишечнике и колебаниями уровня глюкозы в сыворотки крови у пациентов с так называемым лабильным сахарным диабетом (СД1, который трудно контролировать, n=10). Обилие Prevotella copri у пациентов с лабильным СД1 в контрольной когорте было значительно ниже, чем у пациентов с контролируемым СД1. Корреляционный анализ показал, что обилие Prevotella copri обратно пропорционально стандартному отклонению уровня глюкозы в сыворотке крови (r=-0,477; p=0,034) [23].
Была проведена серия исследований, показавшая нарушение уровня бифидобактерий при СД2 и положительную роль пробиотиков, содержащих бифидобактерии. У женщин с резистентностью к инсулину (n=92) уровни инсулина отрицательно коррелировали с титрами бифидобактерий (r=-0,22; p=0,04) [24].
Результаты исследований трех основных видов бактерий: Bifidobacterium Teenageris, Bifidobacterium bifidum и Lactobacillus rhamnosus показывают, что использование этих видов бактерий способствует снижению уровня глюкозы в сыворотке крови [25]. Применение пробиотической формулы, включающей штаммы Lactobacillus acidophilus, Bifidobacterium longum infantis и Bifidobacterium bifidum, способствовало улучшению уровня гликемии на модели мышей с диабетической нефропатией [26]. Применение ферментированного молока Bifidobacterium longum способствовало улучшению метаболизма глюкозы и липидов, регулируя микробиоту кишечника у мышей [27].
Оценивалось влияние пребиотиков (30 г рожкового дерева в день) и пробиотиков (Bifidobacterium longum, Lactobacillus helveticus, Lactococcus lactis, Streptococcus thermophilus) на снижение массы тела и метаболические параметры у пациентов с ожирением (n=45). По сравнению с контролем (только диета с пониженной калорийностью, без пробиотиков или пребиотиков) в группе с пребиотиками и пробиотиками наблюдалось значительное снижение жировой массы (p=0,001) и значительное увеличение мышечной силы (p=0,008), значительное снижение уровня глюкозы в сыворотке крови натощак (p=0,02) [28].
В соответствии с вышеприведенными результатами хемомикробиомного анализа МИ, ДХИ, ФК и ПМ могут проявлять пребиотические свойства и поддерживать рост комменсалов из рода бактероидов, стрептококков, бифидобактерий. МИ, ДХИ и ФК оказывали значительную поддержку росту бифидобактерий (AUC более 0,80, см. выше). Таким образом, МИ, ДХИ и ФК, проявляя пребиотические свойства, могут поддерживать рост нормобиоты, важной для регуляции углеводного обмена (что не менее важно для профилактики ВПР, чем «прямое» действие ФК [29]).
Воздействие МИ и других пребиотиков на рост штаммов патогенных бактерий
Хемомикробиомный анализ значений MIC исследованных молекул при воздействии на 152 штамма патогенных бактерий показал, что исследованные вещества могут несколько тормозить рост некоторых патогенов – возбудителей внутрибольничных инфекций (Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumoniae) и грибов Candida albicans (рис. 5). Напомним, что более низкие значения MIC для того или иного вещества соответствуют более эффективному ингибированию бактериального роста этим веществом.
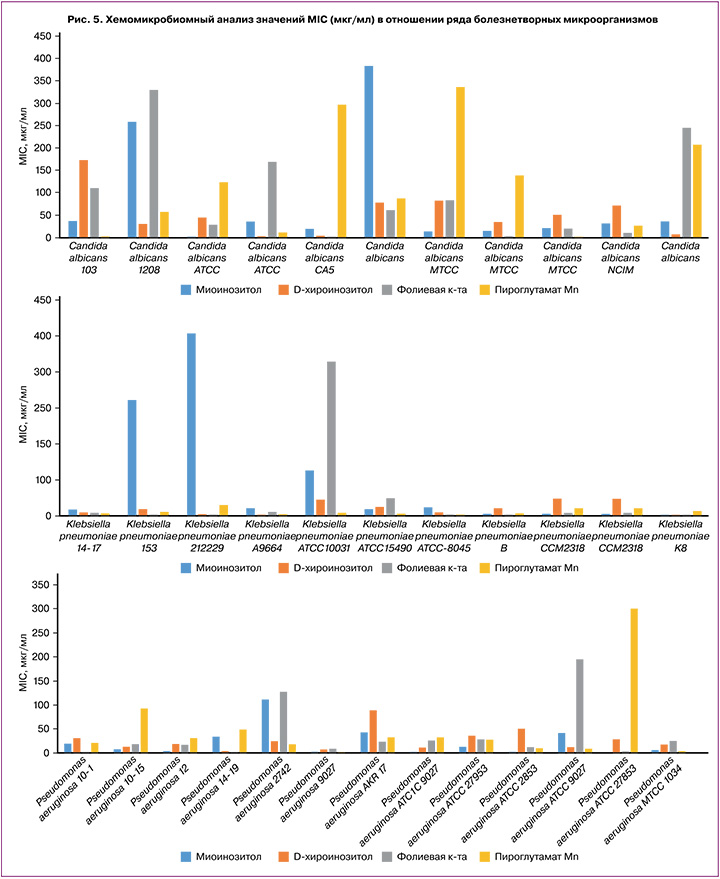
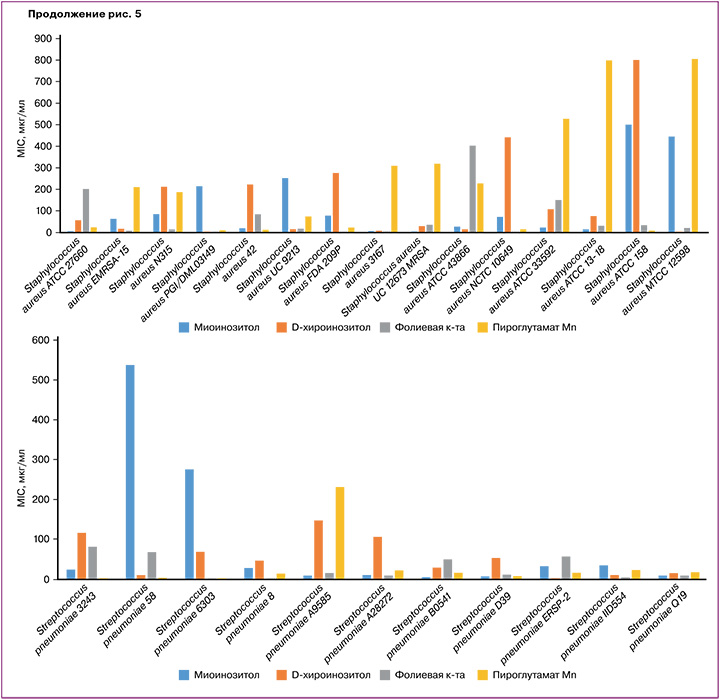
Например, в случае штаммов Candida albicans (обнаруживаются у 80% людей, при иммунодефиците вызывают кандидозы) ДХИ характеризовался более низкими значениями MIC (52±49 мкг/мл), чем все остальные молекулы (MIC 77–116 мкг/мл).
Схожая ситуация наблюдалась и для штаммов бактерии Klebsiella pneumoniae (при иммунодефицитах вызывают внутрибольничные инфекции, в т.ч. пневмонию, сепсис, инфекции мочевыводящих путей, бактериемию, менингит): значения MIC для ДХИ и ПМ составили 32–35 мкг/мл, а для МИ и ФК – 182±170 мкг/мл и 80±77 мкг/мл соответственно.
В то же время по отношению к бактериям Staphylococcus aureus и Streptococcus pneumoniae несколько большим подавляющим действием, чем остальные молекулы, характеризовалась ФК. В случае штаммов Staphylococcus aureus (вызывает внутрибольничные инфекции, пневмонию, менингит, эндокардит, сепсис, кожные инфекции – угревая сыпь, карбункулы, целлюлит) значения MIC для ФК (37±35 мкг/мл) были существенно ниже, чем для остальных молекул (MIC=61–107 мкг/мл). В случае Streptococcus pneumoniae (возбудитель пневмонии, менингита, среднего отита, синусита, эндокардита, септического артрита, перитонита) наименьшие значения MIC (37–31 мкг/мл) отмечены для ФК и ПМ (для остальных молекул MIC=54–88 мкг/мл). Все исследованные вещества в одинаковой степени способствовали торможению роста Pseudomonas aeruginosa (возбудитель внутрибольничных инфекций, в т.ч. вентилятор-ассоциированной пневмонии и сепсиса, MIC=22–47 мкг/мл).
Таким образом, исследование показало слабо выраженное подавляющее действие МИ и его синергистов (ДХИ, ФК, ПМ) в отношении патогенных микроорганизмов (Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumoniae, Candida albicans): значения MIC 20–30 мкг/мл и более (эффективными считают антибактериальные препараты со значениями MIC менее 5 мкг/мл). Все же эти эффекты ДХИ, МИ и других молекул могут способствовать коррекции микробиома, оказывая слабое подавляющее действие в отношении патогенных микроорганизмов и стимулирующее действие в отношении представителей здоровой микробиоты.
Заключение
Инозитолы и их микронутриентные синергисты могут проявлять пребиотические свойства, т.е. поддерживать рост нормальной микробиоты кишечника. Наибольшим вкладом в поддержку нормальной микробиоты вносил МИ, за ним следовали ДХИ и ФК. Результаты хемомикробиомного анализа исследованных молекул у добровольцев с различными профилями микробиома подтвердили, что МИ и его синергисты не способствуют росту патогенной флоры и могут тормозить рост патогенных микроорганизмов.
На основании этих данных можно сделать вывод, что средство, содержащее МИ, ДХИ, ПМ и ФК, может применяться для поддержания здорового микробиома, а также при различных дисбиозах ЖКТ, например, ассоциированных с инсулинорезистентностью или избыточной массой тела. В настоящее время в России зарегистрирован витаминно-минеральный комплекс «Дикироген» (свидетельство о государственной регистрации RU.77.99.88.003.R.003342.09.21 от 03.09.2021 г.), в составе которого МИ (1000 мг) и ДХИ (200 мг), ПМ (5 мг) и ФК (200 мкг). Дикироген рекомендован при нарушениях менструального цикла, предменструальном синдроме, гиперандрогении, для предгравидарной подготовки, а также при повышенной массе тела и инсулинорезистентности. Может применяться, в том числе, у беременных женщин по согласованию и под наблюдением врача.



